Si vous souhaitez connaître l’essentiel sur les probiotiques et les prébiotiques, leurs intérêts et comment les utiliser, c’est par ici !
Nous commençons tout juste à découvrir les propriétés essentielles du microbiote intestinal sur notre santé. Il est donc logique de s’intéresser aux moyens permettant d’optimiser la qualité de cette population bactérienne. C’est ainsi que sont apparus sur le marché des compléments alimentaires les probiotiques. Selon l’Organisation Mondiale de la Santé, il s’agit de « micro-organismes vivants qui, lorsqu’ils sont pris en quantité suffisante, peuvent être bénéfiques pour la santé ». La réglementation européenne considérant toutefois le terme de probiotiques comme une allégation nutritionnelle, les laboratoires utilisent désormais des expressions marketing comme ultrabiotiques ou microbiotiques. Pour autant, les propriétés des bactéries aux effets probiotiques sont utilisées depuis des millénaires pour fabriquer des yaourts, du fromage (en particulier à base de lait cru), de la choucroute, du kéfir ou encore de la kombucha (boisson à base de thé fermenté).
Les prébiotiques sont quant à eux des fibres alimentaires utilisées par les bactéries pour favoriser leur développement. Bien que de nombreux compléments alimentaires soient proposés (à base d’inuline, de chicorée, de GOS, de FOS, etc.), une alimentation riche en fibres (fruits, légumes, légumineuses, produits céréaliers complets, etc.) représente à mon sens la priorité et la meilleure façon de nourrir votre microbiote. Toutefois, ces fibres étant plus ou moins bien tolérées au niveau intestinal, en cas de sensibilité, je vous conseille une consommation progressive de fruits et légumes cuits, de légumineuses trempées au moins 12h et bien cuites et mastiquer +++. Attention également aux légumes reconnus pour leur activité dite bifidogène (artichauts, potirons, salsifis, panais, topinambours, ail, poireaux, oignons, chicoré, froment, etc.) et aux bananes vertes.
Les symbiotiques sont des associations de pré- et de probiotiques.
Les postbiotiques sont des molécules produites par les bactéries à l’activité probiotique et pouvant exercer un effet spécifique bénéfique.
Les psychiobiotiques sont des probiotiques utilisées pour réguler l’humeur et le fonctionnement cérébral.
Dans quelles situations avoir recours aux probiotiques ?
Les études analysant les effets des probiotiques sous forme de complément alimentaire sont de plus en plus nombreuses et permettent de leur attribuer les propriétés suivantes :
- Amélioration des fonctions de la barrière intestinale (peu d’études encore disponibles pour confirmer leurs effets positifs pour lutter contre l’hyperperméabilité de l’intestin),
- Modulation positive de l’immunité,
- Effet barrière contre les agents pathogènes (bactéries et levures comme Candida albicans notamment),
- Amélioration des troubles digestifs fonctionnels (troubles du transit),
- Régulation de la production de neuromédiateurs intestinaux,
- Amélioration de la digestion du sucre du lait, le lactose,
- Réduction de l’assimilation de cholestérol alimentaire.
Au quotidien, des milliers de thérapeutes utilisent les probiotiques dans les situations suivantes :
- Post-antibiothérapie,
- Troubles fonctionnels intestinaux et syndrome du côlon irritable : diarrhées, constipations ou alternance de l’un et de l’autre, ballonnements, gaz, douleurs intestinales, etc.
- Maladies inflammatoires chroniques intestinales (MICI) : maladie de Crohn, rectocolite hémorragique.
- Candidose : infection à Candida albicans.
- Maladies auto-immunes ou inflammatoires extra-digestives.
- Stéatose hépatique non-alcoolique, également qualifiée de syndrome NASH ou maladie du soda lorsque cette pathologie atteint le stade inflammatoire.
- Dépression, anxiété : le terme utilisé pour qualifier les effets des probiotiques sur l’humeur est psychobiotique.
Comment utiliser les probiotiques ?
La durée minimale conseillée est d’un mois, notamment en cas de troubles digestifs. Elle peut être plus importante, à minima 3 mois dans les autres cas, puis suivie d’une utilisation régulière par la suite (tous les 3 jours ou 1 semaine par mois ou au moins pendant 1 mois 2 fois par an). La fréquence peut être adaptée selon votre propre ressenti digestif.
A consommer au moins 15 min avant le petit déjeuner, afin de permettre aux bactéries de passer le tractus digestif à jeun. Les bactéries à l’activité probiotique étant vivantes et constituées de protéines, il est important d’éviter la présence d’enzymes digestives, notamment de protéases, secrétées au cours d’un repas. Vous pouvez par exemple les préparer sur votre table de chevet de façon à les avaler au réveil.
Conserver vos probiotiques au réfrigérateur. Les bactéries sont en effet très sensibles aux élévations et aux variations de température. Les laboratoires commercialisant ces produits sont censés avoir réalisé des études de stabilité à température ambiante afin de garantir la quantité de probiotiques tout au long de la durée de vie du produit commercialisé. Toutefois, plus la conservation se réalisera au frais (T° < 4°c), plus grandes seront les chances d’obtenir un produit riche en bactéries résiduelles. Certains laboratoires sont malheureusement peu sensibles à cette précaution, pourtant déterminante…
Comment choisir un probiotique ?
- S’assurer de quantités suffisantes. Bien qu’il n’existe pas de quantité définie par la littérature scientifique, en termes d’usage, 10 milliards par jour est un minimum pour en espérer un effet significatif, bien que certaines personnes puissent ressentir un bénéfice avec des quantités moindres (justifiant ainsi d’autant plus l’utilité des probiotiques chez elles). En cas d’infections chroniques pouvant nécessiter une prise prolongée d’antibiotiques, de maladies inflammatoires chroniques ou auto-immunes, je recommande très souvent un minimum de 40 milliards de bactéries par jour, voire plus de 100 milliards. Une telle quantité peut apparaitre vite coûteuse au regard du prix des produits. Je vous ai donc indiqué des produits qualitatifs mais au demeurant plus économiques car dosés à 25 milliards par gélule. Les souches sélectionnées sont alors souvent plus communes et moins documentées mais peuvent demeurer intéressantes dans une telle situation.
- Varier les souches, donc les produits. Il n’existe à ce jour aucune étude clinique contrôlée et indépendante de tout laboratoire permettant de garantir une efficacité significative d’une souche à long terme et au sein de l’ensemble des microbiotes intestinaux de la population. Un même produit, conseillé auprès de deux personnes pour la même indication, peut exercer des effets différents. A titre d’exemple, certaines souches vont accélérer le transit chez des personnes et le ralentir chez d’autres. Ainsi, plus vous diversifierez la nature des probiotiques, plus vous favoriserez l’implantation partielle de bactéries complémentaires à votre propre microbiote. Mon conseil clé est simple : testez différents produits et variez les marques.
- Sélectionner des souches possédant une capacité optimale de résistance à l’acidité gastrique et d’adhésion à la muqueuse intestinale. Les bactéries possèdent en effet une gastro-résistance plus ou moins importante, de même qu’une capacité d’adhésion à la muqueuse intestinale très variable. Un laboratoire sérieux doit être en mesure de vous justifier le choix de ses souches en ce sens. A noter qu’il existe des marques proposant des ingrédients dits micro-encapsulés pour tenter d’accroitre la résistance à l’acidité de l’estomac. Toutefois, la priorité demeure le choix de la souche, ce d’autant plus que la supériorité technologique de la micro-encapsulation n’a pas encore été parfaitement établie.
- Optimiser la stabilité du produit. Pour ce faire, choisir des produits dont l’imperméabilité à l’air est maximale tout au long de la durée de vie. Le critère permet de quantifier l’humidité est l’Aw : plus il est faible, mieux c’est. La protection par l’aluminium, sous forme de sachets ou de gélules sous blister, est optimale pour la stabilité du produit (bien que ce conditionnement soit loin d’être idéal au niveau environnemental). La vente en piluliers est inadaptée. Pour la même raison, l’utilisation de gélules végétales apparait plus adaptée que les gélules à base de gélatine, mais surtout que les comprimés. En effet, la fabrication d’un comprimé nécessite par définition une compression, altérant ainsi fortement la viabilité du produit. Enfin, l’ensemble de la formulation du produit est important, notamment le choix des excipients. Le recours à de l’amidon de pomme de terre est par exemple intéressant (à condition de tolérer ce tubercule bien entendu. De nombreuses personnes souffrant d’hyperperméabilité intestinale ont intérêt à l’éviter du fait de la présence de solanacées). A noter que l’amidon ou les maltodextrines de maïs non transgéniques garantissent globalement de bons résultats.
Que penser des probiotiques ?
Aussi efficaces soient-ils, au moins en termes de ressenti par la personne en consommant, les effets de ces probiotiques ne sont à ce jour pas avérés sur le long terme. Leur capacité à persister dans le microbiote intestinal varie en effet de manière très importante selon chaque individu et en fonction des souches utilisées. Par ailleurs, même s’il existe de nombreuses souches étudiées (essentiellement par les fabricants de ces bactéries pour les laboratoires), à l’image du LGG ®, La-5 ®, Bb-12 ® ou encore L.gasseri, la variabilité de chaque microbiote est telle qu’il est encore précoce d’affirmer que ces dernières exercent un effet universel. De plus, les études analysent essentiellement les propriétés des probiotiques chez des personnes souffrant de troubles spécifiques, celles concernant les effets en cas de microbiote initial équilibré sont encore peu nombreuses et amènent à une certaine prudence.
Une solution d’avenir pour tenter d’équilibrer et de diversifier le microbiote est indéniablement la transplantation de matière fécale (TMF), de plus en plus étudiée et utilisée. Historiquement proposée en cas d’infection persistante à Clostridium difficile, la TMF fait l’objet de nombreuses recherches et applications pour lutter contre les maladies inflammatoires chroniques de l’intestin (MICI), la stéatose hépatique non alcoolique (syndrome NASH), l’obésité, les maladies cardiovasculaires, l’autisme, l’arthrite inflammatoire ou encore la sclérose en plaques. De même, l’utilisation des bactériophages, des virus en mesure de contrôler l’activité des bactéries du microbiote intestinal, est une autre piste thérapeutique importante, bien que délaissée par la plupart des laboratoires car non brevetable. Les patients souhaitant accéder à ces phages doivent aujourd’hui réaliser une forme de tourisme thérapeutique en Europe de l’Est, notamment en Géorgie.
Si vous souhaitez désormais découvrir en détails le sujet des probiotiques, c’est par ici !
Si vous vous intéressez un minimum à la nutrition, il est fort probable que vous ayez entendu parler des « probiotiques », ces bactéries qui ont supplanté la prescription d’ultra-levure de la part des médecins à la suite d’une prise d’antibiotiques. A l’inverse de ces derniers, probiotiques signifie pour la vie. Il s’agit en effet de bactéries vivantes proposées dans des aliments ou des compléments alimentaires, à l’instar de la fameuse bouteille Actimel de Danone. Si l’on se réfère à une définition plus technique, les probiotiques sont des « micro-organismes vivants qui, lorsqu’ils sont pris en quantité suffisante, peuvent être bénéfiques pour la santé » 1. L’organisation mondiale de gastroentérologie et l’autorité européenne de sécurité des aliments (EFSA) confirment cette définition initiée par l’Organisation mondiale de la santé (OMS) en 2012 2. En matière de probiotique, la notion de quantité est importante, nous y reviendrons. Elle est exprimée en nombre d’unités formant colonies (UFC) par portion. Selon Santé Canada et le ministère italien de la Santé, les UFC minimales à considérer pour qualifier un produit de probiotiques sont de minimum d’un milliard (1 x109 UFC) 1. Les deux autres critères nécessaires pour confirmer cette appellation sont la proposition de ces bactéries sous une forme vivante et ayant démontré des effets sur la santé.
Le terme de probiotiques est sujet à discussion en France et en Europe. En effet, les instances de régulation réglementaire (DGCCRF, Commission Européenne) considèrent actuellement que ce mot est une allégation non justifiée, à savoir une promesse nutritionnelle pouvant induire le consommateur en erreur. Les laboratoires développent donc des noms permettant de communiquer avec des termes plus séduisants que « ferments lactiques » par exemple. Mais tout ceci n’est au final que du… marketing !
Quels sont les aliments riches en probiotiques ?
Il existe de nombreux aliments contenant des bactéries. La lacto-fermentation représente d’ailleurs une méthode de conservation des aliments bien connue de nos ancètres. Elle contribue à la formation d’alcools et de composés bactéricides, diminue le pH, la quantité de facteurs anti-nutritionnels, améliore la digestibilité des glucides et des protéines. Ce procédé contribue également à développer de nombreux composés aromatiques et certains nutriments (notamment les vitamines du groupes B : thiamine, niacine et riboflavine3). Dès 2000 ans avant JC, les concombres étaient ainsi conservés au Moyen-Orient. Le kimchi, chou fermenté coréen, serait né par la fermentation naturelle des légumes desséchés dans l’eau de mer 4. Plusieurs méthodes de fermentation peuvent être utilisées : alcoolique (à partir de levures), frappée (fermentation partielle) ou malolactique (à partir de bactéries lactiques) 5. Les produits laitiers représentent la source principale d’aliments consommés sous forme fermentée, notamment de yaourts et de fromages 6. Toutefois, la lacto-fermentation est de plus en plus valorisée à travers des aliments véhiculant une image de santé et de bien-être, à l’image des légumes lacto-fermentés (choucroute, pickles, cornichons, carottes, choux, etc.), de la kombucha (boisson à base de thé fermenté), du kéfir de lait et de fruit ou encore des kimchi.
Les fromages au lait cru sont reconnus pour leur gout prononcé et leur texture particulière7. Cette propriété est due à un environnement bactérien particulièrement riche8 et à une présence plus importante d’enzymes comparativement aux fromages réalisés avec du lait pasteurisé 9–11.
En matière de santé, les micro-organismes contenus dans le fromage au lait cru peuvent s’avérer bénéfiques, à l’image des lactobacilles et des bifidobactéries12 mais aussi pathogènes (ex. Listeria, Salmonella, Escherichia coli, Campylobacter, mycotoxines, etc.), en particulier du fait d’une antibio-résistance consécutive à la présence de résidus d’antibiotiques dans le lait 13.
Il est toutefois délicat de parler de probiotiques pour ces aliments dans la mesure où il existe également de nombreux composés produits par la fermentation potentiellement bénéfiques pour la santé, indépendamment de la présence des bactéries 1,14. Sans compter sur le fait que certaines marques agro-alimentaires profitent de la mode des probiotiques pour enrichir leurs produits en bactéries mais dans des quantités non significatives, produits par ailleurs riches en acides gras saturés et/ou en sucres ajoutés (à l’image d’Actimel contenant plus de 10g de sucre par petite bouteille) 6,15. Je vous invite donc à conserver un regard critique sur ces fameuses promesses nutritionnelles…
Le kombucha, boisson fermentée originaire d’Asie, bénéficie d’une visibilité et d’une popularité grandissante, notamment en raison des nombreux bénéfices « santé » qui lui sont attribués. Mais qu’en est-il vraiment ?
La kombucha est issue de l’activité d’un consortium de micro-organismes composé de bactéries principalement acétiques et de levures, dans un milieu liquide classiquement composé d’extrait de thé sucré. Il n’existe pas de « culture unique » mais une grande variété de compositions microbiennes.
- Si vous souhaitez réaliser vous-même votre kombucha, voici la recette : Une base de thé vert ou thé noir (type Pu’er) ;
- Ajouter une quantité d’environ 50 g de sucre / litre 16 ;
- Les cultures de kombuchas sont ensuite ajoutées (mère et starter) afin de lancer la fermentation ;
- La durée de fermentation varie selon le gout souhaité. Elle est généralement comprise entre 7 (goût plus doux) et 20 jours (goût plus vinaigré).
Voici les grands principes de la fermentation :
- A température ambiante, le sucre ou saccharose introduit dans l’infusion est transformé par les levures en fructose et glucose ;
- Ces sucres sont alors convertis en éthanol (dans le cadre de la fermentation alcoolique) ;
- Le mélange étant en contact avec l’air, les bactéries acétiques utilisent le glucose et l’éthanol disponibles pour produire des acides organiques 17,18, à savoir l’acide acétique issu principalement de l’oxydation de l’éthanol et l’acide gluconique provenant de la transformation du glucose19 ;
- L’acidification du milieu entraîne la diminution du pH, passant rapidement en dessous de 3,5 et prévenant ainsi le développement de flores pathogènes 20 ;
- Se forme une masse gélatineuse composée de cellulose produite par certaines bactéries acétiques, plus particulièrement Komagateibacter xylinus 21 ;
- Lors de la mise en bouteille, l’absence d’oxygène favorise la fermentation alcoolique par les levures utilisant les sucres résiduels et menant à la production d’alcool et de gaz carbonique ;
- Vous voici en possession d’une boisson acidulée gazeuse « santé » !
Que contient la kombucha ?
L’analyse de nombreuses kombuchas en laboratoire a montré la présence de composés nutritionnellement intéressants tels que 22 :
- Les acides organiques (essentiellement les acides acétique, gluconique, glucuronique (GlcUA)23,24) et l’acide D-saccharique 1,4-lactone (DSL) 25 ;
- Des vitamines hydrosolubles (B1, B2, B6, B12, C) 26 ;
- Des enzymes ;
- Des antioxydants issus du thé (catéchines et flavonoïdes) ;
- Des populations de micro-organismes (bactéries acétiques, lactiques et levures), dont les proportions et concentrations dépendent du mode opératoire utilisé dans la fabrication de la boisson.
Extrait de Leal et al, 2018 22
De nombreuses études in vitro et in vivo se sont penchées sur les effets du kombucha en matière de santé. Il en ressort l’existence de propriétés anti-oxydantes 28,29, antimicrobiennes 30,31 et hépato-protectrices 32. Cependant, ces conclusions nécessitent d’être à l’heure actuelle confortées par d’autres études, notamment chez l’homme 22,33.
En conclusion, la kombucha représente une boisson désaltérante à teneur limitée en sucre, soit une alternative intéressante à toutes les boissons sucrées industrielles. Fabriquées de manière optimale et consommées avec modération, elle s’intègre donc tout à fait dans une démarche santé !
Merci à Antoine Martin pour sa collaboration autour du sujet de la kombucha. Antoine a fait partie de la seconde promotion de mon cursus professionnel en nutrition. Il a délaissé sa première vie professionnelle pour se lancer dans l’aventure de l’entrepreneuriat de la santé durable grâce à sa marque Jubiles, que je vous invite à découvrir. Si vous me lisez régulièrement, vous savez que je n’ai pas pour habitude de citer des marques, mais la démarche d’Antoine mérite amplement un petit clin d’oeil, autant pour l’intégrité de la démarche que pour la qualité de l’homme qui en est à l’origine.
Au-delà des aliments, le marché des compléments alimentaires dits probiotiques s’est fortement développé au cours de ces dernières années. Il suffit de vous rendre dans une pharmacie ou de taper ce mot sur internet pour constater leur succès. Sont-ils bénéfiques pour la santé ? Inutiles ? Voyons tout ceci.
Quels sont les bénéfices prouvés des probiotiques ?
A ce jour, les principales propriétés attribuées aux probiotiques sont leur capacité à :
- Améliorer les fonctions de la barrière épithéliale* de l’intestin (plus de 300m2),
- Moduler l’immunité 34,35 : Pour rappel, plus de 70% de l’immunité subit une phase de maturité dans l’écosystème intestinal. Cette propriété est connue de longue date. Dès le début des années 1900, le prix Nobel Ilya Ilitch Metchnikoff, attribua d’ailleurs la longévité exceptionnelle des Bulgares à la présence de bactéries présentes dans les yaourts. Selon leur nature, les bactéries probiotiques peuvent en effet stimuler la production de certains messagers de l’immunité (notamment les cytokines IL-2, IL-4, IL-5, IL-10, IL-12, IL-13 et IL-17, TNF-alpha, IFN-gamma) en charge d’orienter la réponse immunitaire en cas d’infection. Certains probiotiques ont la capacité de stimuler la production d’anticorps renforçant l’immunité au niveau des muqueuses (les IgA sécrétoires), notamment pour se protéger d’infections digestives ou extra-digestives telles que les sinusites, les otites ou encore les bronchites. La capacité des probiotiques à réduire les diarrhées infectieuses chez l’enfant a été bien étudiée. La prise de Lactobacillus rhamnosus GG® a notamment démontré des effets positifs, de même en cas d’allergie ou d’eczéma chez le jeune enfant 36. Les probiotiques peuvent également produire des molécules agissant directement contre certains agents infectieux, les bactériocines.
Cette souche probiotique est désormais bien connue dans le milieu du complément alimentaire. Elle a été isolée pour la première fois en 1985 à partir d’échantillons fécaux d’un adulte humain sain par Sherwood Gorbach et Barry Goldin, expliquant ainsi l’appellation « GG » à partir de leurs noms 37.
De nombreux essais cliniques ont examiné l’efficacité du LGG® dans la prévention de la diarrhée associée aux antibiotiques 38–41. Presque tous ont confirmé un effet supérieur au placebo 42. Un essai clinique randomisé, en double aveugle et contrôlé par placebo, mené en 2015 auprès de 72 enfants ayant eu recours à des antibiotiques, a mis en évidence une absence de diarrhée chez le groupe supplémenté, contre six épisodes de diarrhées graves et 21 de diarrhées légères en l’absence de prise de LGG® (associés à d’autres souches, Bifidobacterium lactis Bb-12® et L. acidophilus La-5®). Il n’a toutefois pas été possible d’identifier l’effet isolé du LGG® comparativement à la synergie possible des trois souches utilisées 43. Une analyse de 12 essais randomisés contrôlés, incluant 1 499 patients, a mis en évidence que l’utilisation de LGG® réduisait le risque de diarrhée associée aux antibiotiques de 22,4 % à 12,3 % chez les patients traités par antibiotiques 44. Cette souche semblerait également réduire les risques de rechute de diarrhées à la suite d’une infection à Clostridium difficile 45–48, bien que les échantillons de patients recrutés aient été trop faibles pour être significatifs. A noter que certaines études ne démontrent pas d’effets spécifiques positifs de cette souche 49–51, notamment en comparaison d’autres probiotiques tel que Lactobacillus helveticus R0052® 52,53.
Le lien possible entre LGG® et allergies alimentaires est de plus en plus étudié. Un grand nombre d’études cliniques et de méta-analyses ont été publiées sur ce sujet, aux résultats contradictoires du fait de méthodologies et/ou de choix de souches différents 54–61. L’administration prénatale et postnatale de fortes doses de LGG® semble être l’approche la plus prometteuse, en particulier pour réduire les risques allergiques dits atopiques 62. A noter qu’il a été mis en évidence une augmentation du risque de sensibilisation atopique à la suite de l’administration de Lactobacillus acidophilus AD031® 62.
- Produire des neuromédiateurs et moduler l’information nerveuse. J’ai eu l’occasion de développer les moyens de communication existant entre le système nerveux entérique (présent dans l’intestin) et le système nerveux central (du cerveau). L’un d’entre eux correspond à la transmission d’une information à travers la production de peptides bactériens ou la stimulation de médiateurs produits par l’organisme.
- Exercer un effet positif de compétition envers les agents pathogènes (bactéries ou levures notamment) en limitant la capacité de ces derniers à persister dans l’intestin 63,64. Les probiotiques peuvent également contribuer à réduire la virulence des agents pathogènes.
- Favoriser la digestion de certains sucres comme le lactose issu du lait. En cas de déficit en lactase (l’enzyme produite par l’organisme humain pour digérer ce sucre et dont un manque se traduit par des inconforts digestifs, voire des diarrhées), les bactéries vont « prendre le relais » et ainsi favoriser la tolérance digestive au lactose. C’est d’ailleurs la raison pour laquelle une personne intolérance au lactose, donc ne digérant pas bien le lait, peut malgré tout consommer des yaourts artisanaux ou du fromage.
- Réduire la solubilisation des sels biliaires, pouvant ainsi limiter l’assimilation du cholestérol 65–67.
- Réduire les troubles digestifs reconnus sous le terme du syndrome du côlon irritable (IBS), bien que les résultats apparaissent très hétérogènes selon les symptômes ressentis 68–70.
Il existe à ce jour encore peu d’essais cliniques permettant de caractériser l’impact des probiotiques sur la perméabilité intestinale, menées chez l’homme de manière rigoureuse et indépendante de tout laboratoire. A titre d’exemple, un essai clinique contrôlé randomisé a été réalisé chez 59 enfants ayant reçu du Lactobacillus rhamnosus (1 x 109 UFC) ou un placebo pendant 4 semaines pour déterminer l’effet de ce probiotique sur la perméabilité intestinale, mesurée en calculant le rapport lactulose/mannitol. Aucune différence significative n’a été constatée 71.
Quelques études menées sur des animaux suggèrent l’effet bénéfique de certaines souches probiotiques. Chez des souris, l’administration de 1 x109 UFC de Lactobacillus acidophilus, Bifidobacteria et Streptococcus thermophilus a mis en évidence une meilleure « vitalité » des cellules intestinales (à savoir une plus grande hauteur des villosités et profondeur des cryptes, un nombre de cellules plus important, une meilleure mitose et prolifération cellulaire) au niveau du jéjunum. Chez l’homme, les résultats sont difficilement comparables en raison de la taille des échantillons et de l’hétérogénéité de la méthodologie utilisée pour évaluer l’adaptation intestinale. Une étude a mis en évidence une amélioration de la qualité des selles chez deux nourrissons atteints de surcroissance de bactéries intestinales (également connue sous le terme de SIBO) à la suite de l’apport de 1 x 1010 UFC de Lactobacillus plantarum 299V® pendant 23 semaines72. Ce résultat a été confirmé par deux autres études 73,74. Plusieurs études mettent toutefois en évidence une réduction des diarrhées faisant suite à la prise d’antibiotiques en cas de supplémentation en probiotiques 75–78
Toutefois, l’identification de la bactérie impliquée (à savoir la souche, le genre et l’espèce auxquels elle appartient : par exemple sous la marque Bb-12® est connue sous le nom Bifidobacterium animalis Lactis DSMZ 15954) et la dose (UFC au moment de la consommation du produit) sont essentielles pour caractériser ces propriétés.
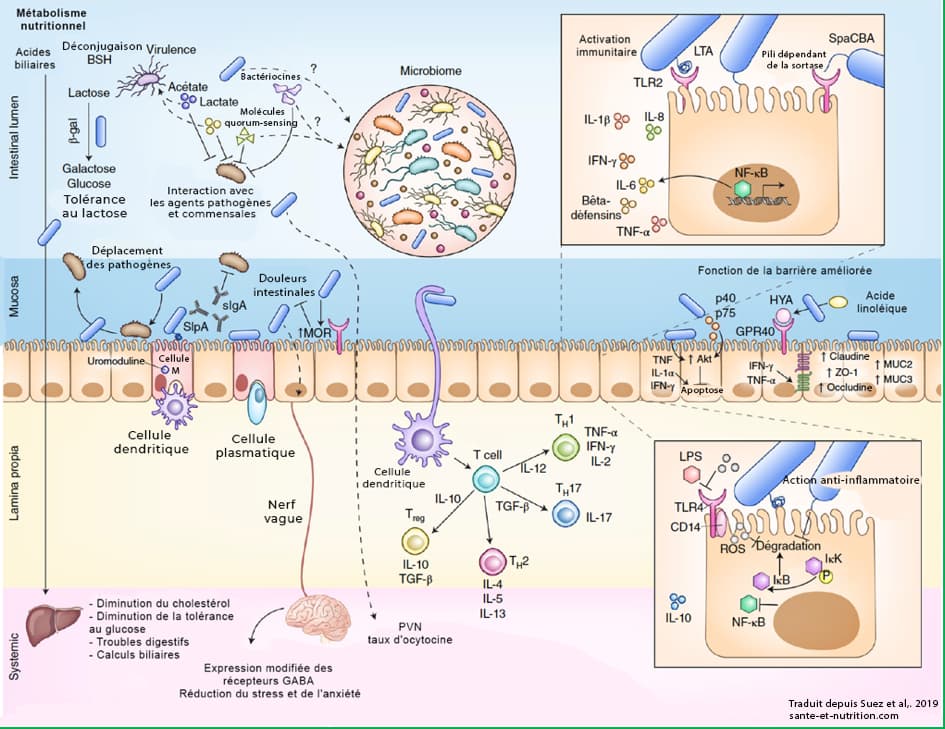 Interactions entre les probiotiques, l’hôte et le microbiote, traduit depuis Suez et al,. 201979
Interactions entre les probiotiques, l’hôte et le microbiote, traduit depuis Suez et al,. 201979
Il a été suggéré que les probiotiques pourraient inhiber la colonisation des agents pathogènes en s’attachant aux cellules de la muqueuse intestinale et en bloquant physiquement leur capacité d’adhésion (voir schéma ci-dessus). Cette action a été mise en évidence In vitro 80 et chez l’animal 81.
Plusieurs mécanismes sont envisagés, notamment la régulation de cytokines (IL-8, IL-1β et TNF-α) 82, la production d’acétate inhibant des bactéries comme E. coli 83 et de bactériocines aux propriétés antimicrobiennes 84 .
| Souches | Effets | Référence |
| L. salivarius UCC118 | Production de bactériocines chez la souris | Corr Sc et al,. 200785 |
| L. acidophilus La-5® | Réduction de l’expression de certains facteurs de virulence de E. coli in vitro |
Medellin-Peña et al,. 201686 |
| L. acidophilus GP1B | Amélioration de la survie à Clostridium Difficile chez la souris | Yun et al,. 201487 |
| L. reuteri RC-14® | Diminution de la virulence de Staphylococcus aureus (staphylocoque doré) chez la souris |
Tuffs et al,. 201888 |
Ces propriétés sont toutefois à relativiser pour plusieurs raisons. Non seulement ces résultats sont obtenus In vitro, ils ne peuvent donc pas être extrapolés In vivo, mais de plus les mécanismes à l’origine de la modulation de la population bactérienne peuvent également s’appliquer au microbiote bénéfique pour la santé 87–89
Les probiotiques sont-ils efficaces à long terme ?
Au-delà de leur efficacité immédiate, la vraie question de fond est de savoir si la prise de probiotiques peut exercer un effet bénéfique sur la santé au terme de la cure de supplémentation et si oui, pendant combien de temps. Rien n’est bien clair. Au regard des données disponibles chez l’homme, il apparait en effet que l’excrétion détectable de probiotiques dans les échantillons de selles diminue suite à l’arrêt du traitement, notamment concernant les genres Bifidobacterium infantis, Bifidobacterium animalis lactis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus johnsonii La1, Lactobacillus plantarum, Lactobacillus reuteri, Lactobacillus rhamnosus et Lactobacillus salivarius 90. A noter toutefois que, dans la plupart des études, le suivi se limite à une ou deux semaines post-supplémentation. Les études analysant les effets sur une période plus longue suggèrent une persistance variable selon la souche et l’individu. Par exemple, deux mois après l’arrêt de la supplémentation, L. rhamnosus n’est détecté que chez une personne sur dix 91 alors que dans le cas de B. longum, un tiers des consommateurs ont continué à éliminer des souches issues des probiotiques jusqu’à 6 mois après 90,92.
Pour cette raison, la prise de probiotiques sous forme de compléments alimentaires mérite d’être poursuivie régulièrement après une cure afin de maintenir une action résiduelle. Selon l’indication et la sensibilité individuelle, elle peut être réalisée un jour sur trois ou une semaine par mois par exemple. Dans tous les cas, je conseille à toutes les personnes ayant constaté un effet bénéfique de la prise de probiotiques de maintenir une cure d’un mois au moins deux fois par an.
Il est essentiel de comprendre que, contrairement à ce que vantent de nombreux laboratoires, les probiotiques ne rééquilibrent pas le microbiote. Ils assurent “simplement” un apport ponctuel et transitoire de bactéries pouvant exercer un effet potentiellement bénéfique sur l’écosystème intestinal. Seule la transplantation fécale peut moduler en profondeur les populations bactériennes.
Considérée pendant longtemps comme une pratique peu sérieuse du fait de sa représentation, la transplantation microbienne fécale (TMF) représente pourtant un outil thérapeutique d’avenir. Elle s’avère d’ailleurs particulièrement efficace pour éradiquer les infections à Clostridium difficile résistantes aux traitements conventionnels dans 95 % des cas 93,94. La transplantation fécale augmente notamment la diversité du microbiote et la résistance à la colonisation intestinale par les bactéries pathogènes. En quelque sorte, elle introduit des agents « sains » dont les propriétés sont essentielles pour maintenir l’intégrité de la muqueuse intestinale, limiter son hyperperméabilité et réduire l’inflammation, autant locale que systémique. A noter qu’elle modifie également le métabolisme des acides biliaires 95–97.
La transplantation fécale est de plus en plus étudiée pour lutter contre de nombreuses pathologies dont un lien avec une perturbation du microbiote intestinal a été mis en évidence : maladies inflammatoires chroniques de l’intestin (MICI), obésité, maladies cardiovasculaires, autisme, arthrite inflammatoire ou encore sclérose en plaques 98–101. Il n’existe toutefois à ce jour pas encore de résultats homogènes dans la mesure où les protocoles sont bien souvent différents (nombre de transplantations effectuées, méthodes et modalités de préparation, caractéristiques du donneur, etc.) 71,72.
Présentation d’indications établies et potentielles pour la transplantation microbienne fécale 102
Dans le cas de la maladie de Crohn, les résultats apparaissent hétérogènes 73–76. Cette maladie semble en effet moins sensible à la transplantation fécale que la colite ulcéreuse par exemple, sauf dans une étude concluant à une rémission prolongée de la maladie chez certaines personnes 78. La transplantation nécessite toutefois un pré-traitement antibiotique et anti-inflammatoire spécifique dans la plupart des cas 103.
Effets cliniques attendus des principales souches probiotiques 104,105
| Syndrome | Probiotique | Effets |
| Diarrhée | LGG®, Saccharomyces boulardii, L. reuteri SD2112, L. casei DN114 G01, L. bulgaricus, S. thermophilus |
Réduction des diarrhées |
| Entérite | VSL#3, L. acidophilus | Prévention de la diarrhée radio-induite |
| Colite ulcéreuse | Escherichia coli Nissle, VSL#3 |
Prévention et rémission plus rapide |
| Maladie de Crohn | E. coli Nissle, S. boulardii, LGG® |
Amélioration des symptômes et diminution de la perméabilité intestinale |
| Stéatose hépatique non alcoolique |
VSL#3, combination of L. plantarum, L. delbrueckii subsp. bulgaricus, L. acidophilus, L. rhamnosus, Bifidobacterium bifidium, S. thermophilus, Bifidobacterium longum |
Réduction de la graisse hépatique, diminution des transaminases et de l’inflammation |
En 2006, des scientifiques de l’université de Louvain, sous la direction du Pr Cani, ont constaté la présence d’une bactérie, jusqu’alors inconnue, en très forte quantité dans le microbiote de souris sveltes à l’inverse de celles en surpoids, la concentration étant alors 100 fois moins importante chez ces dernières : Akkermansia muciniphila106,107.
Ils ont donc tenté l’expérience logique d’introduire cette bactérie chez les souris en surpoids, le résultat fut alors sans appel : elles maigrirent. Selon le chercheur André Marette, ces bactéries pourraient se développer grâce à la consommation de petites baies riches en antioxydants, les polyphénols. A l’inverse, chez les personnes souffrant d’obésité du fait d’une carence en leptine 108,109 ou ayant suivi un régime riche en graisses saturées et en sucres 110,111, Akkermansia muciniphila ne pourrait se développer de manière optimale du fait d’une moindre épaisseur du mucus intestinal 112. Les études réalisées chez l’homme n’apparaissent malheureusement pas aussi concluantes que les chercheurs l’espéraient 112–117. Très rapidement, le microbiote intestinal reprend le dessus sur Akkermansia muciniphila 118. Même si la qualité du microbiote joue un rôle essentiel dans la gestion du poids, ce n’est donc pas encore pas via la bactérie miracle que réside la solution à l’obésité.
Lactobacillus gasseri
D’autres espèces bactériennes ont été étudiés pour tenter de trouver une solution à l’épidémie d’obésité, notamment Lactobacillus gasseri (LG2055). Cette souche semble inhiber l’augmentation des cellules adipeuses viscérales (à l’origine d’un risque cardiovasculiare accru) et réduire l’inflammation associée à l’obésité 119–123.
Lactobacillus reuteri
Lactobacillus reuteri est nommé d’après Gerhard Reuter, un microbiologiste allemand ayant passé la majeure partie de sa carrière à tenter de comprendre le microbiote intestinal humain 124. Les bactéries de l’espèce Lactobacillus reuteri sont des micro-organismes à gram-positif, de type anaérobie. Ces bactéries sont particulièrement efficaces pour produire des nutriments telles que les folates et la vitamine B12 125. Mais cette espèce est surtout connue pour produire un composé spécifique, la reuterine. Il s’agit d’un puissant antimicrobien affectant autant les bactéries que les champignons 126. Lactobacillus reuteri est donc considéré comme un probiotique prometteur pour lutter contre de nombreuses infections. Une série d’études récentes menées chez la souris ont par ailleurs mis en évidence une cicatrisation rapide, une prévention de l’obésité et une augmentation du taux de testostérone chez les souris âgées 127–129.
Dans quels cas peut-on utiliser les probiotiques ?
Indépendamment des effets documentés dans la littérature scientifique, les probiotiques peuvent trouver un intérêt dans de nombreux situations pratiques au regard des retours d’expérience de milliers de thérapeutes :
- Troubles fonctionnels intestinaux : diarrhées, constipations ou alternance de l’un et de l’autre, ballonnements, gaz, douleurs intestinales, etc.
- Maladies inflammatoires chroniques intestinales (MICI) : maladie de Crohn, rectocolite hémorragique.
- Candidose : infection au Candida albicans.
- Maladies auto-immunes ou inflammatoires extra-digestives.
- Stéatose hépatique non-alcoolique, également qualifiée de syndrome NASH ou maladie du soda lorsque cette pathologie est au stade inflammatoire.
- Dépression, anxiété : le terme utilisé pour qualifier les effets des probiotiques sur l’humeur est psychobiotique.
Après les probiotiques, les prébiotiques, les symbiotiques (association de pré- et probiotiques) et les post-biotiques(molécules produites par les probiotiques et pouvant posséder un effet spécifique bénéfique), j’ai l’honneur de vous présenter les psychobiotiques. Ce terme désigne des probiotiques ou des prébiotiques qui, lorsqu’ils sont ingérés, procurent des bienfaits sur la santé mentale grâce à leurs interactions avec les bactéries intestinales 130.
| Maladie | Psychobiotique | Espèce | Effets comparé au groupe témoin | Référence |
| Alzheimer | Prébiotiques : Chitosans Oligosaccharide | Souris (n = 12) | ↑Fonction cognitive ↓cytokines pro-inflammatoires | Shiliang et al,. 2016 131 |
| Sclérose latérale amyotrophique (SLA ou maladie de Charcot) | Prébiotique :
Galacto-oligosaccharides |
Souris (n = 12) | ↓Mort des motoneurones ↑Taux de folates et vitamine B12, ↑Homocystéine | L.Song et al,. 2013132 |
| Autisme | Probiotique : Bacteroides fragilis | Souris (n = 75) | ↑Fonction de la barrière intestinale ↓Cytokines pro-inflammatoires (Il-6) ↓Anxiété ↓Comportement répétitif ↑Communication | Elaine Y et al,. 2013133 |
| Anxiété | Prébiotiques : bimuno-galacto- oligosaccharides (B-GOS) | Souris (n = 15) | ↓Cytokines pro-inflammatoires (Il-1b) | Helene M.Savignacet al,. 2016134 |
De nombreuses marques proposent des souches spécifiques selon l’indication, bien souvent brevetées car ayant fait l’objet d’études financées par le laboratoire. C’est ainsi que l’on peut vous proposer un produit A à la suite d’une candidose, un produit B en cas d’inflammation intestinale ou encore un produit C pour lutter contre les infections urinaires. Il ne s’agit pas de remettre ici en question la pertinence de ce conseil car il existe des produits de qualité confirmant les bénéfices attendus. Comprenons toutefois ici que les études réalisées le sont bien souvent dans des conditions expérimentales ne permettant pas de généraliser une telle indication. Elles sont souvent menées In vitro ou non randomisées en double aveugle auprès d’une population significative. Il est par ailleurs impossible d’analyser les effets d’une souche sur un microbiote spécifique dans la mesure où il n’existe pas de colonisation bactérienne universelle de l’intestin. Notre empreinte bactérienne (plus connue sous le terme de microbiome) est unique, donc notre réponse potentiellement différente à la suite de la prise d’une souche spécifique. La notion d’individualisation et de test par l’expérience demeure donc à mon sens essentielle. LA souche idéale n’existe donc pas, bien qu’il soit possible de proposer des bactéries adaptées à notre propre microbiote.
De plus, la majorité des études publiées évoquant l’intérêt des probiotiques se sont uniquement concentrées sur des populations présentant des pathologies spécifiques. Un récent article s’est attelé à compiler les données scientifiques disponibles entre 1990 et 2017 sur les effets possibles de la consommation de probiotiques chez des personnes considérées comme en bonne santé. Les auteurs confirment l’existence d’une amélioration de la qualité du microbiote à la suite de la supplémentation en probiotiques. Néanmoins, ces modifications semblent se limiter à une augmentation transitoire du nombre de bactéries de la souche spécifique administrée 135.
Lorsqu’un fabricant de probiotiques est parvenu à obtenir des résultats valorisables à travers l’étude des effets spécifiques d’une souche, il s’empresse bien souvent de lui offrir un petit nom (Bb-12, LA-5, RC-14, GR, etc.). Cette action va alors lui permettre de proposer la bactérie à un laboratoire de compléments alimentaires à un prix lui aussi fortement valorisé. C’est ainsi que vous pouvez découvrir régulièrement des produits laitiers ou des compléments alimentaires censés disposer de LA souche miracle. Il est essentiel de bien comprendre qu’il existe des enjeux économiques importants via ce marché et que, lorsqu’un fabricant réalise une étude clinique ou préclinique, il attend un retour sur investissement conséquent, comme dans de nombreux autres domaines me direz-vous. Certes. Toutefois, même si cette souche apparait intéressante dans des conditions expérimentales, nous ne savons pas comment elle va réagir dans un microbiote humain à la composition bien complexe, par définition vivant et multiple (pour rappel, plus de 1000 espèces identifiées). Par ailleurs, d’autres souches peuvent s’avérer tout aussi bénéfiques, même si elles n’ont pas fait l’objet d’études spécifiques. C’est ce qui fait la grande différence entre la dénomination générique d’un genre et d’une espèce, par exemple Lactobacillus acidophilus, avec un nom commercial, Lactobacillus Tartempion. Il est certes important de pouvoir caractériser une souche pour en préciser un effet (genre, espèce, nom). Cela ne garantit pas pour autant qu’il s’agira d’une meilleure bactérie que les autres. Le seul avantage de choisir un nom commercial de souche est d’en connaitre les indications cibles et d’en conclure que le laboratoire a vraisemblablement mené une démarche sérieuse en ce sens. Il demeure toutefois difficile pour ne pas dire impossible – de prédire en l’état actuel des connaissances, des effets d’un probiotique sur la santé.
Comment bien choisir et utiliser vos probiotiques ?
Pendant quelle durée prendre des probiotiques ?
En cas de troubles fonctionnels intestinaux, je conseille généralement une cure d’un mois. Concernant les autres situations, elle nécessite souvent davantage de temps, à minima 3 mois, puis une prise régulière par la suite (tous les trois jours ou une semaine par mois ou au moins pendant un mois deux fois par an).
A quel moment prendre les probiotiques ?
Le moment de prise est important : au moins 15 min avant le petit déjeuner, afin de permettre aux bactéries de passer le tractus digestif avant d’initier la digestion. En effet, les probiotiques sont des bactéries vivantes constituées de protéines. La présence d’enzymes digestives, et en particulier de protéases, augmente les risques de perte de viabilité. Vous pouvez par exemple les préparer sur votre table de chevet de façon à les consommer au moment du réveil.
Je vous recommande toutefois de conserver votre boite de probiotiques dans le réfrigérateur afin d’optimiser leur viabilité au cours du temps. Les bactéries sont en effet très sensibles aux élévations et aux variations de température. Les laboratoires commercialisant ces produits sont censés avoir réalisé des études de stabilité à température ambiante afin de garantir la quantité de probiotiques tout au long de la durée de vie du produit commercialisé. Toutefois, plus la conservation se réalisera au frais (T° < 4°c), meilleures seront les chances d’obtenir un produit riche en bactéries résiduelles, indépendant des conditions de conservation. Certains laboratoires sont malheureusement peu sensibles à cette précaution, pourtant déterminante. Les produits que je vous recommande ci-dessous sont réputés pour leur sérieux en matière de production. Ils utilisent par ailleurs des souches ayant fait l’objet d’études cliniques. Même si, comme nous venons de le voir, ces dernières peuvent être critiquables notamment au regard des conditions d’études, elles traduisent une démarche intéressante. En effet, certains laboratoires se contentent d’acheter des probiotiques à des fabricants ou à des façonniers sans même se soucier du choix des souches, des conditions de stabilité ou de l’efficacité du produit fini. Ce qui leur importe demeure le prix de revient et le nombre de souches pouvant être mises en avant sur le packaging. A ce sujet, vous pourrez constater la mention sur certains produits « Nombre de bactéries à la mise en gélule ». Cela signifie alors que le laboratoire n’a pas mené d’études de stabilité suffisantes pour garantir un nombre de bactéries tout au long de la durée de vie du produit.
Voici donc quelques précautions qui devraient vous permettre de faire le tri dans la jungle de ce marché devenu particulièrement lucratif du fait de l’image positive des probiotiques :
- Utiliser des quantités suffisantes. Il n’existe pas de valeur minimale, toutefois au regard des retours d’usage, 10 milliards par jour semblent être le minimum pour en espérer un effet significatif, bien que certaines personnes puissent ressentir un bénéfice avec des quantités moindres (justifiant ainsi d’autant plus l’utilité des probiotiques chez elles). En cas d’infections chroniques, par exemple à la suite de la maladie de Lyme pouvant nécessiter une prise prolongée d’antibiotiques, de maladies inflammatoires chroniques ou auto-immunes, je recommande très souvent un minimum de 40 milliards de bactéries par jour, voire plus de 100 milliards. Une telle quantité peut apparaitre vite coûteuse au regard du prix des produits. Il existe des produits qualitatifs mais au demeurant plus économiques car dosés à 25 milliards par gélule. Les souches sélectionnées sont alors souvent plus communes et moins documentées mais peuvent demeurer intéressantes dans une telle situation. Il existe des marques proposant des quantités encore supérieures (dosé à 40 milliards par gélule) mais le coût rapporté à la dose est totalement injustifié (près de 60€ la boite de 30 gélules !). De même, je vous conseille de varier les souches, donc les produits. Comme j’ai pu le développer précédemment, il n’existe à ce jour aucune étude clinique contrôlée et indépendante de tout laboratoire permettant de garantir une efficacité significative d’une souche à long terme et au sein de l’ensemble des microbiotes intestinaux de la population. Un même produit, conseillé auprès de deux personnes pour la même indication, peut exercer des effets différents. A titre d’exemple, certaines souches vont accélérer le transit chez des personnes et le ralentir chez d’autres. Ainsi, plus vous diversifierez la nature des probiotiques, plus vous favoriserez l’implantation partielle de bactéries complémentaires à votre propre microbiote. Mon conseil clé est simple : testez différents produits et variez les marques.
Une étude a analysé les différences de composition de microbiotes intestinaux de populations asiatiques, européennes et américaines. Les résultats montrent une distinction significative : les parties communes correspondent à des populations bactériennes présentes dans les ethnies concernées, les autres à des bactéries spécifiques. Au total, dix gènes sont spécifiques d’une seule ethnie, huit le sont de deux groupes et sept sont partagés par les trois populations analysées 136.
Cette étude ne permet toutefois pas de savoir si ces différences sont plutôt liées à l’alimentation, au mode de vie ou à des prédispositions génétiques 137.
- Sélectionner des souches possédant une capacité optimale de résistance à l’acidité gastrique et d’adhésion à la muqueuse intestinale. Certaines bactéries possèdent en effet une gastro-résistance plus ou moins importante, de même qu’une capacité d’adhésion à la muqueuse intestinale très variable. Un laboratoire sérieux doit être en mesure de vous justifier le choix de ses souches en ce sens. A noter qu’il existe des marques proposant des produits dits micro-encapsulés pour tenter d’accroitre la résistance à l’acidité de l’estomac notamment. Toutefois, la priorité demeure le choix de la souche, ce d’autant plus que la supériorité technologique de la micro-encapsulation n’a pas encore été parfaitement établie.
- Optimiser la stabilité du produit. Pour ce faire, choisir des produits dont l’imperméabilité à l’air est maximale tout au long de la durée de vie. Le critère permet de quantifier l’humidité est l’Aw : plus il est faible, mieux c’est. La protection par l’aluminium, sous forme de sachets ou de gélules sous blister, est optimale pour la stabilité du produit, bien que ce conditionnement soit loin d’être idéal d’un point de vue environnemental. La vente en piluliers est inadaptée. Pour la même raison, l’utilisation de gélules végétales apparait plus adaptée que les gélules à base de gélatine, mais surtout que les comprimés. En effet, la fabrication d’un comprimé nécessite par définition une compression, altérant ainsi fortement la viabilité du produit. Enfin, l’ensemble de la formulation du produit est important, notamment le choix des excipients. Le recours à de l’amidon de pomme de terre est par exemple intéressant (à condition de tolérer ce tubercule bien entendu. De nombreuses personnes souffrant d’hyperperméabilité intestinale ont intérêt à l’éviter du fait de la présence de solanacées). A noter que l’amidon ou les maltodextrines de maïs non transgéniques garantissent également de très bon résultats.
Et les prébiotiques alors ?
Pour rappel, un prébiotique représente le « casse-croute » du microbiote. En d’autres termes, il s’agit des substrats, plus précisément de résidus alimentaires utilisés par les bactéries intestinales pour favoriser leur développement et exercer un effet bénéfique sur la santé humaine 1. Elles permettent notamment d’améliorer l’assimilation de certains minéraux comme le magnésium ou le calcium, mais également de moduler positivement l’inflammation 138, d’améliorer le profil lipidique 139 et semble contribuer à mieux réguler le diabète de type 2 140.
Les prébiotiques appartiennent à la famille des glucides et plus spécifiquement des fibres alimentaires. On peut ainsi citer les fructanes (les fructo-oligo-saccharides ou FOS, notamment l’inuline), les galactanes (galacto-oligo-saccharides ou GOS présents dans le lait maternel par exemple) ou encore le lactulose obtenu, lui, par synthèse 141 . L’inuline est la source la plus connue. Elle est abondante dans la banane, l’asperge, la racine de chicorée, le pissenlit, l’ail, l’artichaut, le topinambour, le poireau, les oignons, le blé, le seigle ou encore l’orge. D’autres oligosaccharides naturels ou d’origine synthétique sont régulièrement mis en avant (oligosaccharides de soja, lactosucrose, isomalto-oligosaccharides, gluco-oligosaccharides, xylo-oligosaccharides (XOS), ulvans, glucans, etc. 142).
Propriétés de certaines fibres prébiotiques
| Fibres | Nature | Sources alimentaire | Propriétés |
| Cellulose | Son, céréales, céréales, légumineuses, noix, pois. |
Augmente le volume des selles et lutte contre la constipation. |
|
| Hémicellulose | Arabinogalactanes Glucanes Arabinoxylanes Glucuronoxylanes Xyloglucanes Galactomannanes Substances pectiques |
Son, céréales, légumineuses, noix, légumes, fruits. |
Augmente le volume des selles et lutte contre la constipation. |
| β -glucanes | Avoine, orge, seigle | Contribuent à réguler le transit et à réduire les épisodes diarrhéiques. Ralentissent le temps de vidange gastrique. Contribuent à la régulation de la cholestérolémie et de la glycémie. |
|
| Pectines | Fruits, légumes Légumineuses Pommes de terre Betterave |
Contribuent à réguler le transit et à réduire les épisodes diarrhéiques. Ralentissent le temps de vidange gastrique. Contribuent à la régulation de la cholestérolémie et de la glycémie. |
|
| Fructanes | Inuline Oligofructose |
Racine de chicorée, oignon Artichaut, agave,Blé, banane, ail |
Développement des bifidobactéries. |
| Dextrine de blé | Froment | Augmentation des bactéroïdes et prévention contre Clostridium perfringens. |
|
| Psyllium | Coques de graines | Contribuent à réguler le transit et à réduire les épisodes diarrhéiques. Ralentissent le temps de vidange gastrique. Contribuent à la régulation de la cholestérolémie et de la glycémie. |
|
| Gomme de guar | Graines de guar | Contribuent à la régulation de la cholestérolémie et de la glycémie. |
Quelques études réalisées chez l’adulte ont mis en évidence des effets d’une supplémentation en oméga 3 sur la composition du microbiote intestinal. Elles ont notamment constaté une diminution de Faecalibacterium et des Lachnospiraceae, impliqués dans les maladies inflammatoires chroniques. Faecalibacterium prausnitzii semble particulièrement intéressant. Les oméga 3 pourraient donc exercer une action bénéfique sur le microbiote en inversant certaines populations et en augmentant la production de composés anti-inflammatoires tels que les acides gras à chaîne courte 140.
De manière générale, les fibres issues des végétaux (fruits, légumes, légumineuses, produits céréaliers complets) contribuent au développement de la flore dite de fermentation (notamment des bifidobactéries et des lactobacilles). Elles sont donc particulièrement bénéfiques pour notre santé autant que pour celle du microbiote. Néanmoins, les composés produits à la suite de leur utilisation (il s’agit d’acides gras à chaine courte ou moyenne, tels que le butyrate ou le propionate) peuvent être issus d’aliments responsables de ballonnements et de gaz. Le régime FODMAP est un modèle alimentaire visant justement à supprimer l’intégralité des aliments susceptibles de générer une fermentation afin d’assurer un confort digestif optimal aux personnes incommodées. Attention toutefois, ce régime doit être réalisé pendant une courte période (quelques semaines maximum) au risque de perturber fortement l’équilibre intestinal, les bactéries se voyant alors totalement privées de leur nourriture.
En cas de supplémentation en prébiotiques, je vous conseille de les introduire (très) progressivement en fonction de votre sensibilité intestinale. En termes d’efficacité, plus la quantité consommée (mais tolérée) est importante, plus la croissance bactérienne sera conséquente. A titre personnel, je conseille très rarement des prébiotiques sous forme de supplémentation, sauf aux personnes vraiment récalcitrantes à une forte consommation de fruits et légumes et présentant un excès de flore de putréfaction (gaz odorants, consommation importante de protéines animales).
A mon sens, la meilleure source d’apport de fibres prébiotiques demeure l’alimentation.
Mécanisme d’action des prébiotiques 142
Les prébiotiques offrent de nouvelles stratégies pour prévenir et soulager diverses inflammations gastro-intestinales (diarrhée infectieuse, maladie inflammatoire de l’intestin, colite ulcéreuse et syndrome du côlon irritable144). À l’heure actuelle, il n’existe toutefois pas d’étude clinique publiée et menée chez l’homme évaluant leur efficacité sur le syndrome du grêle court. Une petite étude a suggéré que la consommation de pectine chez les patients atteints d’un syndrome du grêle court permettrait d’augmenter la production d’acides gras à chaîne courte (AG-CC) 145.
Grâce à la barrière hémato-encéphalique (également appelée barrière méningée ou BHE), le cerveau a jusqu’à très récemment été considéré comme un organe stérile vis-à-vis des composés toxiques mais aussi et surtout des agents infectieux. On parle d’ailleurs de méningite (virale ou bactérienne) lorsque des agents traversent la barrière pour infecter le liquide céphalo-rachidien.
Néanmoins, un groupe de scientifiques de l’Université de l’Alabama à Birmingham a présenté des résultats suggérant la présence de bactéries dans le liquide céphalo-rachidien de personnes en bonne santé. Plus étonnant encore, ce microbiote est constitué des trois types de populations bactériennes également présentes dans l’intestin 147. Il existe à ce jour peu de données disponibles permettant de confirmer ces premiers résultats, mais la brèche est ouverte !
Alors que nous sommes encore bien loin de déchiffrer tous les mystères du microbiote intestinal, voilà que nous (re)commençons à découvrir de nouvelles données sur une population encore plus complexe, les bactériophages. Il s’agit en réalité d’une population de virus, la plus petite entité connue de l’écosystème microbien humain et colonisent toutes les zones du corps humain, y compris celles que l’on considérait comme stériles jusqu’à peu 148. Environ 100 fois plus importante que les bactéries, la population de phages est la plus importante de la biomasse mondiale. Elle est par ailleurs capable de survivre dans des zones désertiques au sein desquelles la vie est considérée comme impossible.
En matière de santé, les phages possèdent une propriété particulièrement intéressante : ils sont capables d’infecter les bactéries, y compris les plus résistantes aux antibiotiques. Cette découverte représente donc une piste thérapeutique majeure 148. Ces virus sont naturellement présents dans le microbiote humain à hauteur d’environ 109 phages par gramme de fèces (soit 1 000 000 000 par gramme !), voire 1014 dans le gros intestin 149. Au même titre que nos bactéries intestinales, la population de phages, que l’on appelle le phagome intestinal, varie selon chacun d’entre nous et vit dans une dynamique permanente. Il peut donc être perturbé, modulé à la suite de modification alimentaires ou lors d’une maladie 150–152. Les personnes atteintes de pathologies intestinales, de maladies inflammatoires chroniques, d’obésité ou encore de maladie de Crohn présentent par exemple des phagomes discordants 153.
Les phages sont des agents antimicrobiens extrêmement puissants. Ils sont notamment capables de se démultiplier en infectant les bactéries au moyen de virions, mais également d’attaquer les biofilms bactériens 154,155, ces organisations bactériennes leur permettant de résister notamment aux antibiotiques 156,157. Pour cette raison, l’utilisation des bactériophages semble particulièrement efficace en cas d’antibiorésistance. Par ailleurs, au-delà de leurs bénéfices possibles sur la santé humaine156, les phages sont aujourd’hui étudiés pour lutter contre les agents pathogènes de l’environnement agricole et aquacole 154,155,158.
Cette découverte ne date pourtant pas d’hier. Les phages ont en effet été identifiés en 1917 par Félix d’Hérelle, collaborateur de l’Institut Pasteur ayant constaté la disparition du choléra dans certaines zones près du Gange. Malheureusement, la découverte de la pénicilline en 1928 et le recours aux antibiotiques lors de la seconde guerre mondiale ont suscité davantage d’intérêts de la part des scientifiques occidentaux, mais surtout des laboratoires, au point que l’utilisation de cette solution thérapeutique, appelée phagothérapie, est interdite en France dans la grande majorité des cas. En réalité, elle n’est pas directement « interdite », tout est une question de cadre réglementaire. Pour être considéré comme médicament et être utilisé dans le cadre d’une pathologie dans un cadre médical, un produit doit être considéré comme tel. Or les phages sont des organismes vivants et facilement disponibles. Un autre argument mis en avant est la production et l’utilisation plus aisée des antibiotiques. Pour autant, certains pays d’Europe de l’Est, notamment la Géorgie, n’ont pas abandonné cette solution thérapeutique, avant tout car ils n’avaient pas accès aux antibiotiques lors de la guerre froide. Depuis 2016, l’Agence nationale de sécurité du médicament (ANSM) accepte néanmoins d’utiliser la phagothérapie dans des cas ultimes, par exemple à la suite d’infections lors de la pose de prothèses de hanche et pouvant être à l’origine d’amputations. Depuis cette année (2019), l’ANSM envisage également de délivrer des autorisations temporaires d’utilisation (ATU), première étape avant une autorisation de mise sur le marché. Pourrait-on imaginer qu’une telle interdiction puisse reposer sur le fait que les phages ne sont pas brevetables par les laboratoires, contrairement aux antibiotiques ? On pourrait en effet se poser la question… d’autant plus que les phages représentent une arme thérapeutique majeure contre les bactéries depuis des millions d’années.
En conclusion, les probiotiques et surtout la transplantation fécale, représentent des axes majeurs de développement thérapeutique pour les années à venir. Au regard du pouvoir du microbiote intestinal sur le maintien de notre santé encore largement sous-estimé, il est évident qu’une modulation positive de la population bactérienne ne peut qu’apparaitre séduisante. A l’heure actuelle, bien qu’il existe des produits qualitatifs utiles dans un certain nombre de situations, nous ne disposons toutefois pas encore de méthodes permettant d’impacter en profondeur et de manière prolongée notre microbiote par la prise de complément alimentaire. Conservons également à l’esprit que l’apport de souches bactériennes dans un microbiote sain, aussi bénéfiques soient-elles en théorie, pourrait également perturber cet équilibre.
Adopter une alimentation de qualité demeure donc LA priorité pour prendre soin de notre santé.
Anthony Berthou
Découvrez ici également : Faut-il éviter le gluten ? Les protéines de lait ? Quels sont les rôles de l’écosystème intestinal sur la santé ?
Sources :
- Gibson GR, Hutkins R, Sanders ME, et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491-502. doi:10.1038/nrgastro.2017.75
- Hill C, Guarner F, Reid G, et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature Reviews Gastroenterology & Hepatology. 2014;11(8):506-514. doi:10.1038/nrgastro.2014.66
- Svanberg U, Lorri W. Fermentation and nutrient availability. Food Control. 1997;8(5):319-327. doi:10.1016/S0956-7135(97)00018-2
- Lee 184246 C-H. Fermentation technology in Korea. 2001. http://agris.fao.org/agris-search/search.do?recordID=XF2015041241. Accessed June 5, 2019.
- Devaki CS, Premavalli KS. 8 – Fermented Vegetable Beverages. In: Grumezescu AM, Holban AM, eds. Fermented Beverages. Woodhead Publishing; 2019:321-367. doi:10.1016/B978-0-12-815271-3.00008-7
- Vijaya Kumar B, Vijayendra SVN, Reddy OVS. Trends in dairy and non-dairy probiotic products – a review. J Food Sci Technol. 2015;52(10):6112-6124. doi:10.1007/s13197-015-1795-2
- Yoon Y, Lee H, Lee S, Kim S, Choi K-H. Membrane fluidity-related adaptive response mechanisms of foodborne bacterial pathogens under environmental stresses. Food Research International. 2015;72:25-36. doi:10.1016/j.foodres.2015.03.016
- Parente E, Cogan TM. Starter Cultures: General Aspects. In: Fox PF, McSweeney PLH, Cogan TM, Guinee TP, eds. Cheese: Chemistry, Physics and Microbiology. Vol 1. General Aspects. Academic Press; 2004:123-147. doi:10.1016/S1874-558X(04)80065-4
- Cavanagh D, Kilcawley KN, O’Sullivan MG, Fitzgerald GF, McAuliffe O. Assessment of wild non-dairy lactococcal strains for flavour diversification in a mini-Gouda type cheese model. Food Research International. 2014;62:432-440. doi:10.1016/j.foodres.2014.03.043
- Centeno JA, Tomillo FJ, Fernández-García E, Gaya P, Nuñez M. Effect of Wild Strains of Lactococcus lactis on the Volatile Profile and the Sensory Characteristics of Ewes’ Raw Milk Cheese. Journal of Dairy Science. 2002;85(12):3164-3172. doi:10.3168/jds.S0022-0302(02)74404-4
- Murtaza MA, Rehman SU, Anjum FM, Huma N. Descriptive sensory profile of cow and buffalo milk Cheddar cheese prepared using indigenous cultures. Journal of Dairy Science. 2013;96(3):1380-1386. doi:10.3168/jds.2012-5992
- Gaucher F, Bonnassie S, Rabah H, et al. Review: Adaptation of Beneficial Propionibacteria, Lactobacilli, and Bifidobacteria Improves Tolerance Toward Technological and Digestive Stresses. Front Microbiol. 2019;10. doi:10.3389/fmicb.2019.00841
- Quigley L, O’Sullivan O, Stanton C, et al. The complex microbiota of raw milk. FEMS Microbiol Rev. 2013;37(5):664-698. doi:10.1111/1574-6976.12030
- Shortt C, Hasselwander O, Meynier A, et al. Systematic review of the effects of the intestinal microbiota on selected nutrients and non-nutrients. Eur J Nutr. 2018;57(1):25-49. doi:10.1007/s00394-017-1546-4
- Hasemann: Yogurt: Nutritious Food or Sugary Treat? – Google Scholar. https://scholar.google.com/scholar_lookup?title=Yogurt%3A%20nutritious%20food%20or%20sugary%20treat%3F&author=A.%20Hasemann&publication_year=2014&pages=37-46. Accessed May 24, 2019.
- Villarreal-Soto SA, Beaufort S, Bouajila J, Souchard J-P, Taillandier P. Understanding Kombucha Tea Fermentation: A Review. J Food Sci. 2018;83(3):580-588. doi:10.1111/1750-3841.14068
- Chen C, Liu BY. Changes in major components of tea fungus metabolites during prolonged fermentation. J Appl Microbiol. 2000;89(5):834-839.
- Sievers M, Lanini C, Weber A, Schuler-Schmid U, Teuber M. Microbiology and Fermentation Balance in a Kombucha Beverage Obtained from a Tea Fungus Fermentation. Systematic and Applied Microbiology. 1995;18(4):590-594. doi:10.1016/S0723-2020(11)80420-0
- De Ley J. Comparative carbohydrate metabolism and a proposal for a phylogenetic relationship of the acetic acid bacteria. J Gen Microbiol. 1961;24:31-50. doi:10.1099/00221287-24-1-31
- Leistner L. Basic aspects of food preservation by hurdle technology. International Journal of Food Microbiology. 2000;55(1):181-186. doi:10.1016/S0168-1605(00)00161-6
- Isolation and identification of a bacterial cellulose synthesizing strain from kombucha in different conditions: Gluconacetobacter xylinus ZHCJ618. – PubMed – NCBI. https://www.ncbi.nlm.nih.gov/pubmed/30263796. Accessed June 7, 2019.
- Leal JM, Suárez LV, Jayabalan R, Oros JH, Escalante-Aburto A. A review on health benefits of kombucha nutritional compounds and metabolites. CyTA – Journal of Food. 2018;16(1):390-399. doi:10.1080/19476337.2017.1410499
- Nguyen NK, Dong NTN, Nguyen HT, Le PH. Lactic acid bacteria: promising supplements for enhancing the biological activities of kombucha. Springerplus. 2015;4. doi:10.1186/s40064-015-0872-3
- Nguyen NK, Nguyen PB, Nguyen HT, Le PH. Screening the optimal ratio of symbiosis between isolated yeast and acetic acid bacteria strain from traditional kombucha for high-level production of glucuronic acid. LWT – Food Science and Technology. 2015;64(2):1149-1155. doi:10.1016/j.lwt.2015.07.018
- Wang K, Gan X, Tang X, Wang S, Tan H. Determination of D-saccharic acid-1,4-lactone from brewed kombucha broth by high-performance capillary electrophoresis. J Chromatogr B Analyt Technol Biomed Life Sci. 2010;878(3-4):371-374. doi:10.1016/j.jchromb.2009.12.003
- Bauer‐Petrovska B, Petrushevska‐Tozi L. Mineral and water soluble vitamin content in the Kombucha drink. International Journal of Food Science & Technology. 2000;35(2):201-205. doi:10.1046/j.1365-2621.2000.00342.x
- Khan N, Mukhtar H. Tea polyphenols for health promotion. Life Sci. 2007;81(7):519-533. doi:10.1016/j.lfs.2007.06.011
- Gamboa-Gómez CI, González-Laredo RF, Gallegos-Infante JA, et al. Antioxidant and Angiotensin-Converting Enzyme Inhibitory Activity of Eucalyptus camaldulensis and Litsea glaucescens Infusions Fermented with Kombucha Consortium. Food Technology and Biotechnology. 2016;54(3):367-374. doi:10.17113/ftb.54.03.16.4622
- Jayabalan R, Subathradevi P, Marimuthu S, Sathishkumar M, Swaminathan K. Changes in free-radical scavenging ability of kombucha tea during fermentation. Food Chem. 2008;109(1):227-234. doi:10.1016/j.foodchem.2007.12.037
- Battikh H, Bakhrouf A, Ammar E. Antimicrobial effect of Kombucha analogues. Food Science and Technology. 2011;47(1):71-77. doi:10.1016/j.lwt.2011.12.033
- Sreeramulu G, Zhu Y, Knol W. Kombucha Fermentation and Its Antimicrobial Activity. J Agric Food Chem. 2000;48(6):2589-2594. doi:10.1021/jf991333m
- Kabiri N, Setorki M, Darabi MA. Protective effects of Kombucha tea and silimarin against thioacetamide induced hepatic injuries in wistar rats. World Applied Sciences Journal. 2013;27:524-532. doi:10.5829/idosi.wasj.2013.27.04.38
- Ernst E. Kombucha: a systematic review of the clinical evidence. Forsch Komplementarmed Klass Naturheilkd. 2003;10(2):85-87. doi:10.1159/000071667
- Maldonado Galdeano C, Novotny Nuñez I, Carmuega E, de Moreno de LeBlanc A, Perdigón G. Role of probiotics and functional foods in health: gut immune stimulation by two probiotic strains and a potential probiotic yoghurt. Endocr Metab Immune Disord Drug Targets. 2015;15(1):37-45.
- Ishizaki A, Bi X, Nguyen LV, et al. Effects of Short-Term Probiotic Ingestion on Immune Profiles and Microbial Translocation among HIV-1-Infected Vietnamese Children. Int J Mol Sci. 2017;18(10). doi:10.3390/ijms18102185
- Cosenza L, Nocerino R, Di Scala C, et al. Bugs for atopy: the Lactobacillus rhamnosus GG strategy for food allergy prevention and treatment in children. Benef Microbes. 2015;6(2):225-232. doi:10.3920/BM2014.0158
- Segers ME, Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG – host interactions. Microbial Cell Factories. 2014;13(1):S7. doi:10.1186/1475-2859-13-S1-S7
- Wenus C, Goll R, Loken EB, Biong AS, Halvorsen DS, Florholmen J. Prevention of antibiotic-associated diarrhoea by a fermented probiotic milk drink. European Journal of Clinical Nutrition. 2008;62(2):299-301. doi:10.1038/sj.ejcn.1602718
- Vanderhoof JA, Whitney DB, Antonson DL, Hanner TL, Lupo JV, Young RJ. Lactobacillus GG in the prevention of antibiotic-associated diarrhea in children. The Journal of Pediatrics. 1999;135(5):564-568. doi:10.1016/S0022-3476(99)70053-3
- Arvola T, Laiho K, Torkkeli S, et al. Prophylactic Lactobacillus GGReduces Antibiotic-Associated Diarrhea in Children With Respiratory Infections: A Randomized Study. Pediatrics. 1999;104(5):e64-e64. doi:10.1542/peds.104.5.e64
- Armuzzi A, Cremonini F, Ojetti V, et al. Effect of Lactobacillus GG Supplementation on Antibiotic-Associated Gastrointestinal Side Effects during Helicobacter pylori Eradication Therapy: A Pilot Study. DIG. 2001;63(1):1-7. doi:10.1159/000051865
- Doron S, Hibberd P, Gorbach S. Probiotics for Prevention of Antibiotic-associated Diarrhea. Journal of Clinical Gastroenterology. 2008;42. doi:10.1097/MCG.0b013e3181618ab7
- Fox MJ, Ahuja KDK, Robertson IK, Ball MJ, Eri RD. Can probiotic yogurt prevent diarrhoea in children on antibiotics? A double-blind, randomised, placebo-controlled study. BMJ Open. 2015;5(1):e006474. doi:10.1136/bmjopen-2014-006474
- Szajewska H, Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Alimentary Pharmacology & Therapeutics. 2015;42(10):1149-1157. doi:10.1111/apt.13404
- Gorbach SherwoodL, Chang T-W, Goldin B. SUCCESSFUL TREATMENT OF RELAPSING CLOSTRIDIUM DIFFICILE COLITIS WITH LACTOBACILLUS GG. The Lancet. 1987;330(8574):1519. doi:10.1016/S0140-6736(87)92646-8
- Biller J, Katz A, Flores A, Buie T, Gorbach S. Treatment of Recurrent Clostridium difficile Colitis With Lactobacillus GG. Journal of Pediatric Gastroenterology and Nutrition. 1995;21(2):224-226.
- Bennett R, Gorbach S, Goldin B, et al. Treatment of Relapsing Clostridium difficile Diarrhea with Lactobacillus GG. Nutrition Today. 1996;31(6). insights.ovid.com. Accessed June 4, 2019.
- Pochapin M. The effect of probiotics on clostridium difficile diarrhea. The American Journal of Gastroenterology. 2000;95(1, Supplement 1):S11-S13. doi:10.1016/S0002-9270(99)00809-6
- Olek A, Woynarowski M, Ahrén IL, et al. Efficacy and Safety of Lactobacillus plantarum DSM 9843 (LP299V) in the Prevention of Antibiotic-Associated Gastrointestinal Symptoms in Children-Randomized, Double-Blind, Placebo-Controlled Study. J Pediatr. 2017;186:82-86. doi:10.1016/j.jpeds.2017.03.047
- Pereg D, Kimhi O, Tirosh A, Orr N, Kayouf R, Lishner M. The effect of fermented yogurt on the prevention of diarrhea in a healthy adult population. Am J Infect Control. 2005;33(2):122-125. doi:10.1016/j.ajic.2004.11.001
- Jafarnejad S, Shab-Bidar S, Speakman JR, Parastui K, Daneshi-Maskooni M, Djafarian K. Probiotics Reduce the Risk of Antibiotic-Associated Diarrhea in Adults (18-64 Years) but Not the Elderly (>65 Years): A Meta-Analysis. Nutr Clin Pract. 2016;31(4):502-513. doi:10.1177/0884533616639399
- Freedman SB, Williamson-Urquhart S, Farion KJ, et al. Multicenter Trial of a Combination Probiotic for Children with Gastroenteritis. New England Journal of Medicine. 2018;379(21):2015-2026. doi:10.1056/NEJMoa1802597
- Schnadower D, Tarr PI, Casper TC, et al. Lactobacillus rhamnosus GG versus Placebo for Acute Gastroenteritis in Children. New England Journal of Medicine. 2018;379(21):2002-2014. doi:10.1056/NEJMoa1802598
- Dang D, Zhou W, Lun ZJ, Mu X, Wang DX, Wu H. Meta-analysis of probiotics and/or prebiotics for the prevention of eczema. J Int Med Res. 2013;41(5):1426-1436. doi:10.1177/0300060513493692
- Doege K, Grajecki D, Zyriax B-C, Detinkina E, Eulenburg C zu, Buhling KJ. Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood: a meta-analysis. British Journal of Nutrition. 2012;107(1):1-6. doi:10.1017/S0007114511003400
- Mugambi MN, Musekiwa A, Lombard M, Young T, Blaauw R. Synbiotics, probiotics or prebiotics in infant formula for full term infants: a systematic review. Nutr J. 2012;11:81. doi:10.1186/1475-2891-11-81
- Osborn DA, Sinn JK. Probiotics in infants for prevention of allergic disease and food hypersensitivity. Cochrane Database Syst Rev. 2007;(4):CD006475. doi:10.1002/14651858.CD006475.pub2
- Canani RB, Di Costanzo M. Gut Microbiota as Potential Therapeutic Target for the Treatment of Cow’s Milk Allergy. Nutrients. 2013;5(3):651-662. doi:10.3390/nu5030651
- Castellazzi AM, Valsecchi C, Caimmi S, et al. Probiotics and food allergy. Ital J Pediatr. 2013;39:47. doi:10.1186/1824-7288-39-47
- Bridgman SL, Kozyrskyj AL, Scott JA, Becker AB, Azad MB. Gut microbiota and allergic disease in children. Annals of Allergy, Asthma & Immunology. 2016;116(2):99-105. doi:10.1016/j.anai.2015.10.001
- Kim H-J, Kim HY, Lee S-Y, Seo J-H, Lee E, Hong S-J. Clinical efficacy and mechanism of probiotics in allergic diseases. Korean J Pediatr. 2013;56(9):369-376. doi:10.3345/kjp.2013.56.9.369
- Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E. Probiotic administration in early life, atopy, and asthma: a meta-analysis of clinical trials. Pediatrics. 2013;132(3):e666-676. doi:10.1542/peds.2013-0246
- Kumar M, Nagpal R, Hemalatha R, Yadav H, Marotta F. Chapter 6 – Probiotics and Prebiotics for Promoting Health: Through Gut Microbiota. In: Watson RR, Preedy VR, eds. Probiotics, Prebiotics, and Synbiotics. Academic Press; 2016:75-85. doi:10.1016/B978-0-12-802189-7.00006-X
- Lebeer S, Vanderleyden J, De Keersmaecker SCJ. Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Nature Reviews Microbiology. 2010;8(3):171-184. doi:10.1038/nrmicro2297
- DiRienzo DB. Effect of probiotics on biomarkers of cardiovascular disease: implications for heart-healthy diets. Nutr Rev. 2014;72(1):18-29. doi:10.1111/nure.12084
- Kumar M, Nagpal R, Kumar R, et al. Cholesterol-Lowering Probiotics as Potential Biotherapeutics for Metabolic Diseases. Journal of Diabetes Research. doi:10.1155/2012/902917
- Jones ML, Martoni CJ, Prakash S. Cholesterol lowering and inhibition of sterol absorption by Lactobacillus reuteri NCIMB 30242: a randomized controlled trial. Eur J Clin Nutr. 2012;66(11):1234-1241. doi:10.1038/ejcn.2012.126
- Ford AC, Harris LA, Lacy BE, Quigley EMM, Moayyedi P. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther. 2018;48(10):1044-1060. doi:10.1111/apt.15001
- McKenzie YA, Thompson J, Gulia P, Lomer MCE, (IBS Dietetic Guideline Review Group on behalf of Gastroenterology Specialist Group of the British Dietetic Association). British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):576-592. doi:10.1111/jhn.12386
- Hod K, Sperber AD, Ron Y, et al. A double-blind, placebo-controlled study to assess the effect of a probiotic mixture on symptoms and inflammatory markers in women with diarrhea-predominant IBS. Neurogastroenterol Motil. 2017;29(7). doi:10.1111/nmo.13037
- Sentongo T, Cohran V, Korff S, Sullivan C, Iyer K, Zheng X. Intestinal Permeability and Effects of Lactobacillus rhamnosus Therapy in Children With Short Bowel Syndrome. Journal of Pediatric Gastroenterology and Nutrition. 2008;46(1):41-47. doi:10.1097/01.mpg.0000304452.92175.f5
- Vanderhoof JA, Young RJ, Murray N, Kaufman SS. Treatment Strategies for Small Bowel Bacterial Overgrowth in Short Bowel Syndrome. Journal of Pediatric Gastroenterology and Nutrition. 1998;27(2):155.
- Candy D, Densham L, Lamont L, et al. Effect of Administration of Lactobacillus casei Shirota on Sodium Balance in an Infant with Short Bowel Syndrome. Journal of Pediatric Gastroenterology and Nutrition. 2001;32(4):506-508.
- Shiau S-L, Su B-H, Lin K-J, Lin H-C, Lin J-N. Possible effect of probiotics and breast milk in short bowel syndrome: report of one case. Acta Paediatr Taiwan. 2007;48(2):89-92.
- Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial. Lancet. 2001;357(9262):1076-1079. doi:10.1016/S0140-6736(00)04259-8
- Marteau PR, de Vrese M, Cellier CJ, Schrezenmeir J. Protection from gastrointestinal diseases with the use of probiotics. Am J Clin Nutr. 2001;73(2 Suppl):430S-436S. doi:10.1093/ajcn/73.2.430s
- Guo Q, Goldenberg JZ, Humphrey C, El Dib R, Johnston BC. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev. 2019;4:CD004827. doi:10.1002/14651858.CD004827.pub5
- Mantegazza C, Molinari P, D’Auria E, Sonnino M, Morelli L, Zuccotti GV. Probiotics and antibiotic-associated diarrhea in children: A review and new evidence on Lactobacillus rhamnosus GG during and after antibiotic treatment. Pharmacol Res. 2018;128:63-72. doi:10.1016/j.phrs.2017.08.001
- Suez J, Zmora N, Segal E, Elinav E. The pros, cons, and many unknowns of probiotics. Nature Medicine. 2019;25(5):716. doi:10.1038/s41591-019-0439-x
- Gueimonde M, Margolles A, de los Reyes-Gavilán CG, Salminen S. Competitive exclusion of enteropathogens from human intestinal mucus by Bifidobacterium strains with acquired resistance to bile–a preliminary study. Int J Food Microbiol. 2007;113(2):228-232. doi:10.1016/j.ijfoodmicro.2006.05.017
- Tsai C-C, Hsih H-Y, Chiu H-H, et al. Antagonistic activity against Salmonella infection in vitro and in vivo for two Lactobacillus strains from swine and poultry. Int J Food Microbiol. 2005;102(2):185-194. doi:10.1016/j.ijfoodmicro.2004.12.014
- Kim Y, Kim S-H, Whang K-Y, Kim Y-J, Oh S. Inhibition of Escherichia coli O157:H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells. J Microbiol Biotechnol. 2008;18(7):1278-1285.
- Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature. 2011;469(7331):543-547. doi:10.1038/nature09646
- Cotter PD, Hill C, Ross RP. Bacteriocins: developing innate immunity for food. Nat Rev Microbiol. 2005;3(10):777-788. doi:10.1038/nrmicro1273
- Corr SC, Li Y, Riedel CU, O’Toole PW, Hill C, Gahan CGM. Bacteriocin production as a mechanism for the antiinfective activity of Lactobacillus salivarius UCC118. Proc Natl Acad Sci USA. 2007;104(18):7617-7621. doi:10.1073/pnas.0700440104
- Medellin-Peña MJ, Wang H, Johnson R, Anand S, Griffiths MW. Probiotics affect virulence-related gene expression in Escherichia coli O157:H7. Appl Environ Microbiol. 2007;73(13):4259-4267. doi:10.1128/AEM.00159-07
- Yun B, Oh S, Griffiths MW. Lactobacillus acidophilus modulates the virulence of Clostridium difficile. J Dairy Sci. 2014;97(8):4745-4758. doi:10.3168/jds.2014-7921
- Tuffs SW, Haeryfar SMM, McCormick JK. Manipulation of Innate and Adaptive Immunity by Staphylococcal Superantigens. Pathogens. 2018;7(2). doi:10.3390/pathogens7020053
- Miller MB, Bassler BL. Quorum sensing in bacteria. Annu Rev Microbiol. 2001;55:165-199. doi:10.1146/annurev.micro.55.1.165
- Zhang C, Derrien M, Levenez F, et al. Ecological robustness of the gut microbiota in response to ingestion of transient food-borne microbes. The ISME Journal. 2016;10(9):2235-2245. doi:10.1038/ismej.2016.13
- Tannock GW, Munro K, Harmsen HJ, Welling GW, Smart J, Gopal PK. Analysis of the fecal microflora of human subjects consuming a probiotic product containing Lactobacillus rhamnosus DR20. Appl Environ Microbiol. 2000;66(6):2578-2588. doi:10.1128/aem.66.6.2578-2588.2000
- Maldonado-Gómez MX, Martínez I, Bottacini F, et al. Stable Engraftment of Bifidobacterium longum AH1206 in the Human Gut Depends on Individualized Features of the Resident Microbiome. Cell Host Microbe. 2016;20(4):515-526. doi:10.1016/j.chom.2016.09.001
- Brandt LJ, Aroniadis OC, Mellow M, et al. Long-term follow-up of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol. 2012;107(7):1079-1087. doi:10.1038/ajg.2012.60
- Mattila E, Uusitalo-Seppälä R, Wuorela M, et al. Fecal transplantation, through colonoscopy, is effective therapy for recurrent Clostridium difficile infection. Gastroenterology. 2012;142(3):490-496. doi:10.1053/j.gastro.2011.11.037
- Brown WR. Fecal microbiota transplantation in treating Clostridium difficile infection. J Dig Dis. 2014;15(8):405-408. doi:10.1111/1751-2980.12160
- Lawley TD, Clare S, Walker AW, et al. Targeted Restoration of the Intestinal Microbiota with a Simple, Defined Bacteriotherapy Resolves Relapsing Clostridium difficile Disease in Mice. PLOS Pathogens. 2012;8(10):e1002995. doi:10.1371/journal.ppat.1002995
- Tremaroli V, Bäckhed F. Tremaroli, V. & Backhed, F. Functional Interactions between the Gut Microbiota and Host Metabolism. Nature 489, 242-249. Vol 489.; 2012. doi:10.1038/nature11552
- Brown JM, Hazen SL. The gut microbial endocrine organ: bacterially derived signals driving cardiometabolic diseases. Annu Rev Med. 2015;66:343-359. doi:10.1146/annurev-med-060513-093205
- Frank DN, St. Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc Natl Acad Sci U S A. 2007;104(34):13780-13785. doi:10.1073/pnas.0706625104
- Kaur N, Chen C-C, Luther J, Kao JY. Intestinal dysbiosis in inflammatory bowel disease. Gut Microbes. 2011;2(4):211-216. doi:10.4161/gmic.2.4.17863
- Kriegel MA, Sefik E, Hill JA, Wu H-J, Benoist C, Mathis D. Naturally transmitted segmented filamentous bacteria segregate with diabetes protection in nonobese diabetic mice. Proc Natl Acad Sci USA. 2011;108(28):11548-11553. doi:10.1073/pnas.1108924108
- Cohen NA, Maharshak N. Novel Indications for Fecal Microbial Transplantation: Update and Review of the Literature. Dig Dis Sci. 2017;62(5):1131-1145. doi:10.1007/s10620-017-4535-9
- Borody TJ, Finlayson S, Paramsothy S. Is Crohn’s disease ready for fecal microbiota transplantation? J Clin Gastroenterol. 2014;48(7):582-583. doi:10.1097/MCG.0000000000000155
- Eslamparast T, Eghtesad S, Hekmatdoost A, Poustchi H. Probiotics and Nonalcoholic Fatty liver Disease. Middle East J Dig Dis. 2013;5(3):129-136.
- Floch MH, Walker WA, Sanders ME, et al. Recommendations for Probiotic Use–2015 Update: Proceedings and Consensus Opinion. J Clin Gastroenterol. 2015;49 Suppl 1:S69-73. doi:10.1097/MCG.0000000000000420
- Schneeberger M, Everard A, Gómez-Valadés AG, et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci Rep. 2015;5:16643. doi:10.1038/srep16643
- Cani PD, Everard A. Akkermansia muciniphila – Une nouvelle cible pour contrôler l’obésité, le diabète de type 2 et l’inflammation ? Med Sci (Paris). 2014;30(02):125-127. doi:10.1051/medsci/20143002003
- Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. PNAS. 2013;110(22):9066-9071. doi:10.1073/pnas.1219451110
- Everard A, Lazarevic V, Derrien M, et al. Responses of Gut Microbiota and Glucose and Lipid Metabolism to Prebiotics in Genetic Obese and Diet-Induced Leptin-Resistant Mice. Diabetes. 2011;60(11):2775-2786. doi:10.2337/db11-0227
- Cox LM, Yamanishi S, Sohn J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. Cell. 2014;158(4):705-721. doi:10.1016/j.cell.2014.05.052
- Nobel YR, Cox LM, Kirigin FF, et al. Metabolic and metagenomic outcomes from early-life pulsed antibiotic treatment. Nature Communications. 2015;6:7486. doi:10.1038/ncomms8486
- Derrien M, Vaughan EE, Plugge CM, de Vos WM. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. International Journal of Systematic and Evolutionary Microbiology. 2004;54(5):1469-1476. doi:10.1099/ijs.0.02873-0
- Hungate RE. The anaerobic mesophilic cellulolytic bacteria. Bacteriol Rev. 1950;14(1):1-49.
- Woese CR, Fox GE. Phylogenetic structure of the prokaryotic domain: The primary kingdoms. PNAS. 1977;74(11):5088-5090. doi:10.1073/pnas.74.11.5088
- Dao MC, Everard A, Aron-Wisnewsky J, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut. 2016;65(3):426-436. doi:10.1136/gutjnl-2014-308778
- Allen JM, Mailing LJ, Niemiro GM, et al. Exercise Alters Gut Microbiota Composition and Function in Lean and Obese Humans. Med Sci Sports Exerc. 2018;50(4):747-757. doi:10.1249/MSS.0000000000001495
- Karlsson CLJ, Önnerfält J, Xu J, Molin G, Ahrné S, Thorngren‐Jerneck K. The Microbiota of the Gut in Preschool Children With Normal and Excessive Body Weight. Obesity. 2012;20(11):2257-2261. doi:10.1038/oby.2012.110
- Derrien M, Belzer C, de Vos WM. Akkermansia muciniphila and its role in regulating host functions. Microbial Pathogenesis. 2017;106:171-181. doi:10.1016/j.micpath.2016.02.005
- Kadooka Y, Ogawa A, Ikuyama K, Sato M. The probiotic Lactobacillus gasseri SBT2055 inhibits enlargement of visceral adipocytes and upregulation of serum soluble adhesion molecule (sICAM-1) in rats. International Dairy Journal. 2011;21(9):623-627. doi:10.1016/j.idairyj.2011.02.001
- Guazzelli Marques C, de Piano Ganen A, Zaccaro de Barros A, Thomatieli dos Santos RV, dos Santos Quaresma MVL. Weight loss probiotic supplementation effect in overweight and obesity subjects: A review. Clinical Nutrition. April 2019. doi:10.1016/j.clnu.2019.03.034
- Jung S-P, Lee K-M, Kang J-H, et al. Effect of Lactobacillus gasseri BNR17 on Overweight and Obese Adults: A Randomized, Double-Blind Clinical Trial. Korean J Fam Med. 2013;34(2):80-89. doi:10.4082/kjfm.2013.34.2.80
- Kim J, Yun JM, Kim MK, Kwon O, Cho B. Lactobacillus gasseri BNR17 Supplementation Reduces the Visceral Fat Accumulation and Waist Circumference in Obese Adults: A Randomized, Double-Blind, Placebo-Controlled Trial. J Med Food. 2018;21(5):454-461. doi:10.1089/jmf.2017.3937
- Kobyliak N, Conte C, Cammarota G, et al. Probiotics in prevention and treatment of obesity: a critical view. Nutr Metab (Lond). 2016;13. doi:10.1186/s12986-016-0067-0
- Reuter G. The Lactobacillus and Bifidobacterium microflora of the human intestine: composition and succession. Curr Issues Intest Microbiol. 2001;2(2):43-53.
- Santos F, Wegkamp A, Vos WM de, Smid EJ, Hugenholtz J. High-Level Folate Production in Fermented Foods by the B12 Producer Lactobacillus reuteri JCM1112. Appl Environ Microbiol. 2008;74(10):3291-3294. doi:10.1128/AEM.02719-07
- Talarico TL, Dobrogosz WJ. Chemical characterization of an antimicrobial substance produced by Lactobacillus reuteri. Antimicrob Agents Chemother. 1989;33(5):674-679. doi:10.1128/aac.33.5.674
- Levkovich T, Poutahidis T, Smillie C, et al. Probiotic Bacteria Induce a ‘Glow of Health.’ PLOS ONE. 2013;8(1):e53867. doi:10.1371/journal.pone.0053867
- Poutahidis T, Kleinewietfeld M, Smillie C, et al. Microbial Reprogramming Inhibits Western Diet-Associated Obesity. PLOS ONE. 2013;8(7):e68596. doi:10.1371/journal.pone.0068596
- Poutahidis T, Springer A, Levkovich T, et al. Probiotic Microbes Sustain Youthful Serum Testosterone Levels and Testicular Size in Aging Mice. PLOS ONE. 2014;9(1):e84877. doi:10.1371/journal.pone.0084877
- Sarkar A, Lehto SM, Harty S, Dinan TG, Cryan JF, Burnet PWJ. Psychobiotics and the Manipulation of Bacteria–Gut–Brain Signals. Trends in Neurosciences. 2016;39(11):763-781. doi:10.1016/j.tins.2016.09.002
- Jia S, Lu Z, Gao Z, et al. Chitosan oligosaccharides alleviate cognitive deficits in an amyloid-β1–42-induced rat model of Alzheimer’s disease. International Journal of Biological Macromolecules. 2016;83:416-425. doi:10.1016/j.ijbiomac.2015.11.011
- Song L, Gao Y, Zhang X, Le W. Galactooligosaccharide improves the animal survival and alleviates motor neuron death in SOD1G93A mouse model of amyotrophic lateral sclerosis. Neuroscience. 2013;246:281-290. doi:10.1016/j.neuroscience.2013.05.002
- Hsiao EY, McBride SW, Hsien S, et al. Microbiota Modulate Behavioral and Physiological Abnormalities Associated with Neurodevelopmental Disorders. Cell. 2013;155(7):1451-1463. doi:10.1016/j.cell.2013.11.024
- Savignac HM, Couch Y, Stratford M, et al. Prebiotic administration normalizes lipopolysaccharide (LPS)-induced anxiety and cortical 5-HT2A receptor and IL1-β levels in male mice. Brain, Behavior, and Immunity. 2016;52:120-131. doi:10.1016/j.bbi.2015.10.007
- Khalesi S, Bellissimo N, Vandelanotte C, Williams S, Stanley D, Irwin C. A review of probiotic supplementation in healthy adults: helpful or hype? Eur J Clin Nutr. 2019;73(1):24-37. doi:10.1038/s41430-018-0135-9
- Figure 3: The relationships among 25 important genes and three different races. https://www.nature.com/articles/srep23075/figures/3. Accessed June 4, 2019.
- Chen L, Zhang Y-H, Huang T, Cai Y-D. Gene expression profiling gut microbiota in different races of humans. Scientific Reports. 2016;6:23075. doi:10.1038/srep23075
- Khangwal I, Shukla P. Potential prebiotics and their transmission mechanisms: Recent approaches. Journal of Food and Drug Analysis. March 2019. doi:10.1016/j.jfda.2019.02.003
- Aw W, Fukuda S. Understanding the role of the gut ecosystem in diabetes mellitus. Journal of Diabetes Investigation. 2018;9(1):5-12. doi:10.1111/jdi.12673
- Dávila LA, Pirela VB, ReynaVillasmil N, et al. New Insights into Alleviating Diabetes Mellitus: Role of Gut Microbiota and a Nutrigenomic Approach. Diabetes Food Plan. November 2018. doi:10.5772/intechopen.76202
- Leach J, Rastall RA, Gibson GR. Prebiotics: past, present and future. In: Gibson GR, Rastall RA, eds. Prebiotics: Development and Application. Chichester: John Wiley & Sons Ltd; 2006:237-248. http://centaur.reading.ac.uk/13221/. Accessed May 28, 2019.
- Pandey KavitaR, Naik SureshR, Vakil BabuV. Probiotics, prebiotics and synbiotics- a review. J Food Sci Technol. 2015;52(12):7577-7587. doi:10.1007/s13197-015-1921-1
- Costantini L, Molinari R, Farinon B, Merendino N. Impact of Omega-3 Fatty Acids on the Gut Microbiota. Int J Mol Sci. 2017;18(12). doi:10.3390/ijms18122645
- Brownawell AM, Caers W, Gibson GR, et al. Prebiotics and the Health Benefits of Fiber: Current Regulatory Status, Future Research, and Goals. J Nutr. 2012;142(5):962-974. doi:10.3945/jn.112.158147
- Atia A, Girard‐Pipau F, Hébuterne X, et al. Macronutrient Absorption Characteristics in Humans With Short Bowel Syndrome and Jejunocolonic Anastomosis: Starch Is the Most Important Carbohydrate Substrate, Although Pectin Supplementation May Modestly Enhance Short Chain Fatty Acid Production and Fluid Absorption. Journal of Parenteral and Enteral Nutrition. 2011;35(2):229-240. doi:10.1177/0148607110378410
- Tappenden K, Thomson A, Wild G, McBurney M. Short-chain fatty acid-supplemented total parenteral nutrition enhances functional adaptation to intestinal resection in rats. Gastroenterology. 1997;112(3):792-802. doi:10.1053/gast.1997.v112.pm9041241
- The human brain microbiome; there are bacteria in our brains! https://www.abstractsonline.com/pp8/#!/4649/presentation/32057. Accessed June 6, 2019.
- Barr JJ. A bacteriophages journey through the human body. Immunol Rev. 2017;279(1):106-122. doi:10.1111/imr.12565
- Marchesi J, Shanahan F. The normal intestinal microbiota. Curr Opin Infect Dis. 2007;20(5):508-513. doi:10.1097/QCO.0b013e3282a56a99
- Minot S, Bryson A, Chehoud C, Wu GD, Lewis JD, Bushman FD. Rapid evolution of the human gut virome. Proc Natl Acad Sci USA. 2013;110(30):12450-12455. doi:10.1073/pnas.1300833110
- Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science. 2012;336(6086):1268-1273. doi:10.1126/science.1223490
- Reyes A, Haynes M, Hanson N, et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature. 2010;466(7304):334-338. doi:10.1038/nature09199
- Dinan TG, Cryan JF. Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration. J Physiol. 2017;595(2):489-503. doi:10.1113/JP273106
- Sutherland IW, Hughes KA, Skillman LC, Tait K. The interaction of phage and biofilms. FEMS Microbiol Lett. 2004;232(1):1-6. doi:10.1016/S0378-1097(04)00041-2
- Latka A, Maciejewska B, Majkowska-Skrobek G, Briers Y, Drulis-Kawa Z. Bacteriophage-encoded virion-associated enzymes to overcome the carbohydrate barriers during the infection process. Appl Microbiol Biotechnol. 2017;101(8):3103-3119. doi:10.1007/s00253-017-8224-6
- Gutiérrez D, Vandenheuvel D, Martínez B, Rodríguez A, Lavigne R, García P. Two Phages, phiIPLA-RODI and phiIPLA-C1C, Lyse Mono- and Dual-Species Staphylococcal Biofilms. Appl Environ Microbiol. 2015;81(10):3336-3348. doi:10.1128/AEM.03560-14
- Khalifa L, Brosh Y, Gelman D, et al. Targeting Enterococcus faecalis biofilms with phage therapy. Appl Environ Microbiol. 2015;81(8):2696-2705. doi:10.1128/AEM.00096-15
- Smith HW, Huggins MB, Shaw KM. The control of experimental Escherichia coli diarrhoea in calves by means of bacteriophages. J Gen Microbiol. 1987;133(5):1111-1126. doi:10.1099/00221287-133-5-1111
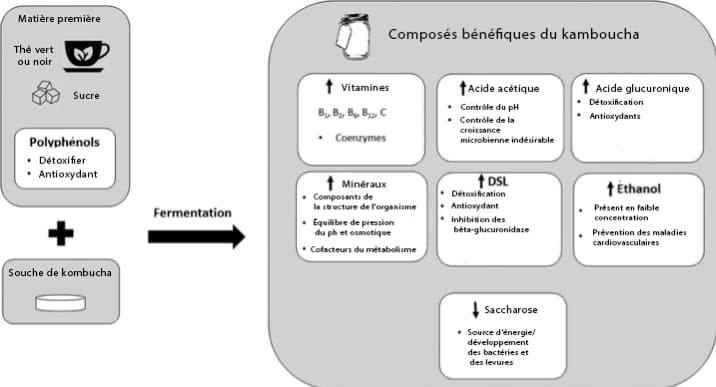
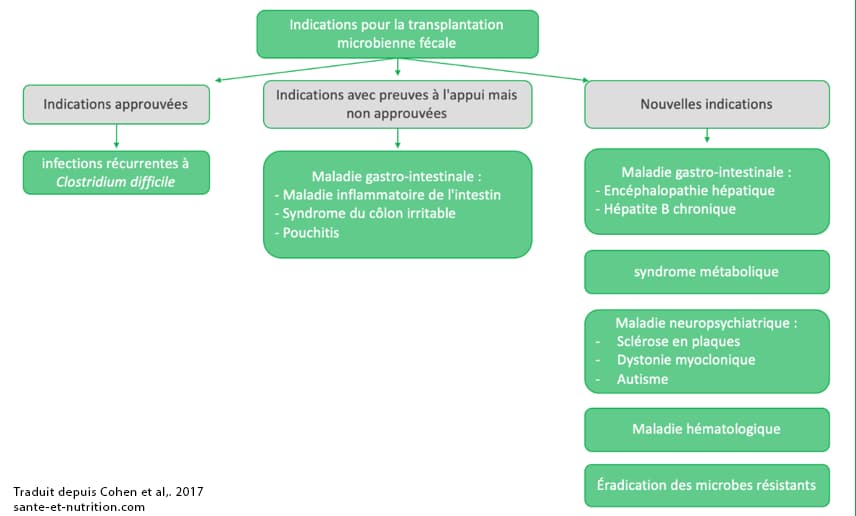
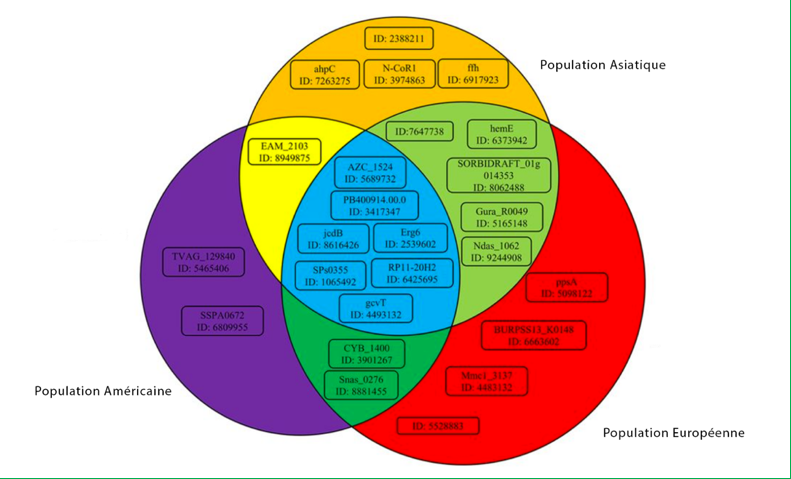
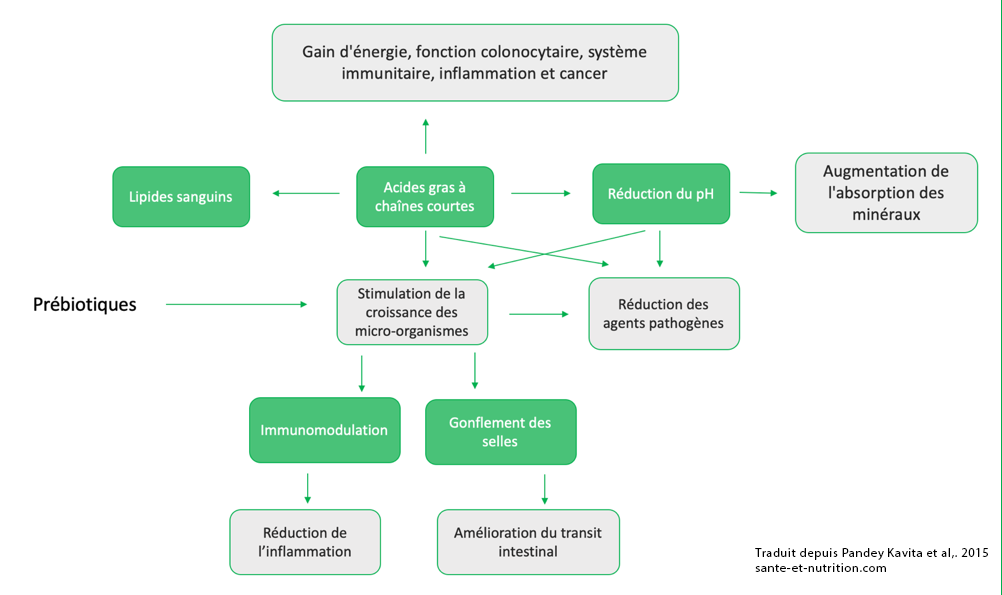



super article, tres bien renseigné …une mine d’informations! Merci anthony pour ce travail.
J’avais une question: pour la transplantation fécale, est-ce que tu as des contacts à donner pour savoir qui en fait? est-ce que ça reste à titre expérimental ou est-ce déjà appliqué à titre curatif?
Super article, une mine d’information bien recapitulee..merci pour le travail fournit et le partage. Il y a aussi un australien, Dr Hawrelak qui fait aussi un travail de recherche tres interessant sur les probiotiques. Le plus dure est souvent de trouve ces souches qui sont parfois un peu specifiques et qui ne resistant pas a la barriere gastrique ou n’est pas stable en version complement.
Article absolument instructif et exhaustif, ce travail est formidable, une mine d’informations qualitatives et quantitatives, un grand merci.
Bonjour, votre article est fort détaillé, comme à chaque fois, ce qui est très appréciable. Néanmoins, je souhaiterais connaître votre avis quant à l’efficacité suggérée de L. Reuteri dans l’éviction de H. Pylori. Diverses études semblent montrer que cette bactérie serait capable d’éradiquer le pathogène, à l’instar d’une antibiothérapie classique.
Cordialement.
Excellent article Anthony. J’ai travaillé avec une personne qui souffrait d’une infection à Helicobacter pylori. Nous avons obtenu d’excellent résultats avec une souche Lactobacillus GG. Merci pour ce travail de fond.
WOW. C’EST INCROYABLE. Le moindre mot qui me vient à la tête c’est WONDERFUL.
Article très détaillé.
Petite remarque : vous semblez limiter les probiotiques aux bactéries alors que comme vous le signalez la définition est « micro-organismes vivants qui, lorsqu’ils sont pris en quantité suffisante, peuvent être bénéfiques pour la santé ». Les champignons comme Saccharomyces boulardii (Ultra Levure) ou Saccharomyces cerevisiae (Carbolevure) sont donc aussi des probiotiques.
Bonjour,
Non je ne limite pas ce terme aux bactéries, toutefois ce terme est en effet usuellement utilisé pour les compléments alimentaires à base de bactérie. D’ailleurs on ne devrait pas parler de probiotiques, mais de micro-organismes à l’activité probiotique si nous poussons davantage le raisonnement.
Un immense merci pour ce travail aussi honnête et mis à disposition gratuitement !
J’ai cherché des informations applicables pour une amie qui est actuellement traitée pour un cancer du rectum. Elle souffre de gros effets secondaires, surtout de la radiothérapie.
Qu’est-il possible de lui suggérer, sans entraver le travail des oncologues ?
Toute ma gratitude !
Merci d’indiquer mon prénom : Marie Claire et non mon nom Ohana 🙂
Je n’interviens pas sur ce paramètre, il apparait selon le profil que vous avez créé
Difficile de vous répondre sans connaitre sa situation mais les probiotiques n’intéragissent pas négativement
Merci Anthony pour cette article ultra complet, avec un nombre impressionnant de sources ! Cela sur un sujet bien complexe parfois simplifié par les magazines féminins et autres..
Bonjour
Merci pour cet article
Pourriez vous parler du kephir?
Il serait une bonne source de probiotiques
Qu’en pensez vous ?
J’en parle dans l’article
Bonjour Très Beau Article Tout est dis Comme il le fallais Encore Felicitation pour votre persévérance
J’aimerais avoir un renseignement sur les Gélule Végétal Contre la constipation Chronique Font t’il prendre du poids au fur à mesure de prendre ses probiotique ? Merci Beaucoup
Bonsoir,
je vous remercie mais je ne comprends pas bien votre demande concernant les gélules végétales.
Escuzer moi j’aimerais savoir si les probiotique pour la constipation Chronique Font prendre du poids au fur à mesure d’en prendre Car je prends un traitement contre le syndrome de l’intestin irritable Mais J’aimerais savoir si se traitement fait prendre du poids ( il est végétal )
Je sais pas si je me suis bien expliquer merci encore de votre réponse
Si vous pouvez me dire si l’un de ses composant est naturel si il fait prendre du poids
Composition : xyloglucane , protéine de pois et extrait de pépin de raison ,xylo-oligosacharides , stéreate de magnésium,(orgine végétale ) et silice précipité amorphe.
Merci beaucoup à vous
Bonsoir,
Non pas à ma connaissance.
Cordialement,
Merci à vous davoir pris le temps de répondre
bonjour Monsieur je souffre régulierement merci pour votre article.Il y a quelques années j ai eu colo fibro ,résultat colopathie fonctionnelle.
Quand je suis en pleine crise je prends par moi meme vivomixx de arkopharma et ça me soulage, qu’ en pensez?Mais je n’ose pas prendre ce traitement en continu.
J ai consulté de nouveau un spécialiste qui ne m’a donné aucune solution et qui est contre les probiotiques!!!!!
Merci de me répondre
Merci pour cet article de grande qualité! C’est le plus intéréssant que j’ai lu sur le sujet. Il est tellement complet que je l’ai lu partiellement mais il est sûr que j’y reviendrai pour puiser de nouvelles informations lorsque je racheterai des probiotiques.
Bonjour
Merci pour cette article, j ai déjà vu une émission très intéressante sur notre microbiote
Merci de me dire si l’on peut prendre en complément sous forme médicamenteuse sachant que j ai d autres médicaments à prendre
,
Bonjour
Ce site que je viens de découvrir est une mine d’informations, très documentées et passionnantes.
A propos des probiotiques, un procédé technologique est en cours de développement pour associer dans chaque gélule gastroresistante de l’argile et du pollen aux bactéries probiotiques.
La problématique étant qu’un partie des bactéries est détruite par l’acidité gastrique et intestinale avant d’arriver sur site,le but est de permettre aux bactéries, lorsque la gélule commence à être digérée, de s’hydrater avec la protection de l’argile verte et de se nourrir avec la pollen. Elles se multiplient donc et sont plus nombreuses ‘à l’arrivée’. Il ne me semble pas abberant de d’introduire une gelule de probiotique dans une gelule plus grande et d’y ajouter un peu d’argile verte surfine et du pollen pour reproduire cet effet…
Qu’en pensez-vous?
Bonjour Anne,
Je vous remercie. Je n’ai aucune donnée sur ce sujet…
Bonjour
Merci pour cet article très documenté
Mon fils souffre de Slerose Latérale Amyotrophique
Que conseillez vous en dehors de la FMT car on est démuni
Merci
Alain
Bonjour Alain,
Dans un tel contexte, il est délicat de vous apporter un conseil générique, je vous invite à vous rapprocher d’un professionnel formé à la nutrition pour être accompagné.
Bonjour,
étant atteint d’une maladie de crohn et d’une probable spondylartrite (lombaires), je lu avec intérêt cet article très généreux !
Quelques questions si voulez bien :
– j’ai retenu parmi vos recommandations les probiotiques de Dr Woltz (dosés à 25 millards par gélule) et Pilej (dosées à 10 millards par sachet) pour mon crohn. Or Sur le dr Woltz, il semble que c’est indiqué 48 millards par gélule (mais mon allemand n’est pas bon). Le produit a t il évolué ou la mention n’est pas bonne ?
– par ailleurs Pileje propose aussi Lactibiane Iki dosé à 40 millards par sachet mais avec des bactéries differentes que Dr Woltz. Qu’en pensez-vous et lequel me conseillerez vous pour mon cas ?
– Enfin savez-vous si les probiotiques peuvent agir aussi sur la spondylartryte puisque c’est inflammatoire et pourrait être lié à mon Crohn ?
Merci d’avance.
Bonjour,
ayant eu le covid au mois de mars, je me traîne encore avec certains symptômes, notamment digestifs (ballonnements, éructations, diarrhées…). Ces symptômes prennent tout leur sens avec les recherches sur les liens entre le covid et le microbiote intestinal (par exemple https://www.gastrojournal.org/article/S0016-5085(20)34701-6/pdf). Quels probiotiques recommandez-vous pour retrouver un microbiote équilibré et protecteur ? Je n’en trouve pas contenant Fecalibacterium prausnitzii, Lachnospiraceae bacterium, Eubacterium
rectale, Ruminococcus obeum, et Dorea formicigenerans. Merci d’avance pour vos conseils.
Bonjour,
Merci infiniment pour votre article très intéressant et de partager vos connaissances en la matière, notamment sur l’existence des psychobiotiques.
Concernant le probiotique Bacteroides fragilis, est-ce que l’étude s’est porté uniquement sur la souris? A-t-il été expérimenté sur l’homme pour soigner des cas d’autisme?
Si oui, où peut-on s’en procurer? Merci beaucoup pour votre réponse. Respectueusement.
Bonjour et merci pour cet article passionnant. Je n’ai pas trouvé la liste des laboratoires ou produits sérieux que vous préconisés, auriez vous des informations à ce sujet?
Bonjour,
En effet, je les ai enlevé entre temps.
Bonjour et merci pour votre article . Deux questions toutefois . D’abord j’ai lu quelque part qu’il fallait se méfier des probiotiques en cas d’intestin perméable , les probiotiques pouvant alors passer dans la circulation générale et provoquer des dégâts en se retrouvant là où elles n’ont rien à faire ; de plus je viens de lire un article sur une maladie qui s’appelle le SIDO , et pour laquelle il serait fortement déconseillé de prendre des probiotiques . Qu’en pensez-vous ?
Bonjour,
Concernant les effets de la prise de probiotiques en cas d’hyperperméabilité intestinale, je n’ai pas connaissance de données validées en ce sens, au contraire. Concernant le SIBO, en effet dans ce cas il est conseillé de les éviter.
Bonjour, en cas d’intestin perméable, si cela peut vous aider, il peut être très utile de commencer par prendre de la glutamine qui jouera un rôle de “ciment” de l’intestin puis ensuite des probiotiques.
Bonjour,
Merci pour cet article ultra complet, une mine d’informations !
Cependant pouvez m’ éclaircir sur le fait que la prise de probiotiques ai un effet “miracle” sur les 4-5 premiers jours maximum puis n’a plus d’effets par la suite ? (Diagnostiqué SII dans mon cas).
Merci beaucoup
Bonsoir Ferdinand,
Je vous remercie. Il est possible que le changement d’équilibre induit par la prise du probiotique ait été positif au début mais que ces bactéries n’aient pu persister au sein de votre microbiote.
Bonjour
Auriez vous des éléments aussi détaillés que pour le Kombucha, dédiés au Kéfir de fruits?
Merci d’avance
Florence
Bonsoir Florence,
Sur le kéfir de manière générale oui, mais je ne l’ai pas publié encore.
Bonjour,
Je m’interroge sur la prise de probiotiques. Est il possible que celles ci peuvent interagir sur une prothèse de hanche en créant une possible infection. Concerne une prothèse posée il y a 4 mois qui me fait souffrir curieusement pendant une cure de probiotiques ? Est ce ridicule d’en parler à mon médecin ?
A vous lire, merci.
Bonsoir Marie,
De prime abord, le lien semble délicat à établir. Toutefois, la phagothérapie est parfois utilisée dans ce type d’indication, le mieux serait donc de vous rapprocher d’un professionnel expert du sujet du microbiote.