Constat malheureusement évident : la population sportive consomme, car c’est bien là le terme, davantage d’anti-inflammatoires que la population générale, d’autant plus facilement que nombre d’entre eux sont désormais accessibles sans ordonnance. Au même titre que les antiasthmatiques ou les antiallergiques, les anti-inflammatoires non stéroïdiens (AINS) sont en effet utilisés selon une fréquence 2 à 4 fois plus importante dans les populations sportives (1). L’incidence précise de cette pratique demeure difficile à évaluer, mais le recueil d’informations lors de contrôles anti-dopage, des enquêtes ciblées auprès des médecins d’équipes lors de championnats officiels ou l’interrogatoire de sportifs lors de compétitions permet malgré tout de se faire une idée. Une étude de 2001 met en évidence une positivité de substances antalgiques dans l’urine de 11,5% des athlètes participant à un trail (2). Lors d’un Ironman, parmi les 26 % de participants ayant accepté d’être interrogés sur leur prise de médicaments, 59,9% ont pris des AINS dans les 3 mois qui précédèrent le course, 25,5% la veille de la course, 17 ,9 % juste avant la course et 47,4% pendant la course. Parmi ceux qui en ont consommé durant les 3 mois précédents, 7,7% en prenaient quotidiennement et 8,7% toutes les semaines (3). Enfin, une étude menée auprès de cyclistes révèle une prise par « seulement » 24% du peloton (4).
Pourquoi l’inflammation est-elle au cœur des débats ?
L’exercice régulier, notamment en phase excentrique ou en descente, provoque des microtraumatismes au niveau de divers tissus : muscle squelettique, tissus osseux, conjonctifs (tendons, ligaments) et intramusculaires (5, 6). Dans le cadre d’un entraînement associé à une récupération adaptée, ces atteintes sont toutefois qualifiées d’adaptatives (6, 7). En effet, ces microlésions occasionnent une réponse inflammatoire modérée, physiologique, et donc nécessaire à la cicatrisation des zones lésées : il s’agit d’une inflammation aiguë. Une fois cicatrisés, les tissus disposent ainsi d’une plus grande résistance aux futures sollicitations. Cette inflammation « contrôlée » contribue donc pleinement au phénomène d’adaptation à l’entraînement et donc d’optimisation naturelle des performances. A l’appui de cette hypothèse, Tim Noakes précise que lorsqu’un coureur à pied introduit méthodiquement des séances de course en descente à sa préparation, ce travail excentrique présente deux caractéristiques : d’une part, le même effort, répété un peu plus tard, sera beaucoup moins traumatisant ; d’autre part, il suffira d’accomplir une session de ce type toutes les trois semaines pour en conserver un bénéfice au cours de cette période (5, 8).
Ne pas confondre inflammation aiguë et désadaptation
A la différence de l’inflammation aiguë, l’inflammation chronique n’évolue pas vers une guérison spontanée car elle persiste, voire s’aggrave pendant plusieurs mois ou plusieurs années. Deux circonstances de survenue des inflammations chroniques peuvent être distinguées :
- Les inflammations aiguës évoluent en inflammations prolongées chroniques lorsque l’agent pathogène initial persiste dans les tissus ou lorsqu’une inflammation aiguë récidive de façon répétée dans le même organe en entraînant à chaque épisode des destructions tissulaires de moins en moins bien réparées.
- Les inflammations peuvent parfois se manifester d’emblée sous une forme apparemment chronique. La phase aiguë passe alors inaperçue, car brève ou asymptomatique. C’est souvent le cas de maladies auto-immunes.
Quel que soit le mécanisme d’installation et de chronicisation de l’inflammation, il traduit toujours une incapacité de l’organisme à rétablir son équilibre, l’homéostasie, pouvant évoluer vers une véritable désadaptation. En effet, lorsque l’entraînement devient trop intensif et/ou la récupération insuffisante, les microtraumatismes peuvent provoquer des blessures aiguës nécessitant une attention particulière. Selon Smith, ces traumatismes peuvent également s’avérer à l’origine d’inflammations impliquées dans le syndrome du surentraînement. Toutefois ces dernières seraient sous-jacentes, plus diffuses, de faible intensité et donc plus délicates à identifier (6). Plusieurs auteurs confirment d’ailleurs l’existence antérieure d’inflammations tissulaires chez des athlètes surentraînés (8, 9). Quelle que soit la localisation ou la nature du traumatisme tissulaire, la réponse de l’organisme reste toujours une inflammation. L’inflammation aiguë demeure le seul mécanisme capable de promouvoir la régénération. Cette dernière nécessite environ 72h, bien qu’elle ne puisse être complètement résorbée avant 6 semaines (6). Pour autant, si pour diverses raisons cette situation demeure non compensée (récupération insuffisante, charge d’entraînement trop lourde, répétitions de stimulus, état nutritionnel inadapté), le risque d’évolution progressive vers la chronicité devient alors majeur (10). Expliquant en partie la fréquence élevée de prise d’AINS parmi la population sportive.
Bref état des lieux sur l’utilisation des anti-inflammatoires
Les AINS sont souvent utilisés pour traiter la douleur ou pour en atténuer les effets. De manière plus détaillée, le principal mécanisme d’action des AINS est une inhibition de la synthèse des prostaglandines par blocage de la cyclo-oxygénase (COX) pour réduire la réponse inflammatoire, bien que celle-ci participe au processus de guérison et de cicatrisation.
Les AINS ciblent deux classes d’enzyme : les enzymes COX-1 et COX-2. Les COX-1 sont constitutives de l’organisme et sont présentes dans la plupart des cellules. Les COX-2 s’expriment majoritairement dans les cellules endothéliales vasculaires, rénales, et dans le système nerveux central. Leur expression augmente en cas d’inflammation.
Il existe différents types d’AINS :
- Les AINS classiques : ils ne sont pas spécifiques de la COX-2 et agissent donc également sur la COX-1, pouvant alors entraîner des effets secondaires. Leur durée d’utilisation doit donc être limitée.
- Les AINS semi-sélectifs : ils présentent un effet faible sur la COX-1 mais maintenu sur la COX-2 (Méloxicam, Nabumétone).
- Les AINS spécifiques de la COX-2 : ils ciblent uniquement cette classe d’enzymes et sont donc très spécifiques de la réaction inflammatoire. On les appelle les Coxib (Célécoxib, Etoricoxib).
En cas de blessure, un des éléments clés du processus de guérison est lié à la mobilisation du tissu lésé. Ainsi, les anti-inflammatoires peuvent être prescrits pour permettre cette mobilisation via une action antalgique, malgré un effet non supérieur au paracétamol (11). Ils sont également utilisés spontanément pour réduire des situations douloureuses diverses telles que les douleurs articulaires ou tendineuses. Dans le cas de la pratique sportive et des affections qui en découlent, la réaction inflammatoire est pourtant parfois inexistante ou représente simplement la première étape physiologique du processus de guérison. Il apparaît donc inadapté, voire contre-productif, de chercher à la supprimer. Par exemple, en cas de lésion musculaire traumatique, le recours aux AINS entraverait le processus de cicatrisation via la limitation de la réaction inflammatoire physiologique initiale et inhiberait la synthèse protéique. Ainsi, les coureurs ayant recours à des AINS à titre préventif présenteraient des marqueurs biologiques de souffrance musculaire plus élevés que ceux n’utilisant pas ces drogues. Nombreux sont les sportifs ayant pourtant recours aux AINS dans le cadre préventif d’une compétition, d’un entraînement de longue durée ou d’une sollicitation musculaire inhabituelle. L’étude menée auprès des Ironman confirme ce point : l’utilisation des AINS pour des raisons thérapeutiques s’est en effet avérée rare, les principales raisons évoquées étant la prévention de douleurs, la recherche de leur effet antalgique aussi bien lors de compétitions qu’à l’entraînement. Parmi les consommateurs d’AINS, 63,8% apparaissaient pourtant au courant d’éventuelles complications gastro-intestinales, ou rénales dans 31% des cas, en sachant que la moitié s’était procurée les médicaments sans ordonnance médicale… Car effectivement, consommer des anti-inflammatoires à l’instar du paquet de fraises Tagada n’est pas sans risques. De par leur effet hypertenseur, les AINS peuvent par ailleurs être impliqués dans la survenue d’accidents cardio-vasculaires lorsqu’ils sont utilisés en forte quantité. La toxicité gastro-intestinale des AINS apparaît surtout lors d’une prise chronique et se traduit par des nausées, des dyspepsies, des ulcères, voire des saignements (12). Une étude met notamment en évidence qu’environ 18% des troubles gastro-intestinaux sont à corréler à la prise d’AINS (13). Chez les sportifs d’endurance, la prise d’AINS est de plus associée à un risque accru d’hyponatrémie, donc de complications rénales en cas de fortes chaleurs associées à des déshydratations (14).
Mais alors, quel est le lien avec la nutrition dans tout ça ?
Nutrition et inflammation
Vous l’avez compris, comme toujours en biologie, tout est une question d’équilibre. Et nous parlons ici d’équilibre au sens cellulaire du terme, ce que l’on appelle l’homéostasie. Le contrôle de l’inflammation fait partie de ces facteurs d’équilibre et, pour faire simple, point d’inflammation contrôlée en cas d’alimentation inadaptée ! De nombreux facteurs nutritionnels interviennent en effet dans la régulation de l’inflammation.
La réponse inflammatoire en détails
La réaction inflammatoire est un mécanisme physiologique indispensable au maintien de la vie, elle est donc bénéfique. De manière simplifiée, il s’agit d’une réponse des tissus face à une agression dont les origines peuvent être multiples : agent infectieux, substance étrangère, agent physique, agent chimique, défaut de vascularisation, lésion tissulaire post-traumatique, anomalie du système immunitaire, etc. Le but est alors d’éliminer l’agent pathogène ou de réparer les tissus lésés via la réponse inflammatoire. Pour ce faire, l’organisme met en jeu de nombreux médiateurs et différentes cellules dont l’ordre d’intervention est complexe et variable, certains d’entre eux étant produits par différentes cellules contrôlant parfois leur propre production par régulation rétroactive. En bref, les mécanismes de la réponse inflammatoire sont loin d’être simples… Nous allons donc ici en dresser les grandes lignes simplifiées.
La réponse inflammatoire fait appel à des modifications de la matrice extracellulaire et à de nombreuses cellules. Il peut s’agir de cellules sanguines circulantes (polynucléaires, monocytes, plaquettes, etc.) ou de cellules résidentes tissulaires (macrophages, cellules endothéliales, fibroblastes, etc.). La réponse inflammatoire mobilise également des médiateurs chimiques à caractère pro ou anti-inflammatoire. Il peut s’agir de systèmes protéiques complexes (système contact, de coagulation, de la fibrinolyse et du complément) ou de médiateurs cellulaires : histamine, sérotonine, eicosanoïdes, radicaux libres, monoxyde d’azote, cytokines, substance P, neurokinine, enzymes de destruction tissulaire, etc. Intéressons-nous ici à ceux envers laquelle la nutrition joue un rôle.
Retrouvez par ailleurs mon article sur la désadaptation à l’effort, voire le surentraînement, en cas de non-contrôle de cette inflammation.
1) Les eicosanoïdes
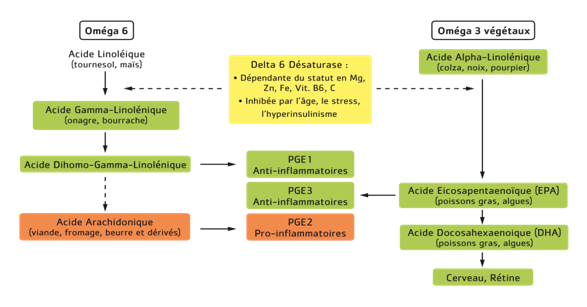
Il s’agit de molécules dérivant directement d’un composant de la membrane des cellules inflammatoires et libérées sous l’action d’une enzyme (phospholipase A2), l’acide arachidonique. Or l’acide arachidonique est un composant des graisses alimentaires particulièrement abondant dans les produits animaux (viandes, beurre et aliments en contenant) ou pouvant être fabriqué par l’organisme à partir d’acide linoléique, un autre acide gras de la famille des omégas 6, contenu lui dans les huiles végétales (pépins de raisins, maïs, tournesol, etc.). L’acide arachidonique va donc être à l’origine de la synthèse de médiateurs – les leucotriènes et les prostaglandines – fortement impliqués dans le développement de l’inflammation, de la douleur et de la fièvre (PGIE, PGD2, PGE2, PGF2, TXA2). Il est intéressant de noter que la synthèse des prostaglandines à partir de l’acide arachidonique se réalise via une enzyme clé, la cyclo-oxygène 2 ou COX2, l’enzyme cible des AINS.
D’autres prostaglandines possèdent à l’inverse un rôle anti-inflammatoire, il s’agit notamment des PGE3, dont la synthèse dérive d’un autre acide gras d’origine alimentaire, l’acide eicosapentaénoïque ou EPA, de la famille des omégas 3. L’EPA peut être apporté directement par la consommation de poissons gras (sardines, anchois, maquereaux, thon frais, saumon) et d’algues, ou fabriqué à partir d’un acide gras d’origine végétale, l’acide alpha-linolénique, contenu notamment dans les huiles vierges première pression à froid de colza, de noix, de lin, de cameline et dans le pourpier. Ainsi, la consommation d’une quantité adaptée d’oméga 3 permet de moduler la réponse inflammatoire systémique via la synthèse de PGE3 au détriment des PGE2. En effet, l’enzyme permettant d’assurer la synthèse d’acide arachidonique et celle d’EPA est commune, il s’agit de la delta 6 désaturase. Ainsi, une consommation excessive d’un des acides gras, au détriment de l’autre, sollicite davantage l’enzyme au profit d’une voie et la dévie de ce fait de l’autre voie. Le rapport physiologique d’apport alimentaire entre les deux familles est d’1 g d’oméga 3 pour 3 à 5 g d’oméga 6 : or le rapport de consommation actuelle de graisses alimentaires en France est d’1 g d’oméga 3 pour 12,6 g d’oméga 6, favorisant ainsi le métabolisme des prostaglandines vers la voie pro-inflammatoire. Vous suivez toujours ? Il ne s’agit pas de parler ici de bonnes ou de mauvaises graisses, mais encore une fois d’équilibre général, donc de favoriser une plus grande consommation d’omégas 3 au détriment des omégas 6 pour rétablir un équilibre physiologique. A noter que consommer une huile industrielle raffinée marquetée comme équilibrée en oméga 3 et oméga 6 n’est pas suffisante pour rétablir cet équilibre puisqu’elle ne fait que le maintenir. Il faut en effet « inverser la balance ». Par ailleurs, un statut nutritionnel optimal en Zinc, Fer, Vit. B6 et C, est nécessaire pour assurer une bonne fonctionnalité de l’enzyme évoquée.
Métabolisme des acides gras et des prostaglandines
Retrouvez mes conseils sur l’importance des graisses de qualité.
2) Les radicaux libres
Quand on évoque le terme de radicaux libres, on pense généralement à des molécules néfastes. Loin de là cette idée. Il s’agit en effet avant tout de molécules indispensables au bon fonctionnement de l’organisme. Encore une fois, la machinerie cellulaire est formidablement complexe et il paraîtrait difficile d’imaginer pour quelle raison elle produirait volontairement des molécules toxiques pour elle ! Non, ce qui pose problème est davantage le basculement d’une situation au cours de laquelle la production de radicaux libres est contrôlée, vers un emballement du système du fait d’une production trop importante ou d’un manque de défenses anti-oxydantes. Tout est une question… d’équilibre ! Ainsi, un excès de production lié notamment à la consommation accrue d’oxygène au cours de l’effort ou un déficit nutritionnel en antioxydants, peut favoriser un déséquilibre du stress oxydant à l’origine d’une altération des structures cellulaires et d’un contexte favorisant l’amplification de l’inflammation. La satisfaction des besoins en nutriments antioxydants (vitamines C, A, E, Zinc, Sélénium, Cuivre, Manganèse, polyphénols) représente donc un facteur important en matière de nutrition sportive : vous pouvez donc « abuser » (si tant est que votre intestin le supporte) des végétaux de saison et d’origine locale, véritables mines d’or en terme d’apports antioxydants. Le thé vert notamment, riche en flavonoïdes, est une boisson anti-oxydante par excellence, de même que la curcumine du curcuma.
Retrouvez mon article sur l’importance du stress oxydant en phase de récupération et l’intérêt ou non d’avoir recours à des antioxydants, pouvant alors altérer le processus physiologique d’adaptation.
3) Les cytokines
Les cytokines sont des glycoprotéines solubles libérées sont l’influence de stimulus variés. Elles peuvent être considérées comme des messagers de l’information inflammatoire ou immunitaire entre les différentes cellules, intervenant selon un mécanisme particulièrement complexe et varié, plus de 40 cytokines ayant été décrites à ce jour. Nous n’allons donc pas toutes les détailler bien entendu, citons simplement ici celles qui sont principalement impliquées dans la réponse inflammatoire : les interleukines (IL-1, IL-6, IL-8, IL-10 et les facteurs de nécrose tumorale (TNFα et TNFβ).
Cytokines et flore intestinale
Et oui, encore et toujours l’intestin… Organe majeur dont on a pourtant longtemps sous-estimé le rôle systémique sur la santé. Pour rappel, la flore intestinale est constituée de plus de 100 000 milliards de bactéries. Le système immunitaire du tube digestif est en dialogue constant avec le microbiote intestinal. Il reconnaît en effet les fragments antigéniques des molécules constitutives des bactéries, leurs métabolites ou des fragments de peptides alimentaires. La reconnaissance de ces antigènes par la flore intestinale va engendrer une production de cytokines dans le but d’apporter des réponses immunitaires et inflammatoires adaptées. Un déséquilibre de la flore intestinale peut alors induire une production inadaptée de cytokines pro-inflammatoires, en particulier d’IL-6, et emballer le système jusqu’à potentiellement modifier le fonctionnement du système nerveux central. En effet, les cytokines sont des messagers, pouvant agir en transmettant directement l’information d’une cellule à une autre (action paracrine), mais aussi à l’organisme entier lorsqu’elles sont présentes en concentration importante dans le sang (action endocrine). Les différents organes sont alors informés : le cerveau, le foie, les reins et les cellules du système immunitaire. La perturbation du microbiote intestinal peut donc représenter une voie de pérennisation de l’inflammation ou de perturbation de l’immunité, en particulier lorsqu’elle est associée à une hyperperméabilité de la muqueuse intestinale à l’origine d’un passage accru de fragments peptidiques d’origine bactérienne (endotoxines) ou alimentaire dans le milieu intérieur. Cette augmentation de la perméabilité intestinale peut être provoquée par de nombreux facteurs, notamment par certaines bactéries pathogènes ou par la gliadine du gluten, à l’origine d’une sécrétion accrue de zonuline, une protéine responsable de l’écartement des cellules intestinales (entérocytes) entre elles. Notons que le même mécanisme peut être impliqué dans l’altération de la barrière hémato-méningée au niveau du cerveau, ce mécanisme représente d’ailleurs une piste de recherche intéressante des liens pouvant exister entre la dépression et l’inflammation chronique. Au delà de savoir qui relève de l’œuf ou de la poule, ce qui est important à retenir ici en synthèse est qu’une perturbation de l’écosystème intestinal (flore et/ou perméabilité accrue) peut favoriser la production de médiateurs inflammatoires, eux-mêmes à l’origine d’une augmentation de la perturbation de l’équilibre intestinal. Vous comprenez donc tout l’enjeu de prendre soin de vos intestins ! D’autant plus que chez le sportif, la répétition des variations de débit sanguin au niveau de la muqueuse intestinale (mécanisme d’ischémie-reperfusion, accentué par la déshydratation) favorise cette perméabilité, du fait de la production accrue de radicaux libres et de leur attaque des jonctions serrées assurant l’imperméabilité physiologique de la muqueuse de l’intestin. Nous revenons ainsi au rôle majeur des antioxydants, donc à la consommation de végétaux de qualité. Enfin, précisons que la prise d’AINS favorise la perméabilité intestinale, en diminuant la production locale de prostaglandines stimulant normalement la production de mucus protecteur.
Retrouvez mon article sur l’importance du microbiote et de l’écosystème intestinal sur la santé, et en particulier sur le contrôle de l’inflammation.
Cytokines et insuline
Encore un sujet bien vaste… Pour le simplifier au maximum, retenons que de forts taux d’IL-6 sont responsables d’une augmentation de la résistance à l’insuline ou insulino-résistance (15). Une restriction calorique pendant 3 semaines chez des patientes obèses a notamment pour effet de réduire le taux circulant d’IL-6 (16). Il apparaît en effet que le tissu adipeux, loin d’être un simple réservoir de graisses, est à l’origine d’une production d’hormones et de médiateurs, dont l’IL-6, favorisant ainsi l’inflammation chronique. En effet, une forte sécrétion par le tissu adipeux d’une autre cytokine, TNF alpha, favorise également l’insulino-résistance chez la souris (17). Le tissu adipeux est donc loin d’être un vulgaire réservoir de graisses, il joue de nombreux rôles de régulation et l’obésité apparaît comme une origine d’amplification et de pérennisation de la réponse inflammatoire. Certes, les sportifs sont globalement peu concernés par l’obésité, par contre ils le sont beaucoup plus par leur choix de glucides, nutriment de prédilection pour de nombreux athlètes ou entraîneurs. Privilégier des aliments glucidiques dont l’index glycémique est faible permet de limiter l’insulino-résistance à long terme, donc favorise une meilleure gestion du poids et de l’inflammation à bas bruit. Plusieurs méta-analyses mettent en effet en évidence l’effet d’un régime riche en aliments à index glycémique élevé sur certains marqueurs de l’inflammation, notamment l’IL-6 (18, 19).
Retrouvez mon article sur l’index glycémique et l’importance du contrôle de la glycémie sur la santé.
Privilégiez les cuissons douces
Un chimiste français, Louis-Camille Maillard, découvrait en 1911 que des acides aminés mis en présence de sucres et à température élevée brunissaient en créant des composés très voisins de l’humus. Il expose cette découverte à l’Académie des Sciences, puis dans un ouvrage publié en 1913 : « Genèse des matières humiques et des matières protéiques ». Cette réaction chimique est depuis appelée réaction de Maillard, connue dans le monde scientifique sous le nom de glycation. Derrière ce terme scientifique se cache la résolution du mystère de la saveur particulière de la croûte du pain, du goût grillé de la viande ou biscuité des pâtisseries, de la saveur issue de la torréfaction du café, du chocolat ou du gout particulier de la volaille rôtie. Que du bonheur ! Me direz-vous. Oui, mais… De telles cuissons à forte température induisent la production de substances inexistantes à l’état naturel et pour lesquelles notre intestin et nos cellules ne disposent pas des enzymes nécessaires à leur digestion, absorption et utilisation. Parmi elles, l’acrylamide est formée lors de la cuisson forte d’aliments riches en amidon et sucres complexes, par exemple dans les chips et les céréales du petit déjeuner, les poudres de café, de chicorée, et tous les aliments fortement grillés ou cuits à plus de 120°C. Son pouvoir cancérigène et toxique pour les cellules de la reproduction et du système nerveux est reconnu, l’OMS la reconnaît d’ailleurs comme « présentant un risque pour la santé humaine ». Les corps de Maillard sont des produits intermédiaires de la formation de produits terminaux de la glycation ou AGE (Advanced Glycation End products) qui, lorsqu’ils sont présents au sein de l’organisme favorisent l’augmentation de la production d’IL-6, IL-1α et TNFα via un stress oxydant majoré.
Les réactions de Maillard peuvent avoir lieu en dehors de la cuisson, à faible température, mais sont très lentes. Une augmentation de température de 10°C double en moyenne la vitesse de réaction (20). Jusqu’à la maîtrise du feu, il n’y a que quelques milliers d’années, l’homme mangeait cru et les enzymes de la digestion et de l’absorption y étaient adaptées. L’évolution des habitudes alimentaires a été bien plus rapide que l’évolution génétique de l’espèce et la consommation de corps de Maillard en grande partie liée aux modes de cuisson est devenue majeure avec l’avènement de l’alimentation moderne, confrontant notre organisme à une certaine inadaptation entre les produits consommés et les capacités biologiques à les digérer, absorber, utiliser et éliminer. Il est pourtant possible de préserver une alimentation goûteuse, conviviale et compatible avec les usages contemporains sans revenir à la consommation exclusive d’aliments crus. Les cuissons douces, en particulier à la vapeur, sont très bien adaptées. Les tartares et carpaccios sont parfaits… En limitant la consommation de plats cuisinés industriels, en limitant le recours aux grillades, fritures au profit du goût des aliments frais et peu cuits, il est aisément possible de réduire la quantité de corps de Maillard que nous ingérons. Certes, rien de tel qu’un bon barbecue entre amis pour profitez de l’été. Par contre, évitez dès lors de laisser la viande bruler sur le feu… Et si vous êtes adapte du vin en accompagnement de cette grillade, préférer un bon verre de vin rouge au rosé permet d’enrichir votre repas en un actif végétal aux pouvoirs antioxydants particulièrement importants, le resvératrol. Et pour aller jusqu’au bout du raisonnement sur le sujet, même si un tel choix peut apparaître contraire à ce que vous guide vos papilles gustatives, un jeune vin tannique s’avèrera plus riche en antioxydants actifs qu’un grand crû datant de quelques décennies… Et si vous voulez opter pour une douceur après le repas, optez pour le chocolat noir. Une étude italienne a démontré auprès de 2000 personnes que celles qui en mangeaient régulièrement (jusqu’à 20 grammes par jour) avaient des niveaux sanguins plus faibles de protéine réactive C, un marqueur de l’inflammation, que ceux qui n’en consommaient jamais.
En synthèse, la notion de réponse inflammatoire est passionnante. La quantité d’AINS consommés dans le monde sportif révèle la recherche d’une solution miracle ponctuelle, avant tout à titre préventif plus que curatif. Or si l’inflammation aigüe est non seulement physiologique, elle contribue aussi et surtout à une meilleure adaptation à l’effort, donc à une amélioration des performances. Par contre, le basculement d’une situation ponctuelle et contrôlée vers une phase inflammatoire chronique et systémique est lui, la traduction d’une désadaptation de l’organisme face aux sollicitations. Et la nutrition est au cœur de ce basculement : en effet, la qualité des graisses consommées, la quantité de végétaux, la nature des cuissons ou encore le choix des aliments glucidiques représentent des axes essentiels pour permettre à l’organisme de répondre favorablement aux sollicitations de l’environnement et donc d’optimiser sa santé. Car n’oublions pas que si récupérer d’une situation inflammatoire peut apparaître important pour les performances, elle l’est surtout pour le maintien de la santé.
Bon appétit !
Anthony Berthou
Références :
- Alaranta A, Alaranta H, Heliövaara M, Airaksinen M, Helenius I. Ample use of physician-prescribed medications in finish elites athletes. Int J Sports Med. 2006 Nov;27(11):919-25.
- Mahler N. Medikamentenmissbrauch im Breitensport. Ther Umsch 2001; 58: 226–231.
- Gorski T, Cadore EL, Pinto SS, da Silva EM, Correa CS, Beltrami FG, Kruel LF. Use of NSAIDs in triathletes: prevalence, level of awareness and reason for use. Br J Sports Med. 2011 Feb;45(2):85-90.
- Riché D. Hyperperméabilité intestinale chez le sportif : mécanismes, consequences et prise en charge nutritionnelle. NAFAS. Vol 2, n°3, Sept 2004.
- Riché D. Micronutrition, alimentation-santé et exercice. De Boeck ed., 2005.
- Smith LL. Tissue trauma: the underlying cause of overtraining syndrome? J Strength Cond Res. 2004 Feb;18(1):185-93.
- Smith LL. Overtraining, excessive exercise, and altered immune function : is this a T helper 1- Versus a T helper-2 lymphocyte response ? Sports Med. 33(5) : 347-364.
- Noakes TD. Lore of running. 4th Capetown Univ.Press. USA. 2001.
- Hikida RS, Staron RS, Hagerman FC, Sherman WM, Costill DL. Muscle fiber necrosis associated with human marathon runners. J Neurol Sci. 1983 May;59(2):185-203.
- Buckley CD, Pilling D, Lord JM, Akbar AN, Scheel-Toellner D, Salmon M. Fibroblasts regulate the switch from acute resolving to chronic persistent inflammation. Trends Immunol. 2001 Apr;22(4):199-204.
- Ziltener JL, Leal S, Fournier PE. Non-steroidal anti-inflammatory drugs for athletes: an update. Ann Phys Rehabil Med. 2010 May;53(4):278-82, 282-8.
- Woo WW, Man SY, Lam PK, Rainer TH. Randomized double-blind trial comparing oral paracetamol and oral nonsteroidal antiinflammatory drugs for treating pain after musculoskeletal injury. Ann. Emerg. Med. 2005; 46: 352–361.
- Van Wijck K, Lenaerts K, Van Bijnen AA, Boonen B, Van Loon LJ, Dejong CH, Buurman WA. Aggravation of exercise-induced intestinal injury by ibuprofen in athletes. Med Sci Sports Exerc. 2012 Dec;44(12):2257-62.
- Wharam PC, Speedy DB, Noakes TD, Thompson JM, Reid SA, Holtzhausen LM. NSAID use increases the risk of developing hyponatremia during an ironman triathlon. Med. Sci. Sports Exerc. 2006 Apr; 38(4): 618–622.
- Kern PA, Ranganathan S, Li C, Wood L, Ranganathan G. Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance. Am J Physiol Endocrinol Metab 2001 May; 280(5): E745-E751.
- Bastard JP, Jardel C, Bruckert E, Blondy P, Capeau J, Laville M, Vidal H, Hainque B. Elevated levels of interleukin 6 are reduced in serum and subcutaneous adipose tissue of obese women after weight loss. J Clin Endocrinol Metab 2000 Sep; 85 (0): 3338-42.
- Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science. 1993 Jan 1;259(5091):87-91.
- Buyken AE, Goletzke J, Joslowski G, Felbick A, Cheng G, Herder C, Brand-Miller JC. Association between carbohydrate quality and inflammatory markers: systematic review of observational and interventional studies. Am J Clin Nutr 2014.
- Schwingshackl L,Hoffmann G. Long-term effects of low glycemic index/load vs. high glycemic index/load diets on parameters of obesity and obesity-associated risks: a systematic review and meta-analysis, Nutr Metab Cardiovasc Dis. 2013 Aug;23(8):699-706.
- http://www.lc-maillard.org/PDF/recup.pdf



Certains de vos termes employés comme prostaglandines échappent à ma culture , et pourtant je m’intéresse à la nutrithérapie ,car je souffre d’inflammations fréquentes à l’encéphale depuis que ,après nettoyage métaux lourds après dépose amalgames , je fut la victime d’un dentiste malveillant qui en dépit de ma demande de ne pas me mettre d’amalgame m’en mit un énorme si bien que ma santé et vigilance déclinèrent rapidement . Je vais mieux maintenant mais aie perdu mon ancienne capacité à la lecture pendant des heures . Je cherche des pistes alimentaire bien que je privilégie aliments basiques . Suis intolérant gluten ( ancien schizophrène puis bi-polaire , ainsi qu’asthmatique médicamenteux guéri de ces problèmes ) aux prod laitiers , soja et oeuf . Lu le livre de Perlmutter : “Ces glucides qui menacent votre santé ” Que me conseillez vous pour récupérer intégrité cérébrale ?
Il faut aider votre organisme à se détoxiquer. C’est un sujet complexe les personnes les plus à la pointe en terme de protocole holistiques sont Chris Shade au Canada et le Dr G. Georgiou en Grèce. Au niveau de l’alimentation, abusez des crucifères sous toutes leurs formes, gingembre, et beaucoup d’acide ascorbique (achetez-le par kilo).
Je suis scotchée de lire qu’une telle proportion de sportifs consomment des anti-inflammatoires en préventif. L’article est très clair et soulève 2 questions :
– est-ce qu’une alimentation constituée de produits bruts ou peu transformés, basée sur une conso de produits frais et de saison, peut réellement combler les besoins en antioxydants (notamment) d’un sportif d’endurance qui pratique 4 à 6h d’endurance par semaine ? ou la complémentation est-elle indispensable ?
– sachant que certains aliments non issus de la filière bio sont des réservoirs de produits phyto sanitaires (vin, pomme…), est-ce que les bénéfices liés aux micronutriments de ces produits est supérieur aux inconvénients liés à la présence des ces résidus de produits phyto ? Plus globalement, y a t-il une balance bénéfice/risque positive à avoir une alimentation saine (peu de produits transformés, beaucoup de végétaux crus ou cuits vapeur…) mais non bio ?
D’avance merci.
Bonjour,
Vous trouverez deux articles qui peuvent vous guider :
https://www.sante-et-nutrition.com/nutrition-metabolisme/
https://www.sante-et-nutrition.com/qualite-nutritionnelle-produits-bio/