Difficile de passer à côté l’aluminium en 2019 tant ce métal est omniprésent dans notre environnement. En soi, il s’agit d’une situation logique. L’aluminium est en effet le métal le plus abondant de la croute terrestre sous forme de bauxite, à partir duquel est extrait l’oxyde d’aluminium, également appelée alumine. La bauxite est un minerai contenant entre 40 à 60% d’oxyde d’aluminium hydraté, mélangé à de la silice et à de l’oxyde de fer lui conférant sa couleur rouge. Extrait sous forme d’une fine couche d’oxyde d’aluminium de cinq à dix nanomètres à la suite de plusieurs procédés industriels, il devient facilement malléable. Il peut par ailleurs ensuite être épaissi par un procédé dit d’anodisation pour former l’aluminium anodisé.
C’est au cours du XIXème siècle que l’homme a compris toutes les perspectives que pouvait apporter la maîtrise de ce métal : léger, durable, souple, malléable, excellent conducteur, économique, résistant à la corrosion, facilement associable à d’autres métaux, recyclage et ce presque indéfiniment. L’aluminium connait ses heures de gloire d’innovation au siècle dernier : depuis la cafetière octogonale d’Alfonso Bialetti en 1930, en passant par la première cannette en 1956, Spoutnik en 1957, la désormais célèbre capsule Nespresso en 1986 jusqu’à l’allégement de l’Audi 18 de 40% en 1994. L’aluminium devient le métal plus utilisé après le fer. On le retrouve dans les câbles pour le transport de l’énergie, les voitures, les avions, les bateaux, les trains, les vélos, les bâtons de ski, les clubs de golf, les appareils électroménagers, les ustensiles de cuisine, les smartphones, le mobilier, les panneaux, l’eau du robinet, les produits pharmaceutiques, l’alimentation, les cosmétiques, etc. Bref, partout. Le niveau d’exposition a donc fortement augmenté depuis le siècle dernier. En moyenne, nous sommes passés de 1 mg par jour en 1950 à environ 30 mg actuellement et selon les projections, nous tendons à 100 mg en 2050 1. Normal. Que demander de plus à un métal ? Pas grand-chose, si ce n’est peut-être un point essentiel : son innocuité.
A ce stade de lecture, retenons que l’aluminium a toujours été omniprésent dans la croute terrestre et qu’il mériterait … d’y rester. Le problème réside en effet davantage dans son extraction et sa transformation par la main industrielle de l’homme afin de l’utiliser pour les différentes applications indiquées. Précisons également que l’aluminium ainsi rejeté dans la nature ne peut plus réintégrer la lithosphère. Il s’accumule depuis des décennies sous une forme non originelle dans l’environnement, faisant émerger des problématiques de gestion des sols et des eaux acides (jusqu’à 700 μg d’aluminium par litre d’eau), donc une atteinte de la biodiversité2 et la mort de poissons par exemple, même à faible concentration3. Dans certaines circonstances, notamment en présence d’un pH acide (<6,2), l’aluminium peut en effet être réduit et présent sous sa forme libre Al3+ (aq). Chez l’homme, les effets de cette forme réactive sont encore peu étudiés.
Si vous souhaitez allez à l’essentiel, voici un tableau synthétique des principales données à retenir
| Question | |
| Que devient l’aluminium une fois dans l’organisme ? | Une fois dans le sang, l’aluminium est essentiellement transporté via une protéine, la transferrine, notamment en fonction de la présence de certaines molécules considérées comme des ligands, dont le citrate ou le phosphate. Les deux tissus susceptibles de contenir le plus d’aluminium seraient la langue et les os, puis le foie, les poumons, les reins, le système immunitaire et le cerveau. Les mécanismes d’accumulation selon les tissus sont peu connus et non homogènes. La distribution de l’aluminium peut être variable d’un organe à un autre, mais il est désormais établi qu’il est présent… partout. |
| Quels sont les effets suspectés de l’aluminium sur la santé ? | · La toxicité la plus reconnue est le risque d’encéphalopathie en cas de dialyse réalisée chez des personnes souffrant d’insuffisance rénale, parfois constatée en cas de concentration élevée en aluminium dans l’eau de ville ou lors de défaillance du système de traitement de l’eau de dialyse. A cette complication neurologique peuvent être associées d’autres conséquences, dont une atteinte osseuse et une anémie. · L’aluminium à l’état libre est, comme de nombreux métaux, extrêmement réactif. Il représente donc un initiateur de stress oxydatif majeur. Il favorise ainsi l’amplification et la pérennisation de l’inflammation dans de nombreuses pathologies comme la sclérose en plaques, la maladie de Crohn, l’asthme, l’autisme, le défaut de fertilité, l’épilepsie ou encore la myofasciite à macrophages (voir encadré). · L’aluminium est dit « exocytotoxique ». En d’autres termes, il s’agit d’un composé hautement toxique pour les cellules, notamment au niveau cérébral. Il peut perturber plus de 200 réactions biologiques, expliquant ainsi son incrimination dans la maladie de Parkinson, d’Alzheimer ou de manière générale dans les neuro-inflammations. · Puissant immunostimulant, l’aluminium est utilisé dans la grande majorité des vaccins pour potentialiser les effets des antigènes inoculés. Or, à ce jour, il existe peu de données permettant d’en expliquer le mécanisme et par voie de conséquence ses effets toxiques potentiels. De manière simplifiée, l’aluminium peut être considéré comme une forme de catalyseur de l’action des cellules immunitaires, d’où l’intérêt des laboratoires pharmaceutiques envers ce dernier afin d’optimiser les couts de fabrication. Il semble surtout exister une forte prédisposition individuelle. · L’aluminium est reconnu comme un mutagène, en particulier dans le cadre des cancers du sein, du poumon et de la vessie chez les travailleurs de l’aluminium. Il est également fortement incriminé pour ses risques tératogènes (de fausse couche) et ses effets sur le développement du fœtus, fortement exposé pendant la grossesse. |
| Quelle est la dose maximale tolérée ? | 1 mg/kg pc/semaine, soit en moyenne 8,5mg/j pour un adulte selon l’EFSA. |
| Quels sont les aliments à surveiller ? | · Limiter la consommation de thé (idéalement, rechercher un thé peu contaminé auprès d’un spécialiste du thé disposant d’analyses). · Certains produits transformés contenant les additifs ci-dessous, notamment le pain, les biscuits, la charcuterie ou encore certains fromages. Une majorité de produits céréaliers et de préparations à faire cuire au four contiennent entre 5 et 10 mg d’aluminium par kilo, notamment les viennoiseries industrielles et les barres de céréales (7,2 mg/kg). · Le chocolat peut contenir jusqu’à plus de 50 mg/kg, 3,7 mg/kg en moyenne. Si l’usage du papier d’aluminium n’arrange rien, la présence d’aluminium est avant tout liée au cacao lui-même. · Certains légumes tels que les champignons, les épinards, les radis, les bettes ou la laitue contiennent de 5 à 10 mg d’aluminium par kg d’aliments. Les cornichons (présence de sels d’aluminium dans les saumures). Certaines épices, surtout quand elles sont conservées dans une boite en aluminium. Les fruits secs et les oléagineux apportent en moyenne 4,1 mg d’aluminium/kg. Les algues peuvent capturer facilement l’aluminium selon leur origine. · Les crustacés et les mollusques (en moyenne 17,1 mg/kg). · Les laits maternisés. Selon 60 millions de consommateurs, un nourrisson de six mois consommant 4 biberons de 210 ml/jour ingère en moyenne 897 μg d’aluminium par semaine. Dans un avis publié en 2008, l’EFSA indiquait que l’exposition d’un nourrisson de 3 mois à l’aluminium était de 0,6 mg/kg pc/semaine quand il était nourri avec les préparations à base de lait, de 0,75 mg avec celles à base de soja et de moins de 0,07 mg en cas d’allaitement. |
| Quels sont les additifs alimentaires à éviter ? | E173, E520 à 523, E541, E554 à E556, E59, E1452 |
| Que penser de l’eau du robinet ? | Des sels d’aluminium sont utilisés pour traiter l’eau du robinet contre les agents infectieux, améliorer sa couleur et sa turbidité. Toutefois, la présence de silice dans certaines eaux permet d’en limiter les conséquences. Selon l’ANSES, l’eau de robinet contribue à hauteur de moins de 1% de la contamination moyenne en aluminium de la population. Vérifier la teneur en aluminium de l’eau de la commune. |
| Que penser des emballages et ustensiles de cuisson ? | · Tous les aliments cuits dans le papier d’aluminium (notamment en présence d’acides, comme par exemple lors de cuisson en papillote avec du vin blanc ou du citron) ou dans des récipients en aluminium, surtout pendant de longues durées, lorsque les aliments sont acides (tomates, rhubarbe, abricots, etc. ou en présence importante de sel. · Les aliments conservés dans des ustensiles contenant de l’aluminium, des canettes, des capsules de café à percolation, des saladiers en aluminium ou encore les boites Tetrapak®. · Les poêles, casseroles et ustensiles en téflon en contiennent de fortes quantités et peuvent facilement migrer dès lors que la pellicule de protection est rompue par une rayure. Certaines restaurations collectives n’hésitent pas à utiliser de vieilles poêles usagées. Même si leur contrôle est quasi-impossible, c’est toujours bon de le savoir…· Transférer les aliments dans des contenants en verre (y compris pour les cuissons, surtout concernant les aliments acides ou cuits dans un milieu acide comme vinaigre, citron, vin blanc, etc.). |
| Quels sont les médicaments riches en aluminium ? | · Les médicaments antiacides et l’aspirine tamponnée : se référer à votre médecin pour limiter leur usage dans la mesure du possible. Renforcer les mesures hygiéno-diététiques, voire l’usage du bicarbonate de soude. · Certains produits de chimiothérapie. |
| Et les cosmétiques ? | · L’utilisation de sels d’aluminium dans les déodorants anti-transpirants peut être à l’origine d’une application cutanée jusqu’à 2g d’aluminium par jour et d’une persistance pendant 24h. La pierre d’alun est à utiliser avec modération. · Crèmes solaires : jusqu’à 5g par jour d’aluminium peuvent être appliqués sur la peau. · Rouges à lèvres sous forme colloïdale · Certains dentifrices · Plus de 25 composés à base d’aluminium sont présents dans les produits cosmétiques : se référer à la base européenne CosIng. La réglementation n’a pas pris de position claire, considérant que les études actuelles ne sont pas suffisantes. Pour autant, dès 2011, l’ANSM (anciennement Afssaps) recommandait de ne pas utiliser de cosmétiques contenant de l’aluminium sur des peaux abimées et de manière générale de diminuer la teneur dans les produits commercialisés à 0,6% du maximum (certains produits contenaient jusqu’à 20% de sels d’aluminium). |
| Quels sont les risques d’inhalation ? | Selon les zones géographiques, le niveau d’exposition peut s’avérer très variable. Considéré comme sain jusqu’à environ 1,4 μg par jour, sa concentration dans l’air peut atteindre jusqu’à 1,4 mg dans certaines régions industrialisées (soit 1000 fois plus) ou selon le type d’activité. La fumée de cigarette (mais aussi de cannabis, voire la cocaïne et l’héroïne) sont des sources complémentaires, au même titre que les résidus de déodorants anti-transpirants. |
| Comment limiter les effets de l’aluminium ? | · Limiter votre exposition dans la mesure du possible grâce aux conseils ci-dessus. · Éviter toutes les sources mentionnant des sels d’aluminium solubles : chlorure, nitrate, lactate ou sulfate d’aluminium. · Consommer une eau riche silice au quotidien : Rozanna, Chateldon, Volvic, Badoit, Vichy Célestins. · Il existe des méthodes de chélation chimique (par le DMPS ou DMSA), actuellement sous contrôle médical en France et interdites dans la plupart des situations (voir les méthodes naturelles dans l’encadré). · En cas d’accumulation d’aluminium ou de pathologie associée à cette dernière : l’acétyl-L-carnitine est reconnue pour optimiser la production énergétique par les mitochondries et la neuro-protection. Son usage en supplémentation a été largement étudié et validé, notamment en cas de maladie d’Alzheimer ou de neuropathies, dans le cadre d’apports entre 1,5 et 3 g/jour en 2 à 3 prises, idéalement en dehors des repas. · Le Fer peut réduire l’assimilation de l’aluminium par compétition mais les quantités apportées par l’alimentation sont trop faibles pour avoir un effet spécifique. A l’inverse, une supplémentation en calcium ou en vitamine D favoriserait l’assimilation de l’aluminium, de même qu’une alimentation riche en acides organiques (citrates, malates, etc.) chez la souris. |
Si vous souhaitez découvrir le sujet plus en détails, c’est par ici.
Quelles sont les sources de contamination en aluminium ?
Cosmétiques et aluminium
A travers cet article, l’objectif n’est pas de développer tous les facteurs de contamination mais de se concentrer sur les sources alimentaires. Toutefois, il est difficile de ne pas citer les risques liés à l’usage des cosmétiques et des produits d’hygiène (crèmes, shampoings, etc.)4. A titre d’exemple, l’utilisation de sels d’aluminium dans les déodorants anti-transpirants peut être à l’origine d’une application cutanée jusqu’à 2g d’aluminium par jour et d’une persistance pendant 24h5,6. La pierre d’alun contient, elle aussi, de l’aluminium. Ce dernier est toutefois présent sous forme de gibbiste (hydroxyde d’aluminium), qui serait stable et peu soluble, donc peu absorbé par l’épiderme, à l’inverse de l’aluminium présent sous forme de chlorhydrate d’aluminium (à repérer sur les étiquettes !). Les données disponibles sont malheureusement rares et non unanimes. Quant aux crèmes solaires, ce sont jusqu’à 5g par jour d’aluminium qui peuvent être appliqués sur la peau7. La liste pourrait être encore bien longue : dans les rouges à lèvres sous forme colloïdale ou encore dans le dentifrice sous forme de minéraux insolubles8. Plus de 25 composés à base d’aluminium sont présents dans les produits cosmétiques selon la base européenne CosIng9.
Inhalation de l’aluminium
Un des principaux risques de l’aluminium est son inhalation. Il peut en effet être retenu par la langue et la muqueuse du tractus respiratoire. Selon les zones géographiques, le niveau d’exposition peut s’avérer très variable. Considéré comme sain jusqu’à environ 1,4 μg par jour, sa concentration dans l’air peut atteindre jusqu’à 1,4 mg dans certaines régions industrialisées (soit 1000 fois plus) ou selon le type d’activité10. La fumée de cigarette, mais aussi de cannabis, voire la cocaïne et l’héroïne sont des sources complémentaires d’inhalation11, au même titre que les résidus de déodorants anti-transpirants.
Médicaments et aluminium
L’usage de médicaments est un autre facteur de contamination12,13. On peut ainsi citer en premier lieu les antiacides (jusqu’à 7200 mg/j), mais aussi l’aspirine(1000mg/j)64 ou certaines produits de chimiothérapie. Une autre source, désormais bien connue, est la vaccination. Je développerai ce point ultérieurement. Les prothèses et les amalgames dentaires sont également concernés16,17.
Que devient l’aluminium une fois dans l’organisme ?
De manière générale, toutes les surfaces externes de l’organisme (peau, nez, langue, tractus digestif) contribuent à la pénétration d’aluminium dans l’organisme18.
Concernant la contamination par voie cutanée, la réglementation n’a pas pris de position claire, considérant que les études actuelles ne sont pas suffisantes. Pour autant, dès 2011, l’ANSM (anciennement Afssaps) recommandait de ne pas utiliser de cosmétiques contenant de l’aluminium sur des peaux abimées et de manière générale de diminuer la teneur dans les produits commercialisés à 0,6% du maximum (certains produits contenaient jusqu’à 20% de sels d’aluminium)19.
Lorsque l’aluminium pénètre la cavité nasale, notamment par les résidus volatiles issus des déodorants, il se retrouve en contact avec la muqueuse. Il peut alors potentiellement être solubilisé via le mucus et se retrouver dans la circulation générale14,20. Le nerf olfactif représente également une porte d’entrée potentielle de l’aluminium vers le cerveau21. La langue est une autre voie de contamination, notamment en présence de la salive pouvant faciliter la solubilisation de l’aluminium et sa pénétration via la muqueuse22. L’intestin représente quant à lui une large zone d’exposition pouvant faciliter la pénétration de l’aluminium du fait des variations de pH des différentes zones du système digestif, même si une grande partie est éliminée par les selles23. Selon l’EFSA, l’absorption par voie orale serait de 0,1% du niveau d’exposition.
Une fois dans le sang, l’aluminium est essentiellement transporté via une protéine, la transferrine pour 90%24, notamment en fonction de la présence de certaines molécules considérées comme des ligands, dont le citrate ou le phosphate pour 10%. Toute la question est alors de connaitre le niveau de pénétration de l’aluminium dans les tissus25. Étonnamment, il existe peu de publications sur le sujet26. Les deux tissus susceptibles de contenir le plus d’aluminium seraient la langue et les os (environ 6 μg par gramme), puis le foie, les reins et le cerveau (1 μg par gramme)27. Les mécanismes d’accumulation selon les tissus sont peu connus et non homogènes. La distribution de l’aluminium peut être variable d’un organe à un autre, mais il est désormais établi qu’il est présent… partout28.
Source : Christopher Exley.
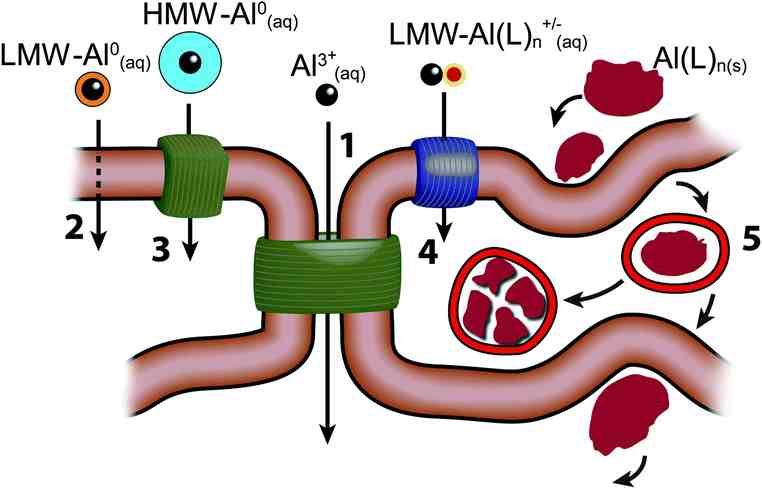
L’aluminium peut être présent sous différentes formes : libre (Al3+(aq)), de nanoparticulaires (Al(L)n(s)), de complexes solubles de faible poids moléculaire neutres (LMW-Al0(aq)), chargés (LMW-Al(L)n+/−(aq)) ou de haut poids moléculaire (HMW-Al0(aq)). Il existe par ailleurs 5 voies de pénétration dans l’organisme : paracellulaire (1), transcellulaire (2), via des transports actifs (3), des canaux (4) ou par endocytose (5).
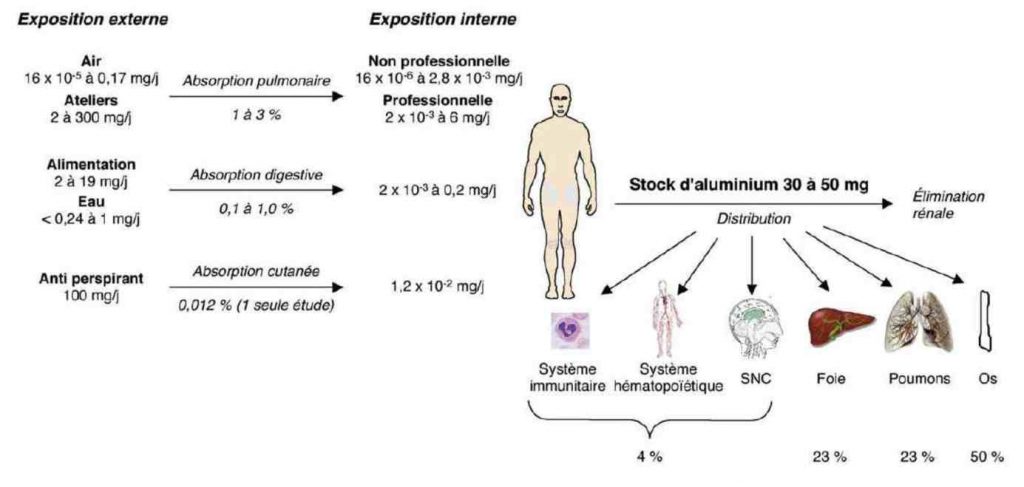
Absorption quotidienne et distribution de l’Al dans l’organisme humain d’après le conseil supérieur de la santé belge64
L’aluminium est-il éliminé ?
Oui, fort heureusement. Il est éliminé essentiellement via les selles (entre 90 et 99%) lorsque la contamination a lieu via l’alimentation. Sa pénétration dans l’organisme serait infime au regard du niveau d’exposition, entre 0,01 et 1%28,29. Il est alors excrété par les reins grâce aux urines à hauteur de 10 et 100 μg/jour30 en moyenne et, dans une moindre mesure, par la transpiration, les cheveux ou encore le sébum. Pour autant, et c’est le cœur du sujet, cette élimination ne semble pas totale. On ne dispose d’ailleurs pas de biomarqueurs suffisamment précis pour la déterminer, d’autant qu’il n’existe pas de normes de concentration dans les tissus. Un des moyens d’évaluation est donc de mesurer le niveau d’excrétion dans les urines.
Une expérience intéressante a été menée par le spécialiste de l’aluminium, Pr Exley31. Elle a consisté à analyser la présence d’aluminium dans les urines pendant 5 jours consécutifs. Les participants ont ensuite bu 1,5 litres d’une eau minérale riche en silice (>17 mg/L) pendant les 5 jours suivants et les urines ont été mesurées à nouveau. Pourquoi une eau riche en silice ? Car celle-ci possède la capacité de chélater l’aluminium, à savoir de le séquestrer32–35. Elle est d’ailleurs omniprésente dans la croute terrestre (la nature est bien faite). Ainsi, si le niveau d’excrétion urinaire d’aluminium augmente pendant la période au cours de laquelle les participants boivent l’eau riche en silice, alors que les conditions de vie sont identiques, cela signifie qu’ils ont accumulé ce métal dans leur organisme et que la silice est efficace pour faciliter son élimination, au moins partiellement. Par ailleurs, si la quantité d’aluminium diminue au cours du temps, par exemple au bout d’un an après avoir bu chaque jour de cette eau, il est probable que la silice contribue à réduire la charge aluminique de l’organisme au cours du temps, sans pour autant identifier les tissus concernés.
Boire une eau riche en silice est donc un excellent moyen, pour ne pas dire le seul, de chélater l’aluminium ingéré3.
Quels sont les effets suspectés de l’accumulation d’aluminium sur la santé ?
En moyenne, l’aluminium est présent dans l’organisme à hauteur de 30 à 50mg, dont 1% dans le cerveau38. La toxicité la plus reconnue est le risque d’encéphalopathie39 en cas de dialyse réalisée chez des personnes souffrant d’insuffisance rénale, parfois constatée en cas de concentration élevée en aluminium dans l’eau de ville ou lors de défaillance du système de traitement de l’eau de dialyse. A cette complication neurologique peuvent être associées d’autres conséquences, dont une atteinte osseuse et une anémie40. En effet, un dépôt excessif d’aluminium peut conduire au syndrome dit AIBD (aluminium-induced bone disease) à l’origine d’ostéomalacie.
L’aluminium à l’état libre est, comme de nombreux métaux, extrêmement réactif. Il représente donc un initiateur de stress oxydatif majeur, en tant que AlO2˙2+ 41. Il favorise ainsi l’amplification et la pérennisation de l’inflammation dans de nombreuses pathologies comme la sclérose en plaques42–44, la maladie de Cröhn45,46, l’asthme47, l’autisme48, le défaut de fertilité49, l’épilepsie50 ou encore la myofasciite à macrophages (voir encadré). Je vous livre ici une petite anecdote qui peut apparaitre totalement empirique car sans lien de causalité prouvée. Je me rendais hier pour réaliser un tournage sur ce sujet de l’aluminium et de la santé auprès de France 2. Dans le train, je rencontre le président d’un collectif d’éleveurs engagés pour une meilleure nutrition de leurs animaux et des hommes, que je connais bien. Je lui raconte la raison de ma venue, il me répond aussitôt : « Nous avons systématiquement constaté moins de production de lait et surtout une baisse de fertilité de nos vaches quand elles restaient sur les sols les plus riches en aluminium. Je l’ai constaté en mesurant le taux de contamination ». Après recherche, j’ai pu comprendre l’origine de son expérience : lorsque les sols sont acides (pH<4,5-5,0), les plantes augmentent leur concentration en aluminium51.
L’aluminium est dit « exocytotoxique ». En d’autres termes, il s’agit d’un composé hautement toxique pour les cellules. Il favorise notamment l’accumulation de calcium au niveau intracellulaire52. Sa toxicité pour le cerveau est aujourd’hui bien établie53, elle augmente d’ailleurs avec l’âge54. Il peut perturber plus de 200 réactions biologiques, expliquant ainsi son incrimination dans la maladie de Parkinson55, d’Alzheimer29,42,53,56–58 ou de manière générale dans les neuro-inflammations42,59. In vitro, il va même jusqu’à favoriser la formation de plaques β-amyloïdes60. Les neurones produisant la dopamine sont par ailleurs particulièrement sensibles aux effets d’une accumulation de fer et d’aluminium. Un excès favorise l’altération de production de dopamine et plus globalement des catécholamines (adrénaline, noradrénaline, etc.)61. Une méta-analyse conduite par l’équipe du Pr Wang a étudié 8 études épidémiologiques, regroupant 10 567 patients, pour déterminer l’existence ou non d’un lien entre la présence d’aluminium et les risques d’apparition de la maladie d’Alzheimer. Les patients souffrant de cette maladie ont bien été fortement exposés à l’aluminium entre l’âge de 8 et 48 ans62. Une autre étude met en évidence un lien entre le niveau d’exposition à l’aluminium via les eaux (>100 mg par litre)) et le risque de développer la maladie63. La toxicité neurologique semblerait significative à partir de 30 mg/kg pc/j en sachant qu’il existe de très grandes variabilités individuelles64 .
Puissant immunostimulant, l’aluminium est utilisé dans la grande majorité des vaccins pour potentialiser les effets des antigènes inoculés. On le qualifie alors d’adjuvant du latin adjuvāns, qui aide. Or, à ce jour, il existe peu de données permettant d’en expliquer le mécanisme18 et par voie de conséquence ses effets toxiques potentiels 18,65. Son action s’expliquerait par un mécanisme de « piège » envers l’élément pathogène. Lors d’une infection (ou de sa simulation par un vaccin), certaines cellules immunitaires (les neutrophiles) sont mobilisées sur le lieu d’infection pour lyser les agents pathogènes, dont les adjuvants à bas de sels d’aluminium. Lorsque les neutrophiles meurent, ils libèrent leur ADN qui va créer une forme de complexe avec le sel d’aluminium. S’en suit alors toute la cascade immunitaire (intervention des cellules dendritiques puis des lymphocytes T formant les cellules mémoires en mesure de réagir beaucoup plus fortement et plus rapidement lors de futures infections). Par rapport à un vaccin sans adjuvant aluminique, le temps de contact entre les cellules présentatrices d’antigènes et les lymphocytes T est deux fois plus rapide en présence d’aluminium66. En clair, l’aluminium peut être considéré comme une forme de catalyseur de l’action des cellules immunitaires, d’où l’intérêt des laboratoires pharmaceutiques envers ce dernier afin d’optimiser les couts de fabrication. Il semble surtout exister une forte prédisposition individuelle67–69. La position du Haut Comité de Santé Publique ne semble toutefois pas l’entendre de cette oreille70, l’ANSM non plus bien qu’elle accorde le fait qu’une prédisposition puisse être à l’origine de lésions locales à la suite d’une injection70.
L’aluminium est reconnu comme un mutagène depuis des années70, en particulier dans le cadre du cancer du sein71.En 1987, le Centre International de Recherche contre le Cancer (CIRC) a classé l’aluminium comme cancérigène certain (groupe 1) vis-à-vis des risques de cancer du poumon et de la vessie chez les travailleurs de l’aluminium. Il est également fortement incriminé pour ses risques tératogènes (de fausse couche) et ses effets sur le développement du fœtus, fortement exposé pendant la grossesse.
La myofasciite à macrophages ? (MFM) est une maladie inflammatoire neurologique causée par la présence d’aluminium dans l’organisme. Bien qu’encore fortement contestée par une grande partie du corps scientifique conventionnel, la MFM a été particulièrement étudiée par l’équipe de recherche du CHU de Créteil sous la direction du Pr Gherardi. Elle a mis en évidence la présence anormale d’aluminium au niveau des deltoïdes (les muscles ayant subi l’injection de vaccin), mais aussi la migration de ce métal sous forme de nanoparticules dans le cerveau. L’équipe de recherche justifie ses résultats par un mécanisme qu’il qualifie de « cheval de Troie ». La présence de cet aluminium en quantité importante pourrait en effet activer, chez des personnes prédisposées au niveau génétique (induisant notamment le maintien du granulome post-vaccinal), certaines cellules immunitaires et initier une réponse inflammatoire. Il a été mis en évidence une surexpression de CCL2/MCP-1, une cytokine impliquée dans la migration des nanoparticules dans le cerveau72,73. Les monocytes pourraient par ailleurs transporter l’aluminium et passer la barrière hémato-encéphalique, causant ainsi une neuro-inflammation (au même titre que la sclérose en plaques chez d’autres personnes présentant une prédisposition différente).
La MFM peut se manifester par de nombreux signes non spécifiques, tels que des douleurs musculaires chroniques (myalgies), une fatigue intense (asthénie), une atteinte de la mémoire visuelle et de travail (troubles neuro-cognitifs), au point que 80% des patients atteints doivent renoncer à leur activité professionnelle ou à leur vie sociale. Selon le Pr Gherardi, une grande partie des personnes souffrant du syndrome de fatigue chronique pourrait être concernée par la MFM. Le diagnostic est actuellement réalisé à la suite d’une biopsie musculaire au niveau des deltoïdes et par imagerie médicale (couplage d’IRM et de PETSCAN). Seuls deux appareils sont disponibles en France, l’un au CHU de Créteil, l’autre est dédié à la recherche. Ces résultats sont toutefois remis en question par de nombreux scientifiques, à commencer par l’agence du médicament (ANSM) dans son rapport de juin 201774, bien que certaines études confirment les travaux du Pr Gherardi publiés dès 1992 dans la revue The Lancet 72,75–78 . Toujours selon le Pr Gherardi, une des complémentarités entre la maladie de Lyme et la MFM serait une initiation d’inflammation par la borrelia dans le premier cas et par l’aluminium dans le second. Nous ne sommes certainement qu’au début d’une longue investigation scientifique et de polémiques entre experts. Si vous vous sentez concerné(e), je vous conseille de vous rapprocher de l’association E3M et son président Didier Lambert.
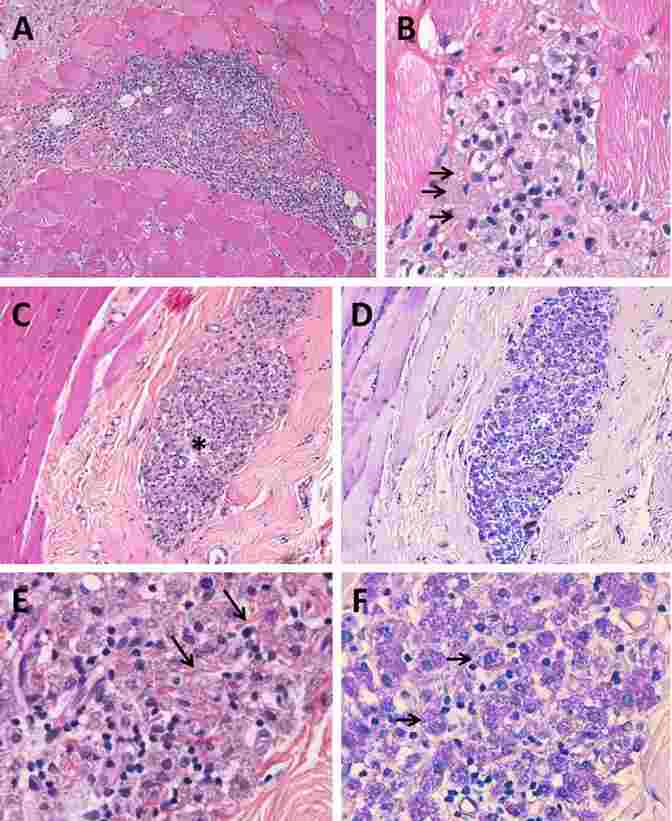 Lésions histologiques de myofasciite macrophagique (MFM).
Lésions histologiques de myofasciite macrophagique (MFM).
A et B. Infiltrat inflammatoire focal formé de grands macrophages mononucléés cohésifs, avec présence de lymphocytes ; les macrophages présentent des inclusions intracellulaires granuleuses (B : flèches).
C et D. Lésion de MFM périmysiale (étoile) : macrophages fortement positifs avec la technique du PAS (D).
E et F. Fort grossissement montrant des fibres de collagène interposées entre les macrophages (E : flèches) et des macrophages avec des inclusions granuleuses PAS-positives (F : flèches). Biopsie de muscle deltoïde.
D’après Gherardi et al. 2016 81
Quels sont les doses maximales tolérées en aluminium ?
Selon l’EFSA, la dose hebdomadaire tolérable provisoire (DHTP) est fixée à 1 mg/kg pc/semaine, ce qui représente environ 8,5 mg/jour pour un adulte79,80. Elle a été revue à la baisse depuis 2008, les recommandations initiales en 1989 étant de 7 mg/kg pc/semaine. En 2011, l’OMS et la FAO ont défini un seuil de 2 mg/kg pc/semaine81.
Selon le rapport de l’ANSES, l’exposition moyenne de la population française à l’aluminium serait de 0,16 mg/kg pc/semaine. L’EFSA indique quant à elle une exposition moyenne des européens entre 02 et 1,5 mg/kg pc/ semaine, tout en affirmant que la limite de 1 mg serait franchie par une part significative de la population. Pour le chercheur de l’INSERM Pierre Desreumeaux, 10% de la population dépasserait les 10mg/kg pc/j.
L’étude française EAT2 révèle quant à elle des valeurs de 0,28 mg/kg pc/semaine chez les adultes et de 0,42 mg/kg pc/semaine chez les enfants (de 3 à 17 ans)82. Elle constitue d’ailleurs l’étude la plus représentative compte tenu du nombre d’aliments analysés, de la méthodologie utilisée (pratique de la préparation des repas au plus proche de la réalité) et du gain en sensibilité des méthodes analytiques utilisées.
Quels sont les aliments les plus contaminés en aluminium ?
C’est là que le bât blesse car la réponse est relativement simple : quasiment partout ! Y compris dans des aliments que nous ne suspecterions pas, à commencer par le thé85–87. L’institut allemand BFR88 a analysé 79 échantillons de thé non fermenté, notamment du thé matcha. Les résultats sont alors particulièrement marquants. Le niveau médian de contamination de l’ensemble des thés est de 521 mg/kg avec des valeurs maximales atteintes de 2 880 mg/kg. Le BFR précise que le thé noir n’est pas épargné avec des teneurs pouvant atteindre 1490 mg/kg. Lorsque le thé choisi fait partie des thés les plus contaminés, les 5% les plus grands consommateurs atteignent 291 % de la dose maximale tolérée. Les consommateurs moyens de thé (2 tasses/j) présentent un taux de 105% au-dessus de la dose maximale. Si l’on considère cette fois-ci le taux de contamination moyen du thé, les pourcentages sont alors respectivement de 66% (pour les plus gros buveurs) et de 24 % (pour les buveurs moyens). Selon l’EFSA, le thé noir contiendrait en moyenne 4,2 mg d’aluminium par litre. Il n’existe malheureusement aucune obligation pour le producteur ou l’industriel de mentionner le niveau d’aluminium, laissant ainsi la place à un choix hasardeux selon la nature du sol sur lequel est cultivé le thé.
Je vous entends d’ici me dire « OK, mais quid des capsules Nespresso ? ». Selon l’entreprise (j’ai eu l’occasion d’avoir un retour direct à la suite d’une publication d’un article pour Yuka), l’enquête de 60 millions de consommateurs89 représente leur référence car bien évidemment, rien n’est spécifié sur leur site internet. Il y est précisé que boire quatre dosettes correspond à ingurgiter 0,3% de la dose hebdomadaire maximale, soit 2,1% sur une semaine. Une telle affirmation n’est toutefois pas suffisante, la dose étant pour rappel déterminée en fonction du poids corporel de l’individu et donc soumise à de fortes variations. Pour autant, cet apport apparait minime au regard des seuils de tolérance si l’on occulte le principe cumulatif. Qu’en est-il des autres métaux lourds, des furanes et autres composés présents dans ces dosettes ? C’est un autre sujet qui mériterait d’être développé.
Certains additifs contiennent de l’aluminium. Il peut s’agit de colorants, d’antiagglomérants, de raffermissants, etc. :
- E173, utilisé pour l’enrobage des confiseries et pâtisseries industrielles.
- E520 à E523 appartenant à la famille des sulfates d’aluminium et particulièrement présents dans les fruits confits ou les produits à base de blanc d’œuf.
- E541 ou phosphate d’aluminium utilisé dans les pâtisseries.
- E554 et E555 sous forme de silicates d’aluminium ou dioxyde de silicium dans les gélules de compléments alimentaires ou de médicaments.
- E1452 ou octényl succinate d’amidon d’aluminium, plus communément appelé amidon modifié et utilisé dans les compléments alimentaires ou les produits céréaliers industrialisés (type pâtisseries et viennoiseries).
Exemples de teneur moyenne en aluminium de produits transformés
| Aliments | Teneur en aluminium (mg/kg) |
| Pâte à tartinée chocolatée | 116 |
| Mousse au chocolat | 29,3 |
| Crème caramel | 23 |
| Flan aux oeufs | 22 |
| Biscotte/Baguette | 10 |
| Céréales au chocolat/muesli/pétales de maïs | 9 |
| Riz | 8 |
| Pâtisseries industrielles/brioche | 7 |
| Lait demi-écrémé | 6 |
Source : Tableau de données régionales EAT284
Le chocolat peut contenir jusqu’à plus de 50 mg/kg, 3,7 mg/kg en moyenne. Si l’usage du papier d’aluminium n’arrange rien, la présence d’aluminium est avant tout liée au cacao lui-même.
Certains légumes tels que les champignons, les épinards, les radis, les bettes ou la laitue contiennent de 5 à 10 mg d’aluminium par kg d’aliments. Les cornichons sont également concernés du fait de la présence de sels d’aluminium dans les saumures. Certaines épices peuvent en contenir également, surtout quand elles sont conservées dans une boite en aluminium. Les fruits secs et les oléagineux apportent en moyenne 4,1 mg d’aluminium/kg. Les algues peuvent capturer facilement l’aluminium également90.
Autre source significative : les crustacés et les mollusques, en moyenne 17,1 mg/kg selon l’ANSES.
Une des raisons principales de la contamination alimentaire est l’usage d’ustensiles ou d’emballages à base d’aluminium :
- Tous les aliments cuits dans le papier d’aluminium (notamment en présence d’acides, comme par exemple lors de cuisson en papillote avec du vin blanc ou du citron) ou dans des récipients en aluminium92. A titre d’exemple, 100 g de tomates peuvent renfermer 6,5 mg d’aluminium après avoir été cuits et conservés dans un récipient en aluminium toute une nuit. 100 g de rhubarbe et d’abricots cuits peuvent en contenir respectivement 4 mg et 7 mg. De manière générale, les taux peuvent attendre jusqu’à 7 mg pour 100 g d’aliments acides ou cuits dans un environnement acide90,93. A titre d’exemple, une eau du robinet portée à ébullition dans une casserole en aluminium pendant 10 à 15 min peut engendrer une libération d’aluminium entre 1,5 et 5 mg/L selon l’ustensile et l’acidité.
- De fortes quantités de sel augmentent la contamination des aliments en aluminium à partir des ustensiles.
- Les aliments conservés dans des ustensiles contenant de l’aluminium, des canettes, des saladiers en aluminium ou encore les boites Tetrapak®94.
- Les poêles, casseroles et ustensiles en téflon en contiennent de fortes quantités et peuvent facilement migrer dès lors que la pellicule de protection est rompue par une rayure. Certaines restaurations collectives n’hésitent pas à utiliser de vieilles poêles usagées. Même si leur contrôle est quasi-impossible, c’est toujours bon de le savoir.
Plus inquiétant : les laits maternisés. Selon 60 millions de consommateurs95, un nourrisson de six mois consommant 4 biberons de 210 ml/jour ingère en moyenne 897 μg d’aluminium par semaine. Dans un avis publié en 2008, l’EFSA indiquait que l’exposition d’un nourrisson de 3 mois à l’aluminium était de 0,6 mg/kg pc/semaine quand il était nourri avec les préparations à base de lait, de 0,75 mg avec celles à base de soja et de moins de 0,07 mg en cas d’allaitement.
L’eau du robinet est régulièrement incriminée. En effet, des sels d’aluminium sont utilisés pour traiter l’eau du robinet contre les agents infectieux (virus, bactéries, parasites), améliorer sa couleur et sa turbidité. Toutefois, la présence de silice dans certaines eaux permet d’en limiter les conséquences. Selon l’ANSES, l’eau de robinet contribue à hauteur de moins de 1% de la contamination moyenne en aluminium de la population. La concentration maximale autorisée par la DCE (Directive Cadre Eau) et l’OMS est de 0,2mg/litre. Pour autant, en 2000, la cohorte PAQUID avait mis en évidence une augmentation par 2,3 des risques de survenue de maladie d’Alzheimer pour les personnes résidant dans des régions où la concentration en aluminium est supérieure à 0,1 mg/L96.
Selon l’ANSES97, la répartition des principales origines alimentaires de contamination en aluminium est la suivante (hors ustensiles) :
- Adultes : produits céréaliers (20%), légumes (14%) et thé (11%).
- Enfants : produits céréaliers (27%), les légumes (12%), produits laitiers (9%) et chocolat (5%).
Comment limiter votre contamination à l’aluminium ?
La principale précaution est, en toute logique, de limiter son exposition dans la mesure du possible et au regard de son omniprésence dans l’alimentation et les produits cosmétiques. Éviter toutes les sources mentionnant des sels d’aluminium solubles : chlorure, nitrate, lactate ou sulfate d’aluminium.
Nous avons évoqué l’intérêt de consommer une eau riche silice au quotidien, d’une part pour limiter son assimilation quotidienne et d’autre part aider l’organisme à éliminer progressivement les résidus d’aluminium accumulés. Toutefois, l’efficacité de la silice vis-à-vis du dernier point n’a pas été prouvée à ce jour. Je vous conseille donc de considérer ce geste comme une démarche quotidienne préventive plus que curative. Raison pour laquelle le recours à des compléments alimentaires riches en silice n’est pas une priorité à mon sens, si ce n’est sous forme de silice colloïdale (le fameux produit G5, connu des plus férus de micronutrition d’entre vous, n’a absolument pas prouvé de supériorité de biodisponibilité au niveau scientifique).
Il existe par ailleurs des méthodes de chélation chimique par le DMPS ou DMSA, actuellement sous contrôle médical en France et interdite dans la plupart des situations (voir encadré).
| Eau | Silicium (mg/l) |
| Rozana | 95 |
| Chateldon | 90 |
| Fiji water | 45 |
| Volvic | 31 |
| Badoit | 30 |
| Vichy Célestins | 30 |
Si vous souhaitez avoir recours à une chélation chimique, je vous conseille avant tout de vous rapprocher d’un médecin et de réaliser un dosage de votre niveau de contamination dans les différents métaux lourds, soit dans les urines via une première chélation chimique (par DMPS en intraveineuse, sur conseil médical) ou par voie orale par la prise de DMSA. Attention toutefois, ce dernier est interdit à la vente libre en France compte tenu de son statut de médicament. Je vous conseille donc, quelle que soit la méthode envisagée, de suivre les conseils d’un médecin spécialiste du sujet. Une fois cet état des lieux réalisé, comment faire ? L’objectif est de réaliser une chélation de ces métaux lourds, à savoir une capture par des molécules chimiques soit par intraveineuse (via du DMPS, EDTA ou BAL), soit par voie orale via le DMSA. Plusieurs précautions très importantes s’imposent :
- Avant d’entamer un protocole de chélation par voie chimique, vérifier que vous avez supprimé tout amalgame dentaire de votre bouche. Cette dépose d’amalgame est un sujet particulièrement délicat dans la mesure où elle doit être réalisée par des dentistes particulièrement experts et équipés pour se faire (salle avec aspiration d’air, masque au charbon actif, utilisation d’une fraise spécifique à usage unique, inhalation d’oxygène, utilisation de charbon actif avant et après la dépose associée à du sélénium, du zinc et des antioxydants 24h avant et 48 après, etc.). Par ailleurs, si vous portez plusieurs amalgames en bouche, il est impératif d’espacer leur dépose (maximum 1 fois par mois en cas de forme optimale). Tout ceci ne se réalise donc pas « à la va vite », n’importe où et avec n’importe qui. Je vous conseille donc d’en discuter avant tout avec votre thérapeute pour qu’il vous oriente vers un dentiste compétent, y compris en Allemagne ou en Belgique.
- La chélation chimique doit elle aussi être réalisée par des médecins-experts. Fortement sujet à polémique car soupçonnée de créer un mouvement des métaux lourds dans l’organisme qui pourraient alors se déposer dans de nouveaux tissus, la chélation chimique est très peu pratiquée en France sauf en cas d’intoxication massive, mais il existe des structures spécialisées en Suisse. La chélation est par ailleurs sujette à un certain nombre de contre-indications (fatigue importante, insuffisance rénale ou hépatique, grossesse, anémie, hypertension artérielle, etc.). Dans tous les cas, une chélation nécessite une supplémentation importante en minéraux (à stopper 48h avant la chélation) car ils sont eux-mêmes soumis au principe de chélation. Certains cas de décès par carence en magnésium ont par exemple été identifiés.
- La chélation naturelle n’a malheureusement pas démontré d’effets suffisamment importants pour l’envisager comme une méthode unique en cas d’intoxication importante98 :
- La chlorella présente une activité chélatrice essentiellement liée à la chlorophylle, donc moins significative une fois dans le sang. Compte tenu de son avidité importante pour les métaux lourds, éviter les produits issus de cultures aériennes en Asie, au profit de celles réalisées par des tuyaux de verre (aucun contact avec l’air libre).
- L’ail des ours contient des composés soufrés (desulfhydryle) pouvant oxyder le mercure, le cadmium et le plomb au niveau extracellulaire, pour les rendre ainsi plus solubles dans les liquides interstitiels et lymphatiques.
- L’acide alpha-lipoïque a démontré un effet chélateur limité et majoritairement sur le fer.
- Le basilic sacré interviendrait lui davantage dans la chélation du cadmium99.
- Le glutathion demeure le composé le plus intéressant (donc la N-acetyl-cystéine également en tant que substrat du glutathion), notamment contre le plomb (2 x 300 mg par jour)100.
- Les minéraux comme le zinc, le sélénium sont intéressants mais de manière indirecte. La zéolithe est également parfois utilisée, de même que l’acide ellagique101.
L’acétyl-L-carnitine (ALC), le sauveur ?
L’acétyl-L-carnitine est un dérivé acétylé d’un acide aminé, la L-carnitine, reconnu pour optimiser la production énergétique par les mitochondries (pour rappel, il s’agit de nos centrales énergétiques). L’ALC possède par ailleurs d’autres propriétés, notamment de neuro-protection. Elle contribue en effet à nettoyer les mitochondries de composés intermédiaires potentiellement toxiques. L’ALC facilite également la production d’acétylcholine, un neuromédiateur impliqué dans la mémoire et l’apprentissage. Son usage en supplémentation a été largement étudié et validé, notamment en cas de maladie d’Alzheimer ou de neuropathies, dans le cadre d’apports entre 1,5 et 3 g/jour en 2 à 3 prises, idéalement en dehors des repas102–104.
Le Fer est un minéral pouvant réduire l’assimilation de l’aluminium par compétition, mais les quantités apportées par l’alimentation sont trop faibles pour avoir un effet spécifique. A l’inverse, une supplémentation en calcium105 ou en vitamine D106 favoriserait l’assimilation de l’aluminium, de même qu’une alimentation riche en acides organiques (citrates, malates, etc.) chez la souris107.
En conclusion, je vais vous livrer une confidence : je me sens particulièrement concerné par ce sujet. En effet, avant que la maladie de Lyme me soit diagnostiquée, j’ai comme de trop nombreux patients, réalisé un grand nombre d’explorations. J’ai eu la chance d’avoir accès à la mesure couplée de l’IRM et du PETSCAN au sein du CHU de Créteil. Il s’est avéré que je présente tous les signes d’une myofasciite à macrophages. Mes dosages urinaires et sanguins ont par la suite confirmé l’existence de concentrations en aluminium largement supérieures à la norme. En écrivant ces quelques lignes, je sais désormais que je vais être davantage vigilant à ma consommation de thé en complément de la consommation d’eau riche en silice. En effet, mon attrait naturel pour ce breuvage m’a fait minimiser ce point, mais la lecture des études s’y référant est un très bon rappel à l’ordre !
Anthony Berthou
Sources:
- Exley, C. Human Exposure to Aluminium. Environ. Sci.: Processes Impacts 2013, 15 (10), 1807–1816. https://doi.org/10.1039/C3EM00374D.
- Lakshman, S.; Mills, R.; Patterson, H.; Cronan, C. Apparent Differences in Binding Site Distributions and Aluminum(III) Complexation for Three Molecular Weight Fractions of a Coniferous Soil Fulvic Acid. Analytica Chimica Acta 1993, 282 (1), 101–108. https://doi.org/10.1016/0003-2670(93)80357-Q.
- Exley, C.; Chappell, J. S.; Birchall, J. D. A Mechanism for Acute Aluminium Toxicity in Fish. J. Theor. Biol. 1991, 151 (3), 417–428. https://doi.org/10.1016/s0022-5193(05)80389-3.
- CAS Reference Linking Service https://chemport.cas.org/cgi-bin/sdcgi?APP=ftslink&action=reflink&origin=rsc&version=1.0&coi=1%3ACAS%3A528%3ADC%252BC3MXps12kt7Y%253D&md5=ce6dc8acb4c15ae0f96529a7987d88fd (accessed Sep 25, 2019).
- Exley, C. Does Antiperspirant Use Increase the Risk of Aluminium-Related Disease, Including Alzheimer’s Disease? Mol Med Today 1998, 4 (3), 107–109.
- Pineau, A.; Guillard, O.; Favreau, F.; Marty, M.-H.; Gaudin, A.; Vincent, C. M.; Marrauld, A.; Fauconneau, B.; Marty, J.-P. In Vitro Study of Percutaneous Absorption of Aluminum from Antiperspirants through Human Skin in the FranzTM Diffusion Cell. J. Inorg. Biochem. 2012, 110, 21–26. https://doi.org/10.1016/j.jinorgbio.2012.02.013.
- Nicholson, S.; Exley, C. Aluminum: A Potential pro-Oxidant in Sunscreens/Sunblocks? Free Radic. Biol. Med. 2007, 43 (8), 1216–1217. https://doi.org/10.1016/j.freeradbiomed.2007.07.010.
- Liu, S.; Hammond, S. K.; Rojas-Cheatham, A. Concentrations and Potential Health Risks of Metals in Lip Products. Environ. Health Perspect. 2013, 121 (6), 705–710. https://doi.org/10.1289/ehp.1205518.
- https://ec.europa.eu/growth/tools-databases/cosing/ . https://ec.europa.eu/growth/tools-databases/cosing/.
- Bondy, S. C. The Neurotoxicity of Environmental Aluminum Is Still an Issue. Neurotoxicology 2010, 31 (5), 575–581. https://doi.org/10.1016/j.neuro.2010.05.009.
- Exley, C.; Begum, A.; Woolley, M. P.; Bloor, R. N. Aluminum in Tobacco and Cannabis and Smoking-Related Disease. Am. J. Med. 2006, 119 (3), 276.e9-11. https://doi.org/10.1016/j.amjmed.2005.08.004.
- Bohrer, D.; Bertagnolli, D. C.; de Oliveira, S. M. R.; do Nascimento, P. C.; de Carvalho, L. M.; Pomblum, S. G. Drugs as a Hidden Source of Aluminium for Chronic Renal Patients. Nephrol. Dial. Transplant. 2007, 22 (2), 605–611. https://doi.org/10.1093/ndt/gfl569.
- Joachim, S. C.; Reinehr, S.; Kuehn, S.; Laspas, P.; Gramlich, O. W.; Kuehn, M.; Tischoff, I.; von Pein, H. D.; Dick, H. B.; Grus, F. H. Immune Response against Ocular Tissues after Immunization with Optic Nerve Antigens in a Model of Autoimmune Glaucoma. Mol. Vis. 2013, 19, 1804–1814.
- Zaffe, D.; Bertoldi, C.; Consolo, U. Accumulation of Aluminium in Lamellar Bone after Implantation of Titanium Plates, Ti-6Al-4V Screws, Hydroxyapatite Granules. Biomaterials 2004, 25 (17), 3837–3844. https://doi.org/10.1016/j.biomaterials.2003.10.020.
- Nicholson, J. W.; Czarnecka, B. Review Paper: Role of Aluminum in Glass-Ionomer Dental Cements and Its Biological Effects. J Biomater Appl 2009, 24 (4), 293–308. https://doi.org/10.1177/0885328209344441.
- CAS Reference Linking Service.
- https://ansm.sante.fr/var/ansm_site/storage/original/application/ad548a50ee74cc320c788ce8d11ba373.pdf https://ansm.sante.fr/var/ansm_site/storage/original/application/ad548a50ee74cc320c788ce8d11ba373.pdf.
- Exley, C.; Siesjö, P.; Eriksson, H. The Immunobiology of Aluminium Adjuvants: How Do They Really Work? Trends Immunol. 2010, 31 (3), 103–109. https://doi.org/10.1016/j.it.2009.12.009.
- Perl, D. P.; Good, P. F. Uptake of Aluminium into Central Nervous System along Nasal-Olfactory Pathways. Lancet 1987, 1 (8540), 1028. https://doi.org/10.1016/s0140-6736(87)92288-4.
- Divine, K. K.; Lewis, J. L.; Grant, P. G.; Bench, G. Quantitative Particle-Induced X-Ray Emission Imaging of Rat Olfactory Epithelium Applied to the Permeability of Rat Epithelium to Inhaled Aluminum. Chem. Res. Toxicol. 1999, 12 (7), 575–581. https://doi.org/10.1021/tx9900268.
- Riihimäki, V.; Aitio, A. Occupational Exposure to Aluminum and Its Biomonitoring in Perspective. Crit. Rev. Toxicol. 2012, 42 (10), 827–853. https://doi.org/10.3109/10408444.2012.725027.
- Powell, J. J.; Jugdaohsingh, R.; Thompson, R. P. The Regulation of Mineral Absorption in the Gastrointestinal Tract. Proc Nutr Soc 1999, 58 (1), 147–153. https://doi.org/10.1079/pns19990020.
- Fatemi, S. J.; Kadir, F. H.; Moore, G. R. Aluminium Transport in Blood Serum. Binding of Aluminium by Human Transferrin in the Presence of Human Albumin and Citrate. Biochem J 1991, 280 (Pt 2), 527–532.
- Beardmore, J.; Exley, C. Towards a Model of Non-Equilibrium Binding of Metal Ions in Biological Systems. J. Inorg. Biochem. 2009, 103 (2), 205–209. https://doi.org/10.1016/j.jinorgbio.2008.10.003.
- Sakajiri, T.; Yamamura, T.; Kikuchi, T.; Ichimura, K.; Sawada, T.; Yajima, H. Absence of Binding between the Human Transferrin Receptor and the Transferrin Complex of Biological Toxic Trace Element, Aluminum, Because of an Incomplete Open/Closed Form of the Complex. Biol Trace Elem Res 2010, 136 (3), 279–286. https://doi.org/10.1007/s12011-009-8547-y.
- Roider, G.; Drasch, G. Concentration of Aluminum in Human Tissues : Investigations on an Occupationally Non-Exposed Population in Southern Bavaria (Germany); 1999.
- C. Exley Molecular and Supramolecular Bioinorganic Chemistry: Applications in Medical Sciences , A. L. R. Merce, J. Felcman and M. A. L. Recio, Nova Sci. Pub. Inc., New York, USA, 2008, Pp. 45–68.
- Aluminium Toxicokinetics. – PubMed – NCBI.
- Moore, P. B.; Day, J. P.; Taylor, G. A.; Ferrier, I. N.; Fifield, L. K.; Edwardson, J. A. Absorption of Aluminium-26 in Alzheimer’s Disease, Measured Using Accelerator Mass Spectrometry. Dement Geriatr Cogn Disord 2000, 11 (2), 66–69. https://doi.org/10.1159/000017216.
- Iyengar, G. V. Reevaluation of the Trace Element Content in Reference Man. Radiation Physics and Chemistry 1998, 51 (4), 545–560. https://doi.org/10.1016/S0969-806X(97)00202-8.
- S.Davenward, Silicic Acid-Rich Mineral Water as a Non-Invasive Method of Reducing Aluminium Body Burden in Healthy Individuals, Alzheimer’s and Parkinson’s Disease, PhD Thesis, Keele University, 2013.
- Exley, C.; Korchazhkina, O.; Job, D.; Strekopytov, S.; Polwart, A.; Crome, P. Non-Invasive Therapy to Reduce the Body Burden of Aluminium in Alzheimer’s Disease. J. Alzheimers Dis. 2006, 10 (1), 17–24; discussion 29-31.
- Davenward, S.; Bentham, P.; Wright, J.; Crome, P.; Job, D.; Polwart, A.; Exley, C. Silicon-Rich Mineral Water as a Non-Invasive Test of the “aluminum Hypothesis” in Alzheimer’s Disease. J. Alzheimers Dis. 2013, 33 (2), 423–430. https://doi.org/10.3233/JAD-2012-121231.
- Combadière, C.; Raoul, W.; Guillonneau, X.; Sennlaub, F. Comment on “Ccl2, Cx3cr1 and Ccl2/Cx3cr1 Chemokine Deficiencies Are Not Sufficient to Cause Age-Related Retinal Degeneration” by Luhmann et al. (Exp. Eye Res. 2013; 107: 80.Doi: 10.1016). Exp. Eye Res. 2013, 111, 134–135. https://doi.org/10.1016/j.exer.2013.02.002.
- Dobrzyński, D.; Exley, C. KONTROLA ROZPUSZCZALNOŚCI I POTENCJAŁ TERAPEUTYCZNY KRZEMU W WODACH LECZNICZYCH SUDETÓW. 2010, 10.
- Bellia, J. P.; Birchall, J. D.; Roberts, N. B. The Role of Silicic Acid in the Renal Excretion of Aluminium. Ann. Clin. Lab. Sci. 1996, 26 (3), 227–233.
- Exley, C. Elucidating Aluminium’s Exposome https://www.ingentaconnect.com/content/ben/cic/2012/00000002/00000001/art00002 (accessed Sep 25, 2019).
- Priest, N. D. The Biological Behaviour and Bioavailability of Aluminium in Man, with Special Reference to Studies Employing Aluminium-26 as a Tracer: Review and Study Update. J Environ Monit 2004, 6 (5), 375–403. https://doi.org/10.1039/b314329p.
- Guo, C.-H.; Wang, C.-L. Plasma Aluminum Is a Risk Factor for Oxidative Stress and Inflammation Status in Hemodialysis Patients. Clin. Biochem. 2011, 44 (16), 1309–1314. https://doi.org/10.1016/j.clinbiochem.2011.08.1132.
- Seidowsky, A.; Dupuis, E.; Drueke, T.; Dard, S.; Massy, Z. A.; Canaud, B. Intoxication aluminique en hémodialyse chronique. Un diagnostic rarement évoqué de nos jours. Illustration par un cas clinique et revue de la littérature. /data/revues/17697255/unassign/S1769725517305539/ 2017.
- Mujika, J. I.; Ruipérez, F.; Infante, I.; Ugalde, J. M.; Exley, C.; Lopez, X. Pro-Oxidant Activity of Aluminum: Stabilization of the Aluminum Superoxide Radical Ion. J Phys Chem A 2011, 115 (24), 6717–6723. https://doi.org/10.1021/jp203290b.
- Exley, C.; Mold, M. J. Aluminium in Human Brain Tissue: How Much Is Too Much? J. Biol. Inorg. Chem. 2019. https://doi.org/10.1007/s00775-019-01710-0.
- Álvarez-Soria, M. J.; Hernández-González, A.; Carrasco-García de León, S.; del Real-Francia, M. Á.; Gallardo-Alcañiz, M. J.; López-Gómez, J. L. [Demyelinating disease and vaccination of the human papillomavirus]. Rev Neurol 2011, 52 (8), 472–476.
- Shoenfeld, Y.; Agmon-Levin, N. “ASIA” – Autoimmune/Inflammatory Syndrome Induced by Adjuvants. J. Autoimmun. 2011, 36 (1), 4–8. https://doi.org/10.1016/j.jaut.2010.07.003.
- Erratum for PMID 21180585. Therap Adv Gastroenterol 2012, 5 (5), 371. https://doi.org/10.1177/1756283X10363751.
- Perl, D. P.; Fogarty, U.; Harpaz, N.; Sachar, D. B. Bacterial-Metal Interactions: The Potential Role of Aluminum and Other Trace Elements in the Etiology of Crohn’s Disease. Inflamm. Bowel Dis. 2004, 10 (6), 881–883. https://doi.org/10.1097/00054725-200411000-00022.
- Guo, C.-H.; Chen, P.-C.; Hsia, S.; Hsu, G.-S. W.; Liu, P.-J. The Relationship of Plasma Aluminum to Oxidant-Antioxidant and Inflammation Status in Asthma Patients. Environ. Toxicol. Pharmacol. 2013, 35 (1), 30–38. https://doi.org/10.1016/j.etap.2012.10.005.
- Mold, M.; Umar, D.; King, A.; Exley, C. Aluminium in Brain Tissue in Autism. J Trace Elem Med Biol 2018, 46, 76–82. https://doi.org/10.1016/j.jtemb.2017.11.012.
- Martinez, C. S.; Escobar, A. G.; Uranga-Ocio, J. A.; Peçanha, F. M.; Vassallo, D. V.; Exley, C.; Miguel, M.; Wiggers, G. A. Aluminum Exposure for 60days at Human Dietary Levels Impairs Spermatogenesis and Sperm Quality in Rats. Reprod. Toxicol. 2017, 73, 128–141. https://doi.org/10.1016/j.reprotox.2017.08.008.
- Mold, M.; Cottle, J.; Exley, C. Aluminium in Brain Tissue in Epilepsy: A Case Report from Camelford. Int J Environ Res Public Health 2019, 16 (12). https://doi.org/10.3390/ijerph16122129.
- Matsumoto, H. Cell Biology of Aluminum Toxicity and Tolerance in Higher Plants. Int. Rev. Cytol. 2000, 200, 1–46. https://doi.org/10.1016/s0074-7696(00)00001-2.
- Sass, J. B.; Ang, L. C.; Juurlink, B. H. Aluminum Pretreatment Impairs the Ability of Astrocytes to Protect Neurons from Glutamate Mediated Toxicity. Brain Res. 1993, 621 (2), 207–214. https://doi.org/10.1016/0006-8993(93)90108-y.
- Maya, S.; Prakash, T.; Madhu, K. D.; Goli, D. Multifaceted Effects of Aluminium in Neurodegenerative Diseases: A Review. Biomed. Pharmacother. 2016, 83, 746–754. https://doi.org/10.1016/j.biopha.2016.07.035.
- Inan-Eroglu, E.; Ayaz, A. Is Aluminum Exposure a Risk Factor for Neurological Disorders? J Res Med Sci 2018, 23, 51. https://doi.org/10.4103/jrms.JRMS_921_17.
- Chin-Chan, M.; Navarro-Yepes, J.; Quintanilla-Vega, B. Environmental Pollutants as Risk Factors for Neurodegenerative Disorders: Alzheimer and Parkinson Diseases. Front Cell Neurosci 2015, 9. https://doi.org/10.3389/fncel.2015.00124.
- Campbell, A.; Bondy, S. C. Aluminum Induced Oxidative Events and Its Relation to Inflammation: A Role for the Metal in Alzheimer’s Disease. Cell. Mol. Biol. (Noisy-le-grand) 2000, 46 (4), 721–730.
- Exley, C.; Vickers, T. Elevated Brain Aluminium and Early Onset Alzheimer’s Disease in an Individual Occupationally Exposed to Aluminium: A Case Report. J Med Case Rep 2014, 8, 41. https://doi.org/10.1186/1752-1947-8-41.
- Exley, C. The Aluminium-Amyloid Cascade Hypothesis and Alzheimer’s Disease. Subcell. Biochem. 2005, 38, 225–234.
- Campbell, A.; Bondy, S. C. Aluminum Induced Oxidative Events and Its Relation to Inflammation: A Role for the Metal in Alzheimer’s Disease. Cell. Mol. Biol. (Noisy-le-grand) 2000, 46 (4), 721–730.
- Kawahara, M.; Muramoto, K.; Kobayashi, K.; Mori, H.; Kuroda, Y. Aluminum Promotes the Aggregation of Alzheimer′s Amyloid β-Protein in Vitro. Biochemical and Biophysical Research Communications 1994, 198 (2), 531–535. https://doi.org/10.1006/bbrc.1994.1078.
- Hirsch, E. C.; Brandel, J. P.; Galle, P.; Javoy-Agid, F.; Agid, Y. Iron and Aluminum Increase in the Substantia Nigra of Patients with Parkinson’s Disease: An X-Ray Microanalysis. J. Neurochem. 1991, 56 (2), 446–451. https://doi.org/10.1111/j.1471-4159.1991.tb08170.x.
- Wang, Z.; Wei, X.; Yang, J.; Suo, J.; Chen, J.; Liu, X.; Zhao, X. Chronic Exposure to Aluminum and Risk of Alzheimer’s Disease: A Meta-Analysis. Neurosci. Lett. 2016, 610, 200–206. https://doi.org/10.1016/j.neulet.2015.11.014.
- Neri, L. C.; Hewitt, D. Aluminium, Alzheimer’s Disease, and Drinking Water. Lancet 1991, 338 (8763), 390. https://doi.org/10.1016/0140-6736(91)90531-s.
- CAS Reference Linking Service.
- McKee, A. S.; Burchill, M. A.; Munks, M. W.; Jin, L.; Kappler, J. W.; Friedman, R. S.; Jacobelli, J.; Marrack, P. Host DNA Released in Response to Aluminum Adjuvant Enhances MHC Class II-Mediated Antigen Presentation and Prolongs CD4 T-Cell Interactions with Dendritic Cells. PNAS 2013, 110 (12), E1122–E1131. https://doi.org/10.1073/pnas.1300392110.
- Khan, Z.; Combadière, C.; Authier, F.-J.; Itier, V.; Lux, F.; Exley, C.; Mahrouf-Yorgov, M.; Decrouy, X.; Moretto, P.; Tillement, O.; et al. Slow CCL2-Dependent Translocation of Biopersistent Particles from Muscle to Brain. BMC Med 2013, 11, 99. https://doi.org/10.1186/1741-7015-11-99.
- Lukiw, W. J.; Percy, M. E.; Kruck, T. P. Nanomolar Aluminum Induces Pro-Inflammatory and pro-Apoptotic Gene Expression in Human Brain Cells in Primary Culture. J. Inorg. Biochem. 2005, 99 (9), 1895–1898. https://doi.org/10.1016/j.jinorgbio.2005.04.021.
- Exley, C.; Swarbrick, L.; Gherardi, R. K.; Authier, F.-J. A Role for the Body Burden of Aluminium in Vaccine-Associated Macrophagic Myofasciitis and Chronic Fatigue Syndrome. Med. Hypotheses 2009, 72 (2), 135–139. https://doi.org/10.1016/j.mehy.2008.09.040.
- https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=369.
- Léonard, A.; Gerber, G. B. Mutagenicity, Carcinogenicity and Teratogenicity of Aluminium. Mutat. Res. 1988, 196 (3), 247–257. https://doi.org/10.1016/0165-1110(88)90009-7.
- Darbre, P. D. Aluminium, Antiperspirants and Breast Cancer. J. Inorg. Biochem. 2005, 99 (9), 1912–1919. https://doi.org/10.1016/j.jinorgbio.2005.06.001.
- Khan, Z.; Combadière, C.; Authier, F.-J.; Itier, V.; Lux, F.; Exley, C.; Mahrouf-Yorgov, M.; Decrouy, X.; Moretto, P.; Tillement, O.; et al. Slow CCL2-Dependent Translocation of Biopersistent Particles from Muscle to Brain. BMC Medicine 2013, 11 (1), 99. https://doi.org/10.1186/1741-7015-11-99.
- Cadusseau, J.; Ragunathan-Thangarajah, N.; Surenaud, M.; Hue, S.; Authier, F.-J.; Gherardi, R. Selective Elevation of Circulating CCL2/MCP1 Levels in Patients with Longstanding Post-Vaccinal Macrophagic Myofasciitis and ASIA. Curr Med Chem 2014, 21 (4), 511–517.
- Les vaccins contenant de l’aluminium sont sûrs – Communiqué – ANSM : Agence nationale de sécurité du médicament et des produits de santé https://ansm.sante.fr/S-informer/Communiques-Communiques-Points-presse/Les-vaccins-contenant-de-l-aluminium-sont-surs-Communique (accessed Sep 27, 2019).
- Gherardi, R. K.; Coquet, M.; Chérin, P.; Authier, F. J.; Laforêt, P.; Bélec, L.; Figarella-Branger, D.; Mussini, J. M.; Pellissier, J. F.; Fardeau, M. Macrophagic Myofasciitis: An Emerging Entity. Groupe d’Etudes et Recherche Sur Les Maladies Musculaires Acquises et Dysimmunitaires (GERMMAD) de l’Association Française Contre Les Myopathies (AFM). Lancet 1998, 352 (9125), 347–352.
- Gherardi, R. K.; Authier, F.-J. Macrophagic Myofasciitis: Characterization and Pathophysiology. Lupus 2012, 21 (2), 184–189. https://doi.org/10.1177/0961203311429557.
- Myofasciite à macrophages http://webcache.googleusercontent.com/search?q=cache:_wtw88DQ7WAJ:invs.santepubliquefrance.fr/publications/myofasciite/rapport_myofasciite.pdf+&cd=1&hl=fr&ct=clnk&gl=fr&client=firefox-b-d (accessed May 27, 2019).
- Myofasciite à macrophages https://professionnels.vaccination-info-service.fr/Aspects-sociologiques/Controverses/Myofasciite-a-macrophages (accessed May 27, 2019).
- Gherardi, R. K.; Aouizerate, J.; Cadusseau, J.; Yara, S.; Authier, F. J. Aluminum Adjuvants of Vaccines Injected into the Muscle: Normal Fate, Pathology and Associated Disease. Morphologie 2016, 100 (329), 85–94. https://doi.org/10.1016/j.morpho.2016.01.002.
- EFSA (European Food Safety Authority: Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC)) (2008).
- Safety of Aluminium from Dietary Intake. Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC). The EFSA Journal, 754: 1-34.
- Arnich, N.; Sirot, V.; Rivière, G.; Jean, J.; Noël, L.; Guérin, T.; Leblanc, J.-C. Dietary Exposure to Trace Elements and Health Risk Assessment in the 2nd French Total Diet Study. Food Chem. Toxicol. 2012, 50 (7), 2432–2449. https://doi.org/10.1016/j.fct.2012.04.016.
- Flaten, T. Aluminium in Tea – Concentrations, Speciation and Bioavailability. Coordination Chemistry Reviews 2002, 228, 385–395. https://doi.org/10.1016/S0010-8545(02)00036-X.
- Powell, J. J.; Greenfield, S. M.; Parkes, H. G.; Nicholson, J. K.; Thompson, R. P. Gastro-Intestinal Availability of Aluminium from Tea. Food Chem. Toxicol. 1993, 31 (6), 449–454. https://doi.org/10.1016/0278-6915(93)90162-r.
- Mehra, A.; Baker, C. L. Leaching and Bioavailability of Al Cu and Mn from Tea (Camellia Sinensis). Food Chemistry 2007, 100, 1456–1463. https://doi.org/10.1016/j.foodchem.2005.11.038.
- High Aluminium Levels in Some Matcha Tea Samples. 12.
- https://www.60millions-mag.com/2013/09/26/pas-de-stress-avec-les-dosettes-et-capsules-de-cafe-7886.
- Aguilar F, Autrup H, Barlow S, Castle L, Crebelli R, Dekant W, et al. Safety of Aluminium from Dietary Intake Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC) EFSA J. 2008;754:1–34.
- https://www.anses.fr/fr/system/files/RCCP2008sa0196.pdf
- Domingo JL. Aluminium. In: Benjamin C, Editor. Encyclopedia of Food Sciences and Nutrition. 2nd Ed. Oxford: Academic Press; 2003. Pp. 160–6.
- Karbouj, R. Aluminium Leaching Using Chelating Agents as Compositions of Food. Food Chem. Toxicol. 2007, 45 (9), 1688–1693. https://doi.org/10.1016/j.fct.2007.03.001.
- Fekete, V.; Deconinck, E.; Bolle, F.; Loco, J. V. Modelling Aluminium Leaching into Food from Different Foodware Materials with Multi-Level Factorial Design of Experiments. Food Additives & Contaminants: Part A 2012, 29 (8), 1322–1333. https://doi.org/10.1080/19440049.2012.688068.
- https://www.60millions-mag.com/2014/02/20/trop-d-aluminium-dans-les-laits-pour-bebes-7915
- DARTIGUES, (J.F.); DARTIGUES (J.F.); HELMER (C.); LETENNEUR (L.); PERES (K.); AMIEVA (H.); AURIACOMBE (S.); ORGOGOZO (J.M.); COMMENGES (D.); JACQMIN-GADDA (H.); et al. Paquid 2012 : Illustration et Bilan. Paquid 2012 : illustration et bilan. 2012.
- Exposition à l’aluminium par l’alimentation | Anses – Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail https://www.anses.fr/fr/content/exposition-%C3%A0-l%E2%80%99aluminium-par-l%E2%80%99alimentation (accessed Sep 27, 2019).
- Sears, M. E. Chelation: Harnessing and Enhancing Heavy Metal Detoxification—A Review. ScientificWorldJournal 2013, 2013. https://doi.org/10.1155/2013/219840.
- Ramesh, B.; Satakopan, V. N. Antioxidant Activities of Hydroalcoholic Extract of Ocimum Sanctum Against Cadmium Induced Toxicity in Rats. Indian J Clin Biochem 2010, 25 (3), 307–310. https://doi.org/10.1007/s12291-010-0039-5.
- Kasperczyk, S.; Dobrakowski, M.; Kasperczyk, A.; Ostałowska, A.; Birkner, E. The Administration of N-Acetylcysteine Reduces Oxidative Stress and Regulates Glutathione Metabolism in the Blood Cells of Workers Exposed to Lead. Clin Toxicol (Phila) 2013, 51 (6), 480–486. https://doi.org/10.3109/15563650.2013.802797.
- Ahmed, S.; Rahman, A.; Saleem, M.; Athar, M.; Sultana, S. Ellagic Acid Ameliorates Nickel Induced Biochemical Alterations: Diminution of Oxidative Stress. Hum Exp Toxicol 1999, 18 (11), 691–698. https://doi.org/10.1191/096032799678839563.
- Traina, G. The Neurobiology of Acetyl-L-Carnitine. Front Biosci (Landmark Ed) 2016, 21, 1314–1329.
- Ferreira, G. C.; McKenna, M. C. L-Carnitine and Acetyl-L-Carnitine Roles and Neuroprotection in Developing Brain. Neurochem. Res. 2017, 42 (6), 1661–1675. https://doi.org/10.1007/s11064-017-2288-7.
- ZANELLI, S. A.; SOLENSKI, N. J.; ROSENTHAL, R. E.; FISKUM, G. Mechanisms of Ischemic Neuroprotection by Acetyl-L-Carnitine. Ann N Y Acad Sci 2005, 1053, 153–161. https://doi.org/10.1196/annals.1344.013.
- Nestel, A. W.; Meyers, A. M.; Paiker, J.; Rollin, H. B. Effect of Calcium Supplement Preparation Containing Small Amounts of Citrate on the Absorption of Aluminium in Normal Subjects and in Renal Failure Patients. Nephron 1994, 68 (2), 197–201. https://doi.org/10.1159/000188256.
- Moon, J.; Davison, A.; Bandy, B. Vitamin D and Aluminum Absorption. CMAJ 1992, 147 (9), 1308–1313.
- Domingo, J. L.; Gomez, M.; Sanchez, D. J.; Llobet, J. M.; Corbella, J. Effect of Various Dietary Constituents on Gastrointestinal Absorption of Aluminum from Drinking Water and Diet. Res. Commun. Chem. Pathol. Pharmacol. 1993, 79 (3), 377–380.




article de grande qualité . Personnellement je bois de l’eau du robinet et je ne savais même pas qu’il pouvait y avoir de l’aluminium dedans
Vos articles sont excellents comme d’habitude! Merci pour cette science partagée.
Faites vous des formations sur Genève ou Lausanne?
Bonjour,
Très intéressé par votre parcours de soin concernant la Borréliose de Lyme.
Cordialement.
Article très intéressant ponctué par une grande recherche qui argumente ces propos. Je vais conserver cet article et en parler autours de moi. Merci
Merci Fiabola,
Oui vous trouverez toutes les dates par ici : https://www.sante-et-nutrition.com/conferences-formations/formation-professionnelle/
A bientôt
Bonjour,
Pourquoi le thé ? Je veux dire peut-on l’appliquer à toutes les plantes que nous infusons en tisane ?
Merci
Bonjour, cette réponse m’intéresse également…
Y a t il des thé à privilégier? merci
Bonjour,
Tout dépend de la nature des sols notamment, je n’ai pas la réponse précise pour les autres plantes et infusions.
Bonjour,
Que penser de l’oxyde d’aluminium contenu dans l’argile verte, lorsqu’on utilise celle-ci en interne ?
Par avance merci.
Delphine
Bonjour,
Des études ont montré que certains signaux émis par les téléphones portables (en particulier les signaux de “bornage”) ouvraient transitoirement les canaux ioniques des membranes cellulaires. Ceci vaut en particulier pour la dure-mère, qui emballe et protège le cerveau contre nombre d’agressions toxiques et bactériologiques externes.
En toute logique, ceci pourrait favoriser l’entrée d’ions aluminium. En pratique, je ne crois pas qu’un tel test “croisé” ait jamais été réalisé… J’imagine ce cela pose un double problème de multi-compétence : scientifique et administrative (quel guichet pour financer).
Si quelqu’un en sais plus…