Polyamines, cancer et douleurs chroniques, des pistes thérapeutiques encore peu explorées
Derrière ce terme technique se cache une famille de molécules essentielles à la vie. Principalement au nombre de trois – putrescine, spermidine, spermine – elles sont en effet étroitement impliquées dans les processus de division et de prolifération des cellules. Certaines études mettent de ce fait en évidence leurs liens potentiels dans le développement du cancer et plus récemment dans la gestion de la douleur chronique.
;
Que sont les polyamines ?
Mises en évidence pour la première fois au XVIIème siècle dans le liquide séminal humain, leur reconnaissance en tant que molécules essentielles au métabolisme cellulaire est quant à elle relativement récente. Les polyamines sont des molécules de faible poids moléculaire à l’origine d’une forte interaction électrostatique avec d’autres molécules. En permettant notamment d’initier la synthèse de l’ADN et des protéines, les polyamines sont ainsi étroitement liées aux processus de croissance des cellules, y compris cancéreuses. L’origine des polyamines est avant tout alimentaire et issue de la flore intestinale, même si l’organisme peut également en fabriquer. Dans des conditions physiologiques normales, l’alimentation est en mesure de couvrir les besoins : la quantité de polyamines dans la ration alimentaire dépend de la nature des aliments consommés, mais également de leur degré de fermentation, de leur mode de préparation et de cuisson.
;
Polyamines et cancer
Plusieurs études démontrent que la prolifération cellulaire cancéreuse est dépendante des taux de polyamines et qu’il existe des concentrations plus fortes au sein des cellules cancéreuses en comparaison des cellules normales, ou encore qu’il existe des relations entre le métabolisme des polyamines et les cancers digestifs, du sein ou de la prostate. Chez l’animal, l’association d’un traitement de chimiothérapie à une alimentation dépourvue de polyamines a permis de doubler le temps de survie et de réduire de manière très significative la dissémination métastatique pulmonaire. Chez l’homme, une étude a été menée auprès de 13 patients présentant un adénocarcinome de prostate métastatique. Une alimentation à teneur réduite en polyamines pendant six mois 5 jours sur 7 leur a été proposé, en parallèle d’une décontamination intestinale : les résultats ont mis en évidence une amélioration de l’état général, un effet antidouleur significatif avec baisse de consommation des antalgiques, une absence de toxicité hépatique ainsi qu’un retour des douleurs et une dégradation de l’état général à la suite de l’arrêt du régime.
:
Polyamines et douleur chronique
Selon une étude menée par l’équipe du Pr Breivik en 2006, 15 à 32% des Français souffrent de douleurs chroniques. La douleur est une manifestation complexe et multidimensionnelle fondée sur un processus certes neurobiologique, mais également influencée par les émotions, la mémoire et les automatismes. La sensibilité à la douleur peut ainsi être modulée de manière négative pour réduire la sensibilité (processus sur lequel s’appuient de nombreux médicaments antalgiques), mais également de manière positive selon un processus moins connu à l’origine d’une augmentation de la sensibilité à la douleur. Ce dernier mécanisme pourrait non seulement expliquer les différences de perception ou de résistance à la douleur en fonction des individus, mais également l’apparition de douleurs chroniques dans des pathologies telles que la fibromyalgie ou les douleurs neuropathiques. En empêchant l’hyperfonctionnement de certains récepteurs (NMDA) par un mécanisme de modulation négative, il pourrait alors être possible de réduire la perception de la douleur tout en respectant le fonctionnement physiologique impliqué, à l’inverse de certaines drogues traditionnellement utilisées. C’est précisément à ce niveau que sont mises en évidence les propriétés des polyamines. Une étude menée par le Pr Simonnet et son équipe a ainsi démontré qu’une alimentation pauvre en polyamines pouvait être proposée pour prévenir de manière significative, autant la douleur de longue durée induite en cas d’inflammation ou de lésion que l’hypersensibilité à la douleur. Une telle alimentation pourrait également, à titre curatif cette fois-ci, réduire de manière importante les douleurs chroniques, y compris en cas de faible sensibilité à l’action de la morphine et sans les effets secondaires qu’induisent les antagonistes NMDA.
;
Alimentation contrôlée en polyamines
La proposition d’une alimentation à teneur contrôlée en polyamines représente une approche nutritionnelle innovante, elle peut en effet s’avérer particulièrement intéressante pour optimiser l’efficacité des traitements conventionnels. Les rôles de l’alimentation dans la prévention et l’accompagnement de certaines pathologies sont de plus en plus mis en évidence, l’exemple des polyamines est significatif. Le recours à une telle alimentation peut toutefois générer des interrogations du fait de l’exclusion de certains aliments habituellement considérés comme bénéfiques pour la santé, mais il s’agit ici d’un protocole spécifique, dont les bénéfices possibles peuvent justifier son application temporaire sans remise en question les intérêts à long terme d’aliments au demeurant riches en polyamines.
- Les agrumes et leurs jus, le raisin et son jus, la mangue, les litchis, la banane, le fruit de la passion,
- Les pois (toutes familles confondues), les lentilles, les fèves, les poivrons verts, les tomates, les champignons, la choucroute,
- La farine d’épeautre, de sarrasin et de seigle complètes et leurs dérivés, les flocons d’avoine, le soja (hormis lait et yaourts de soja), le quinoa, les graines (lin, sésame, courge, tournesol), les noisettes,
- Certains fromages (cantal, comté, brie, Munster, reblochon, roquefort, bleu d’auvergne),
- Le foie et ses dérivés, les fruits de mer, les sauces soja et Tempeh.
Si vous souhaitez connaitre le sujet plus en détails…
Rôles des polyamines
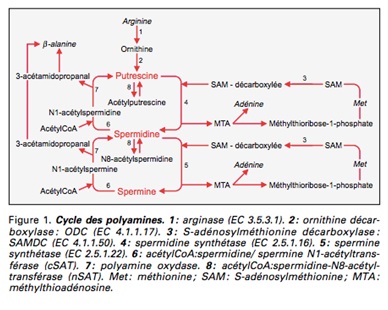
Mises en évidence pour la première fois au XVIIème siècle dans le liquide séminal humain, leur reconnaissance en tant que molécules essentielles au métabolisme cellulaire, et non plus comme simple produit de dégradation, est relativement récente. Elle ne date en effet que des années 1950 . Les polyamines sont des molécules de faible poids moléculaire, constituées d’une chaîne carbonée possédant au moins deux groupements aminés chargés positivement à pH physiologique. En permettant notamment d’initier la synthèse de l’ADN et des protéines, les polyamines sont ainsi étroitement liées aux processus de croissance des cellules. Leur taux est d’ailleurs plus important dans les cellules en prolifération en comparaison des cellules quiescentes . Une déplétion intracellulaire en polyamines est par ailleurs à l’origine de l’induction de l’apoptose . La spermine, du fait de son nombre important de charges positives, est par ailleurs la polyamine possédant l’activité la plus forte et joue un rôle spécifique dans l’organisation structurale et la réactivité de la chromatine . Elle est notamment capable de protéger l’ADN de l’action des endonucléases responsables de la fragmentation de l’ADN, enzymes induites en phase d’exécution de l’apoptose .
Mises en évidence pour la première fois au XVIIème siècle dans le liquide séminal humain, leur reconnaissance en tant que molécules essentielles au métabolisme cellulaire, et non plus comme simple produit de dégradation, est relativement récente. Elle ne date en effet que des années 1950 (1,2). Les polyamines sont des molécules de faible poids moléculaire, constituées d’une chaîne carbonée possédant au moins deux groupements aminés chargés positivement à pH physiologique. Leurs propriétés résident en grande partie dans l’existence de ces charges positives, à l’origine d’une interaction électrostatique étroite avec d’autres macromolécules chargées elles, négativement : ADN, ARN, ATP, protéines ou encore phospholipides membranaires. En permettant notamment d’initier la synthèse de l’ADN et des protéines, les polyamines sont ainsi étroitement liées aux processus de croissance des cellules. Leur taux est d’ailleurs plus important dans les cellules en prolifération en comparaison des cellules quiescentes (3). Une déplétion intracellulaire en polyamines est par ailleurs à l’origine de l’induction de l’apoptose (4). La spermine, du fait de son nombre important de charges positives, est par ailleurs la polyamine possédant l’activité la plus forte (5,6) et joue un rôle spécifique dans l’organisation structurale et la réactivité de la chromatine (7). Elle est notamment capable de protéger l’ADN de l’action des endonucléases responsables de la fragmentation de l’ADN, enzymes induites en phase d’exécution de l’apoptose (8, 9).
;
Source des polyamines
A l’instar de la complexité du fonctionnement des cellules, le métabolisme des polyamines est dépendant de nombreux facteurs. Leur origine est multiple : elles peuvent provenir d’une synthèse endogène, de l’alimentation et de la flore intestinale.
;
1) Synthèse endogène
La synthèse endogène implique quatre enzymes : l’ODC (ornithine décarboxylase), la S-adénosylméthionine décarboxylase (SAM-DC), la spermidine et la spermine-synthétase. Il existe par ailleurs plusieurs voies de retroconversion permettant la régénération de la putrescine et de la spermidine. Les polyamines sont synthétisées par la plupart des cellules, mais sont également issues de cellules mortes et de sources exogènes transportées par un système spécifique, le STP, assurant la régulation des taux intracellulaires. L’ODC est une enzyme-clé fortement impliquée dans le métabolisme de régulation des polyamines. Le gène codant pour cette enzyme est de plus considéré comme un pro-oncogène : il s’agit en effet d’un gène présent dans toutes les cellules mais surexprimé dans les cellules tumorales et dont le produit est impliqué dans la prolifération et la transformation maligne (10, 11).
Catros-Quemener V. Les polyamines : rôle diagnostique et cible thérapeutique en cancérologie (58)
2) Apports alimentaires en polyamines
Dans des conditions physiologiques normales, l’alimentation est en mesure de couvrir les besoins en polyamines, évitant ainsi une synthèse de novo (12-19) : les apports alimentaires sont estimés entre 300 à 600 µmol par jour en fonction des pays (17-19), la quantité de polyamines dans la ration alimentaire dépendant de la nature des aliments consommés, mais également de leur degré de fermentation (15), de leur mode de préparation et de cuisson (16). Ainsi, la détermination des quantités de polyamines présentes dans les aliments demeure difficile à établir et dépendante des méthodes d’analyses utilisées (20) ou de la nature des polyamines considérées (21). De manière simplifiée et rapportées aux quantités consommées par portion, les aliments les plus riches en polyamines sont :
- Les jus d’agrumes (orange, pamplemousse), le jus de raisin et de mangue (ou multifruits)
- Les pois chiches, les pois cassés, les fèves, les petits pois, le soja (hors lait de soja), les lentilles, les graines de courges, de lin, de sésame et de tournesol, les farines d’épeautre, de sarrasin et de seigle complètes ainsi que leurs dérivés (pâtes, pain, etc.), le quinoa, les flocons d’avoine, les haricots rouges, les pistaches, les cacahuètes, le maïs, les steaks de soja, le pain des fleurs au quinoa,
- Certains fruits et légumes non épluchés et non épépinés : l’orange, la poire, le pomelo, la reine-claude, le litchi, la banane, les champignons, la clémentine, le fruit de la passion, le brocolis, le chou-fleur, le chou romanesco, les aubergines, les courgettes, le cresson, les épinards, les poivrons verts, les pousses de soja (haricot mungo), les tomates cerises, la choucroute, les cornichons.
- Certains fromages : le cantal, le comté, le brie, le munster, le reblochon, le roquefort, le bleu d’auvergne
- Le foie, le porc, le canard, le pigeon, la pintade, le faisan, les rognons, la rosette, le pâté de foie, le foie gras, les huitres, les moules, les noix de St Jacques, les palourdes, le foie de morue, les bigorneaux, les bulots, les œufs de saumon,
- Condiments et aromates : pousses de carottes ou de moutarde, germe de blé, levure de boulanger, spiruline, son d’avoine les cornichons, le pollen, la sauce Tamari, la sauce soja, le Tempeh, basilic, cerfeuil, origan, curcuma, curry, poudre d’ail, safran.
Un certain nombre d’aliments considérés comme bénéfiques pour la santé, notamment du fait de leur richesse en antioxydants et actifs végétaux (agrumes, légumineuses, pollen, curcuma ou brocoli par exemple), apparaissent ici riches en polyamines. La mise en place d’un protocole nutritionnel visant à réduire les apports en polyamines se réalise dans un contexte spécifique (accompagnement de traitements de chimiothérapie ou de la douleur chronique) et peut donc justifier la réduction ou l’exclusion temporaire de ces aliments. Dans le cas spécifique du curcuma, sa teneur totale en polyamines (entre 218 et 591 nmol/g selon les analyses et les origines) en fait un aliment pouvant être maintenu à dose modérée compte tenu des faibles quantités consommées par portion (quelques grammes).
,
3) Production par la flore intestinale
La flore intestinale est composée d’environ 100 000 milliards de bactéries, appartenant à des genres, des espèces et des familles variées. La nature de la flore dépend de nombreux facteurs, notamment du type de bactéries implantées au cours des premiers mois de vie du nourrisson et de l’alimentation (22). D’une manière générale, les bactéries de la flore produisent de grandes quantités de polyamines à partir de déchets protéiques, en particulier de la spermidine, même si les proportions peuvent varier en fonction du type de bactéries (23,24). L’alimentation elle-même influence donc la production des polyamines par le microbiote : en fonction de la nature des aliments consommés, certaines souches de bactéries disposeront de substrats favorisant leur croissance. Une alimentation riche en protéines insuffisamment mâchée favorisera par exemple la prolifération d’une flore dite de putréfaction, à l’origine d’une production accrue d’amines.
Les cellules de la muqueuse intestinale sont particulièrement impliquées dans le métabolisme des polyamines. Elles sont en effet à la fois exposées aux sources alimentaires et aux polyamines issues de la flore intestinale elle-même (25). L’ingestion de polyamines exogènes, en particulier la spermine, semble par ailleurs liée à la maturation du système digestif chez le rat. En effet, plusieurs arguments lient ce phénomène à l’introduction de la spermine dans le régime alimentaire : l’inhibition de l’ornithine décarboxylase retarde l’établissement d’un phénotype intestinal de type adulte, la quantité de spermine ingérée via l’alimentation augmente considérablement au moment du sevrage, le maintien de nouveau-nés sous une alimentation appauvrie en polyamines retarde le développement normal de la muqueuse intestinale, l’administration orale de spermine induit précocement le développement postnatal de l’intestin grêle et des pathologies humaines caractérisées par un retard du développement intestinal sont considérées comme étant liées à une déficience en polyamines (26).
;
Quelles sont les relations mises en évidence entre les polyamines et le cancer ?
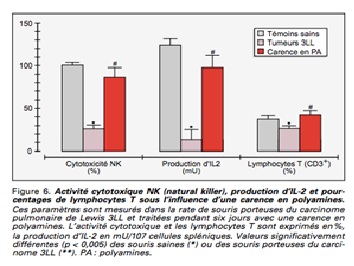
Comme nous l’avons évoqué précédemment, les polyamines sont impliquées de manière étroite dans les processus de prolifération cellulaire néoplasiques (3, 27-30). Deux chercheurs de l’université de Rennes, les Pr Moulinoux et Simonnet, ont particulièrement étudié les relations pouvant exister entre les polyamines et le cancer (31). Plusieurs études réalisées in vitro démontrent en effet que la prolifération cellulaire cancéreuse est dépendante des taux de polyamines, notamment à travers la régulation de l’ODC et qu’il existe des concentrations plus fortes au sein des cellules cancéreuses en comparaison des cellules normales (28-31). Il existe en effet une augmentation de la synthèse de novo et de l’absorption intracellulaire des polyamines au sein des cellules tumorales (1, 25, 32). La question de l’association entre l’induction de l’ODC, l’accumulation intracellulaire des polyamines et la croissance cellulaire tumorale se pose donc légitiment et a fait l’objet de nombreuses études sur différents cancers (33). Les carcinogènes provoquent en effet une augmentation transitoire de l’ODC alors que son inhibition réduit la croissance et la transformation cellulaire (1, 27, 33, 34). De même, la surexpression du gène de l’ODC permet aux cellules d’acquérir des capacités angiogéniques (35). Le métabolisme des polyamines est donc un marqueur potentiel du niveau prolifératif cancéreux (53, 54) et la cible de drogues antiprolifératives (1,36). Plusieurs études ont mis en évidence des relations entre le métabolisme des polyamines et les cancers digestifs, du sein ou de la prostate (37-43). Par ailleurs, chez des patients porteurs d’un adénocarcinome de prostate métastasique, les taux érythrocytaires de polyamines sont corrélés à la progression tumorale (44,45). Chez l’animal, le taux de polyamines circulantes représente donc l’un des paramètres essentiels à la prolifération des cellules tumorales. Un tissu tumoral capte davantage les polyamines extracellulaires et une carence en polyamine favorise l’effet antiprolifératif des drogues anticancéreuses tout en réduisant leur toxicité (46). L’association d’un inhibiteur de l’ODC, de Néomycine©, et de Flagyl© , ainsi qu’une alimentation dépourvue de polyamines a permis de doubler le temps de survie des animaux et de réduire de manière très significative la dissémination métastatique pulmonaire. Enfin, l’association d’un régime pauvre en polyamines à une décontamination intestinale sans inhibiteur de biosynthèse des polyamines entraîne une diminution de 50% de la croissance tumorale au niveau de la prostate (46). Une étude a été menée auprès de 13 patients présentant un adénocarcinome de prostate métastatique. Une alimentation à teneur réduite en polyamines pendant six mois 5 jours sur 7 leur a été proposé, en parallèle d’une décontamination intestinale intermittente par néomycine et métronidazole : les résultats ont mis en évidence une amélioration de l’état général selon le score OMS, un effet antidouleur significatif avec baisse de consommation des antalgiques, une absence de toxicité hépatique ainsi qu’un retour des douleurs et une dégradation de l’état général à la suite de l’arrêt du régime (47, 48).
Catros-Quemener V. Les polyamines : rôle diagnostique et cible thérapeutique en cancérologie (58)
,
Implication des polyamines dans la douleur
Selon une étude menée par l’équipe du Pr Breivik en 2006, 15 à 32% des Français souffrent de douleurs chroniques (49). L’IASP (comité de taxonomie de l’International Association for the Study of Pain), définit la douleur par « une expérience désagréable, sensorielle et émotionnelle associée à un dommage tissulaire présent ou potentiel ou décrite en ces termes ». La douleur est donc une manifestation complexe et multidimensionnelle fondée sur un processus certes neurobiologique, mais également influencée par les émotions, la mémoire et les automatismes.
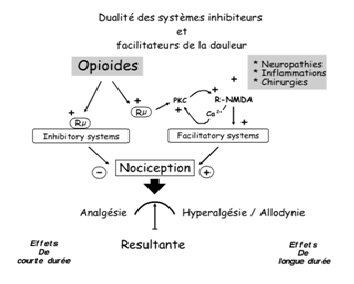
Au niveau périphérique, la douleur est en effet provoquée par la stimulation de récepteurs nociceptifs situés notamment au niveau cutanéo-muqueux. Ce stimulus va alors être transformé en potentiel électrochimique généré par les échanges ioniques, pour parvenir au niveau de la corne postérieure de la moelle épinière, plus précisément du neurone à convergence, qui va traiter l’information pour la transmettre à l’hypothalamus. Or l’hypothalamus est également le siège de traitement d’autres facteurs extérieurs, notamment des émotions et des expériences, qui vont potentiellement moduler la perception de la douleur. Le système nerveux est par ailleurs capable de réduire sa propre sensibilité à la douleur via les systèmes opioïdes endogènes. C’est d’ailleurs selon ce principe de modulation négative, ou d’hyposensibilité à la douleur, que sont développés de nombreux médicaments antalgiques. A l’inverse, il existe des processus moins connus, dits de modulation positive, à l’origine d’une augmentation de la sensibilité à la douleur : ces mécanismes pourraient non seulement expliquer les différences de perception ou de résistance à la douleur en fonction des individus, mais également l’apparition de la douleur chronique (50-54).
La prise répétée ou à fortes doses d’analgésiques opioïdes peut être à l’origine d’une hypersensibilité latente à la douleur (54-56), ressentie comme étant plus forte et plus durable que la stimulation originelle elle-même. Cette hypersensibilité peut alors donner naissance à une sensation douloureuse déclenchée par un stimulus non sensoriel (stress environnemental non nociceptif ou SEEN). Ainsi, des animaux ayant déjà été confrontés à une prise d’opioïdes ou à une lésion malgré que cette dernière soit guérie, peuvent souffrir d’une douleur d’autant plus exacerbée que ce stress va être répété. Ce point est particulièrement intéressant : il met en effet en évidence le fait que l’efficacité d’une drogue sur un individu peut varier en fonction de l’expérience de cet individu. Par ailleurs, plus des animaux subissent des stress non nociceptifs répétés, plus ils déclenchent une sensibilité à la douleur forte à des lésions alors même qu’ils n’ont jamais connus d’expérience douloureuse à la douleur. Extrapolé à l’homme, ce mécanisme met en évidence combien l’histoire du stress d’un individu est importante pour comprendre les réactions de ce dernier à la douleur et ouvre de nouvelles pistes de réflexion sur les origines possibles des douleurs qualifiées d’exagérées telles que la fibromyalgie ou les douleurs neuropathiques.
Simonnet Guy : approche nutritionnelle de la douleur (57)
Une nouvelle approche de prise en charge de la douleur chronique
Les processus de sensibilisation à la douleur sont dépendants des récepteurs NMDA (N méthyl D aspartate) via l’intervention d’acides aminés excitateurs tels que le glutamate et l’aspartate . A chaque stimulus nociceptif, les récepteurs NMDA sont en effet activés et participent ainsi à l’amplification de la douleur. En effet, les récepteurs NMDA possèdent des sites de réception aux polyamines pouvant moduler leur action. Via un mécanisme de double inhibition (l’activation des sites-recepteurs aux polyamines induit l’inhibition d’un autre site-récepteur sensible au proton, inhibant lui-même le fonctionnement des récepteurs NMDA), la présence de polyamines pourrait engendrer une stimulation positive des récepteurs NMDA et à l’inverse, l’absence de polyamines pourrait réduire l’hyperfonctionnement de ces récepteurs et la sensibilité à la douleur qui en découle. Une étude menée par le Pr Simonnet et son équipe a ainsi démontré qu’une alimentation pauvre en polyamines pouvait être proposée pour prévenir de manière significative, autant la douleur de longue durée induite en cas d’inflammation ou de lésion que l’hypersensibilité à la douleur. Une telle alimentation pourrait également, à titre curatif cette fois-ci, réduire de manière importante les douleurs chroniques, y compris en cas de faible sensibilité à l’action de la morphine et sans les effets secondaires qu’induisent les antagonistes NMDA .
Les processus de sensibilisation à la douleur sont dépendants des récepteurs NMDA (N méthyl D aspartate) via l’intervention d’acides aminés excitateurs tels que le glutamate et l’aspartate (52, 53). A chaque stimulus nociceptif, les récepteurs NMDA sont en effet activés et participent ainsi à l’amplification de la douleur. En empêchant leur hyperfonctionnement par un mécanisme de modulation négative, il pourrait alors être possible de réduire la perception de la douleur tout en respectant le fonctionnement physiologique impliqué, à l’inverse de certaines drogues traditionnellement utilisées. C’est précisément à ce niveau que sont mises en évidence les propriétés des polyamines. En effet, les récepteurs NMDA possèdent des sites de réception aux polyamines pouvant moduler leur action. Via un mécanisme de double inhibition (l’activation des sites-recepteurs aux polyamines induit l’inhibition d’un autre site-récepteur sensible au proton, inhibant lui-même le fonctionnement des récepteurs NMDA), la présence de polyamines pourrait engendrer une stimulation positive des récepteurs NMDA et à l’inverse, l’absence de polyamines pourrait réduire l’hyperfonctionnement de ces récepteurs et la sensibilité à la douleur qui en découle. Une étude menée par le Pr Simonnet et son équipe a ainsi démontré qu’une alimentation pauvre en polyamines pouvait être proposée pour prévenir de manière significative, autant la douleur de longue durée induite en cas d’inflammation ou de lésion que l’hypersensibilité à la douleur. Une telle alimentation pourrait également, à titre curatif cette fois-ci, réduire de manière importante les douleurs chroniques, y compris en cas de faible sensibilité à l’action de la morphine et sans les effets secondaires qu’induisent les antagonistes NMDA (57).
La proposition d’une alimentation à teneur contrôlée en polyamines s’avère une approche nutritionnelle innovante. Elle peut en effet s’avérer particulièrement intéressante pour optimiser l’efficacité des traitements conventionnels. Pour rappel, une fois les quantités corrélées à la taille des portions classiquement consommées, les principaux aliments à éviter dans ce cadre sont :
- Les agrumes et leurs jus, le jus de raisin et son jus, la mangue, les litchis, la banane, le fruit de la passion,
- Les pois (toutes familles confondues), les lentilles, les fèves, les poivrons verts, les tomates, les champignons, la choucroute,
- La farine d’épeautre, de sarrasin et de seigle complètes et leurs dérivés, les flocons d’avoine, le soja (hormis lait et yaourts de soja), le quinoa, les graines (lin, sésame, courge, tournesol), les noisettes,
- Certains fromages (cantal, comté, brie, Munster, reblochon, roquefort, bleu d’auvergne),
- Le foie et ses dérivés, les fruits de mer, les sauces soja et Tempeh.
Les rôles de l’alimentation dans la prévention et l’accompagnement de certaines pathologies sont de plus en plus mis en évidence, l’exemple des polyamines en est un significatif. Le recours à une telle alimentation peut toutefois générer des interrogations du fait de l’exclusion de certains aliments habituellement considérés comme globalement bénéfiques pour la santé, mais il s’agit encore une fois ici d’un protocole spécifique, dont les bénéfices possibles peuvent justifier son application temporaire sans remise en question des intérêts d’aliments au demeurant riches en polyamines sur le long terme.
Références :
- Pegg AE. Polyamine metabolism and its importance in neoplastic growth and as a target for chemotherapy. Cancer Res 1988 ; 48 : 759-74.
- Seiler N. Formation, catabolism and pro- perties of the natural polyamines. In: Car- ter C, ed. The neuropharmacology of polyamines. London: Academic Press, 1994: 1-36.
- Tabor CW, Tabor H. Polyamines. Ann Rev Biochem. 1984 ; 53:135-146.
- Wata S, Sato Y, Asada M, Takagi M, Tsujimoto A, Inaba T, et al. Anti-tumor activity of antizyme which targets the ornithine decarboxylase (ODC) required for cell growth and transformation. Oncogene. 1999 ; 18:165-172.
- Bueb J-L, Da Silva A, Mousli M, Landry Y. Natural polyamines stimu late G-Proteins. Biochem J. 1992 ; 282:545-550.
- Yuan Q, RAY RM, Viar MJ, Johnson LR. Polyamine regulation of ornithine decarboxylase and its antizyme in intestinal epithelial cells. Am J Physiol Gastrointest Liver Physiol. 2001 ; 280:G130-G138.
- Moulinoux JP, Quemener V. Les polyamines : aspects chimiques, rôle biologique, applications médicales. Paris : Médecine-Sciences Flammarion, 1991 : 1-280.
- Moulinoux JP, Quemener V, Khan NA. Biological significance of circulating polyamines in oncology. Cell Mol Biol. 1991; 37:773-783.
- Heby O. Polyamines in Biomed Res. John Wiley & Sons. NY, 1980, pp 27.
- Marton LJ, Pegg AE. Polyamines as tar- gets for therapeutic intervention. Annu Rev Pharmacol Toxicol 1995 ; 35 : 55-91.
- Paasinen-Sohns A, Hölttä E. Cells trans- formed by ODC, c-Ha-ras and v-src exhibit MAP kinase/Erk-independent constitutive phosphorylation of Sos, Raf and c-Jun activation domain, and reduced PDGF receptor expression. Oncogene 1997 ; 15 : 1953-66.
- Bardocz S, Grant G, Brown DS, Ralph A, Pusztai A. Polyamines in food-implications for growth and health. J Nutr Biochem. 1993 ; 4:66-71.
- Bardocz S, Duguid TJ, Brown DS, Grant G, Pusztai A, White A, et al. The importance of dietary polyamines in cell regeneration and growth. Brit J Nutr. 1995 ; 73:819-828.
- Ploszaj T, Ryniewicz Z, Motyl T. Polyamines in goat’s colostrum and milk. Comp Biochem Phys. 1997 ; 118:45-52.
- Okamoto A, Sugi E, Koizumi Y, Yanagida F, Udaka S. Polyamines content of ordinary foodstuffs and various fermented foods. Biosci Biotech Bioch. 1997 ; 61:1582-1584.
- Herandez-Jover T, Izquierdo-Pulido M, Veciana-Nogués MT, Mariné-Font A, Vidal-Carou MC. Biogenic amine and polyamines contents in meat and meat products. J Agr Food Chem. 1997 ; 45:2098- 2102.
- Bardocz S, Brown DS, Grant G, Pusztai A. Luminal and basolateral polyamine uptake by rat small intestine stimulated to grow by Phaseolus vul- garis lectin phytohaemagglutinin in vivo. Biochim Biophys Acta. 1990 ; 1034:46-52.
- Bardocz S, Hughes EL, Grant G, Brown DS, Duguid TJ, Pusztai A. Uptake interorgan distribution and metabolism of dietary putrescine in the rat. J Nutr Biochem. 1998 ; 9:332-338.
- Dorhout B, Van Faassen A, Van Beusekom CM, Kingma AW, Dhoog E, Nagel GT, et al. Oral administration of deuterium labelled poly- amines to suckling rat pups. Luminal uptake, metabolic fate and effects on gastrointestinal maturation. Brit J Nutr. 1997 ; 78:639-654.
- Atiya Ali M, Poortvliet E, Strömberg R, Yngve A. Polyamines in foods: development of a food database. Food Nutr Res. 2011 Jan 14;55.
- Cipolla B, Havouis R and Moulinoux JP (2007) Polyamine contents in current foods: a basis for polyamine reduced diet and a study of its long term observance and tolerance in prostate carcinoma patients. Amino Acids 33: 203-212.
- Smith HW. Observations on the flora of the alimentary tract of animals and factor affecting its composition. J Pathol Bact. 1965; 89:95-122.
- Hamana K, Satake S. Absence of cellular polyamines in gram-positiv anaerobic cocci and lactic acid bacteria. J Gen Appl Microbiol. 1995 ; 41:159-163.
- Noack J, Kleessen B, Proll J, Dongowski G, Blaut M. Dietary guar gum and pectin stimulate intestinal microbial polyamine synthetis in rats. J Nutr. 1998 ;128:1385-1391.
- Seiler N, Delcros J-G, Moulinoux J-P. Polyamines transport in mam- malian cells. An update Int. J Biochem Cell Biol. 1996 ; 28 :843-861.
- Gharbi Myriam. Analyse des modifications induites dans les entérocytes suite à l’ingestion de spermine. Thèse doctorale, 2007.
- Auvinen M, Paasinen A, Andersson LC, Höltta E. Ornithine decar- boxylase activity is critical for cell transformation. Nature. 1992 ; 360:355- 358.
- Wallace HM, Keir HM. A comparison of polyamines metabolism in nor- mal and transformed baby-hamster-kidney cells. Biochem J. 1982 ; 202:785-790.
- Heby O. Polyamines and cell differentiation The physiology of polyami- nes. I 1989: 83-94.
- Heby O, Holm I, Frostesjö L, Collin H, Grahn B, Rehnholm A, et al. Polyamines: regulators of mammalian cell growth and differentiation. Polyamines in the gastrointestinal tract. 1992 ;19-28.
- Moulinoux JP, Cipolla B, Simmonet G. Polyamines and cancer: scientific basis and therapeutic potentialities. La Revue de Gériatrie, 2010 ; Tome 35 n°6.
- Russo F, Linsalata M, Giorgo I, Caruso ML, Armentano R, Di Leo A. Polyamines levels and ODC activity in intestinal-type and diffuse-type gastric carcinoma. Digest Dis Sci. 1997 ;42:576-579.
- Jänne J, Pösö H, Raina A. Polyamines in rapid growth and cancer. Biochim Biophys Acta. 1978 ; 473:241-293.
- Tabib A, Bachrach U. Polyamines induce malignant transformation in cultured NIH 3T3 fibroblasts. Int J Biochem Cell Biol. 1998 ; 30:135- 146.
- Monte M, Klein S, Jasnis MA, Davel L, Algranati ID, De Lustig ES. Inhibition of lymphocyte and tumor-induced angiogenesis by the administra- tion of difluoromethylornithine. Cancer J. 1993 ; 6:147-150.
- Casero RA, Marton LJ. Targeting polyamine metabolism and function in cancer and other proliferative diseases. Nature Reviews. Drug Discovery 2007 ; 6:373-390.
- Scalabrino G, Ferioli ME. Polyamines in mammalian tumors. Part I. Adv Cancer Res. 1981 ; 35:151-268.
- Scalabrino G, Ferioli ME. Polyamines in mammalian tumors. Part II. Adv Cancer Res. 1982 ; 36:1-102.
- Thomas T, Thomas TJ. Polyamine metabolism and cancer. J Cell Mol Med. 2003 ; 7:113-126.
- Saydjari R, Townsend CM Jr, Barranco SC, Thompson JC. Polyamines in gastrointestinal cancer. Dig Dis Sci. 1989 ; 34:1629-1636. 44. Milovic V, Turchanowa L. Polyamines and colon cancer. Biochem Soc Trans. 2003 ; 31:381-383. 45. Weiss TS, Bernhardt G, Buschauer A, Thasler WE, Dolgner D,
- Zirngibl H, et al. Polyamine levels of human colorectal adenocarcinomas are correlated with tumor stage and grade. Int J Colorectal Dis. 2002 ; 17:381-387.
- Levêque J, Foucher F, Bansard JY, Havouis R, Grall JY, Moulinoux JP. Polyamine profiles in tumor, normal tissue of the homolo- gous breast, blood, and urine of breast cancer sufferers. Breast Cancer Res Treat. 2000 ; 60:99-105.
- Leveque J, Foucher F, Havouis R, Desury D, Grall JY, Moulinoux JP. Benefits of complete polyamine deprivation in hormone responsive and hormone resistant MCF-7 human breast adenocarcinoma in vivo. Anticancer res. 2000 ; 20:97-101.
- Cipolla B, Guille F, Moulinoux JP, Bansard JY, Roth S, Staerman F, et al. Erythrocyte polyamines and prognosis in stage D2 prostatic carcinoma patients. J Urol. 1994 ; 151:629-633.
- Cipolla B, Ziade J, Bansard JY, Moulinoux JP, Staerman F, Quemener V, et al. Pretherapeutic erythrocyte polyamine spermine levels discriminate high risk relapsing patients with M1 prostate carcinoma. Cancer. 1996 ; 78:1055-1065.
- Cipolla B, Blanchard Y, Chamaillard L, Quemener V, Guillé F, Havouis R, et al. In vivo, synergestic inhibition of MAT-LyLu rat prostatic adenocarcinoma growth by polyamine deprivation and low-dose cyclophos- phamide. Urol Res. 1996 ; 24:93-99.
- Cipolla, B, Guillé F, Moulinoux JP. Polyamine-reduced diet in metastatic hormone-refractory prostate cancer patients. Biochem Soc Trans. 2003; 31:384-387.
- Cipolla B, Havouis R, Moulinoux JP. Polyamine contents in current foods: a basis for polyamine reduced diet and a study of its long term observance and tolerance in prostate carcinoma patients. Amino Acids. 2007 ; 33:203–212.
- Breivik H & Co. Survey of chronic pain in Europe : prevalence, impact on daily life and treatment. Eur J Pain 2006 ; 10 :287-333/
- Laulin JP, Célèrier E, Larcher A, Le Moal M, Simonnet G. Opiate tolerance to daily heroin administration: an apparent phenomenon associated with enhanced pain sensitivity. Neuroscience 1999 ; 89:631-636.
- Laulin JP, Maurette P, Corcuff JB, Rivat C, Chauvin M, Simonnet G. The role of ketamine in preventing fentanyl-induced hyperalgesia and subsequent acute morphine tolerance. Anesth Analg 2002 ; 94:1263-1269.
- Célèrier E, Laulin JP, Corcuff JB, Le Moal M, Simonnet G. Progressive enhancement of delayed hyperalgesia induced by repeated heroin administration: a sensitization process. J Neurosci 2001 ; 21:4074- 4080.
- Célèrier E, Rivat C, Jun Y, Laulin JP, Larcher A, Reynier P, Simonnet G. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology 2000 ; 92:465-472.
- Rivat C, Laulin JP, Corcuff JB, Celerier E, Pain L, Simonnet G. Fentanyl enhancement of carrageenan- induced long-lasting hyperalgesia in rats: prevention by the N-methyl-D-aspartate receptor antagonist ketamine. Anesthesiology 2000 ; 96:381-391.
- Rivat C, Laboureyras E., Richebé P., Laulin JP, Le Roy C.and Simonnet G. Non-nociceptive environmental stress induces hyperalgesia, not analgesia, in pain and opioid experienced rats. Neuropsychopharmacology 2007, 32, 2217-2228.
- Rivat C, Laboureyras E., Richebé P., Laulin JP, Le Roy C.and Simonnet G. Polyamine deficient diet to relieve pain hypersensitivity. 2007
- Simonnet G. Approche nutritionnelle de la douleur – Régime alimentaire appauvri en polyamines- Institut de France, 2008
- Catros-Quemener V, Chamaillard L, Bouet F. Les polyamines : rôle diagnostique et cible thérapeutique en cancérologie. Médecine/sciences 1999 ; 15 : 1078-85
Anthony Berthou





Bonjour,
Votre article est vraiment très intéressant. Cependant, j’avais à l’esprit qu’en cas de crohn, de RCH, d’infections intestinales, de prises répétées d’antibiotiques ou d’antiinflammatoires, de pathologies inflammatoires, d’ischémie reperfusion chez le sportif… une alimentation équilibrée mais favorisant les polyamines (introduite avec prudence en cas de douleurs)était conseillée. Qu’en pensez vous?
merci
Bonjour,
Je n’ai pas de données validées en ce sens.
Cet article est très intéressant. La réduction, voire la suppression temporaire des aliments riches en polyamides m’a été conseillé par le médecin anesthésiste avant l’opération d’une prothèse de hanche. Je n’ai ressenti la moindre douleur pendant et après mon hospitalisation.
ça limite enormément le choix des aliments à consommer avec un cancer du sein;qu’est il bon de manger dans ces conditions?
Je fais attention à mon alimentation car lymphoïde et me nourrit de tous ses aliments à éviter . Quoi manger ?
Bonjour,
Je voudrais avoir comment dépister la présence de Polyamines dans un aliment diététique hyperprotéiné à destination d’une personne cancéreuse dénutrie.
Merc
Bonjour,
Il vous faut demander ces résultats au fabricant.
Cordialement
Bonjour, merci pour votre article. la Spermidine est souvent presente comme un bon complement alimentaire pour favoriser l’autophagie. Est-ce que vous deconseille pour des personnes en bonne santee (pas de cancer)?
Bonjour Arnaud,
Je n’ai pas de recul sur l’usage de la spermidine dans ce cadre.
Anthony