Pour aller à l’essentiel
- La peroxydation des oméga 3 représente une limite importante à se supplémenter en oméga 3 car ces derniers peuvent être plus délétères que bénéfiques sur la santé. Plusieurs indices permettent de mesurer le niveau d’oxydation : l’indice de peroxyde, l’indice d’anisidine et le TOTOX. La réglementation sur les contrôles des produits n’est malheureusement à ce jour pas assez rigoureuse pour garantir une traçabilité suffisante. En dehors des compléments alimentaires, cette péroxydation concerne également les oméga 3 des produits naturels (sardines en boite, saumon en conserve, maquereau surgelé, mode de cuisson et de préparation, etc.) mais la matrice de l’aliment permet une certaine protection des oméga 3.
- Il existe différentes formes d’oméga 3 sur le marché et je vous recommande de privilégier les origines naturelles et de bien veiller à la qualité des produits :
- Demander au fabricant l’indice TOTOX, qui doit être le plus bas possible.
- Rechercher plutôt les formes naturelles (triglycérides originels) ou sous forme de phospholipides.
- Privilégier les labels EPAX et Quality silver pour limiter les risques d’oxydation et de contamination par les métaux lourds.
- Acheter les compléments alimentaires produits le plus récemment possible et de les conserver au congélateur.
- Éviter les formes en flacons (au profit des capsules) et/ou aromatisées tout en privilégiant la protection par des extraits végétaux (par exemple le romarin, plus efficace que la vitamine E seule).
- La supplémentation en oméga 3 doit à mon sens demeurer ponctuelle, l’alimentation méritant d’être la principale source de ces acides gras, notamment via les petits poissons gras et les huiles de qualité. La supplémentation peut se justifier dans les situations suivantes :
- Prévention de l’arythmie : 700 mg à 1 g / jour.
- Prévention de l’hypertriglycéridémie : effets proportionnels aux doses, de 200 mg à 2,5 g par jour.
- Athérosclérose : de 1 g à plus de 3 g / jour.
- Optimisation des fonctions cérébrales : de 1 à 2,5 g d’EPA.
- Troubles neurodégénératifs, de la mémoire ou déclin cognitif : de 500 mg à 1500 mg par jour de DHA.
Les personnes suivant un régime vegan peut privilégier l’apport d’oméga 3 sous forme d’algues en s’orientant vers l’algue rouge Crypthecodinium cohnii et la microalgue Schizochytrium.
Les compléments alimentaires à base d’oméga 3
Lorsque vous mangez des graisses, vous consommez en réalité majoritairement des triglycérides, à savoir des molécules composées de trois acides gras et d’un alcool, le glycérol. Les oméga 3 font donc partie des acides gras présents naturellement dans les triglycérides. Les compléments alimentaires proposent alors différentes formes d’oméga 3 à longue chaîne (EPA et DHA) :
- Les oméga 3 issus de triglycérides originels contenant, comme leur nom l’indique, les triglycérides sous leur forme naturelle, identique à celles que vous pourriez consommer dans du poisson par exemple. Les produits ainsi proposés contiennent environ 30 % d’oméga 3 de la quantité totale, selon un ratio 18/12 (18 % EPA et 12 % DHA).
- Les oméga 3 issus de triglycérides ré-estérifiés sont proposés eux-aussi sous forme de triglycérides, mais modifiés. Différentes étapes industrielles réarrangent en effet ce triglycéride de façon à les concentrer en oméga 3, en DHA et/ou en EPA. L’assimilation ne semblerait pas altérée1.
- Les oméga 3 sous forme d’éthyl-esters sont des oméga 3 issus d’un procédé chimique visant à isoler les acides gras du glycérol pour concentrer les teneurs en EPA et/ou en DHA dans le produit fini.
- Les oméga 3 sous forme de phospholipides, contenus par exemple dans l’huile de krill ou dans les produits riches en phospholipides de jaune d’œuf. Les oméga 3 ne sont pas ici présents sous forme de triglycérides, mais de phospholipides qui sembleraient plus stables face à l’oxydation et qui pénètreraient mieux les membranes cellulaires du fait d’une meilleure biodisponibilité2-4. Certains phospholipides, en particulier la phosphatidylsérine, sont reconnus pour contribuer à réduire le déclin cognitif5. Les sources de phospholipides sont toutefois beaucoup moins concentrées en oméga 3.
Pendant longtemps, les triglycérides originels ont été plus recommandés que les formes d’esters éthyliques, notamment au regard de leur meilleure stabilité, d’une résistance plus importante aux lipases digestives et de leur mode d’assimilation à travers la barrière intestinale6. Toutefois, une étude plus récente semble remettre en question cet aspect, les taux sanguins en oméga 3 étant comparables 36 h après la consommation de triglycérides ou d’esters-éthyliques7. La plupart des études ayant montré les bénéfices d’une supplémentation en oméga 3 sur la santé ont utilisé des esters éthyliques. Ainsi, davantage qu’une question de biodisponibilité entre les différentes formes, pour laquelle rien n’est établi de manière consensuelle, c’est à mon sens le choix de l’origine de l’huile qui doit vous guider. A titre personnel, je préconise davantage les formes originelles. Le cas des oméga 3 proposés sous forme de phospholipides est à isoler dans la mesure où la supplémentation vise à apporter des principes actifs complémentaires (les phospholipides) mais pouvant tout à fait trouver leur légitimité dans certaines indications – le déclin cognitif notamment – même si les quantités sont moins importantes.
L’huile de krill présente quant à elle l’avantage d’apporter un antioxydant spécifique, l’astaxanthine, à l’origine de la pigmentation rose-orangée de ces petites crevettes. Malheureusement, ces antioxydants ne semblent pas protéger l’huile de la péroxydation en cas de recours à un complément alimentaire (voir schéma ci-dessous).
Les personnes suivant un régime vegan ou souhaitant privilégier les formes d’oméga 3 apportées par les algues pourront plutôt s’orienter vers des formules contenant l’algue rouge Crypthecodinium cohnii et/ou la micro-algue Schizochytrium, riches en DHA. De plus, une telle supplémentation permet de limiter les métaux lourds. Elle apparaît donc optimale chez la femme enceinte. Les bénéfices des formes alguaires sembleraient équivalentes aux formes marines42,43. Petit bémol toutefois, l’algue contient surtout le DHA, ce qui apparait limitant lorsque l’on veut supplémenter en EPA. Par ailleurs leur prix actuel est bien plus élevé que les formes à base d’huile de poisson.
Attention aux contaminants
Lorsqu’on évoque les poissons gras, la question légitime du risque de contamination se pose. L’analyse des compléments alimentaires révèle globalement des taux de mercure largement en-deçà des normes (1 à 6 ppb contre 100 ppb maximum autorisés), mais une présence de PCB dans plusieurs produits8. Deux labels bretons, EPAX et Quality silver, garantissent une absence quasi totale de contaminants et un procédé de micro-encapsulation destiné à limiter l’oxydation. Les poissons utilisés sont alors issus du Pérou et du Chili.
Le label Friend of the sea garantit quant à lui l’utilisation pour partie de poissons issues de la pêche et pour l’autre partie d’élevage intensif en Amérique du sud.
Quelle quantité et quelle concentration en oméga 3 choisir ?
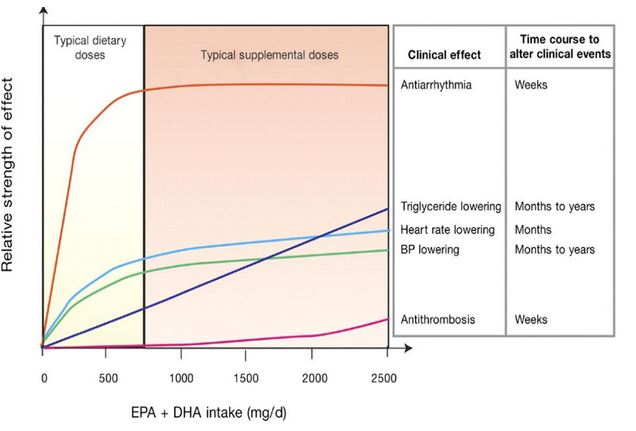
Tout dépend de l’indication pour laquelle vous avez recours à la supplémentation. Une étude parue dans le JAMA en 2007 présente une synthèse utile des effets physiologiques en fonction des doses et des objectifs cardiovasculaires attendus (EPA et DHA confondus)9 :
- En prévention de l’arythmie : un plateau semble apparaître à partir d’un dosage à 700 mg / jour ;
- Pour prévenir l’hypertriglycéridémie : les effets sont proportionnels aux doses, dès 200 mg et jusqu’à 2,5 g par jour. Sur ce point, plusieurs études remettent en question l’intérêt de la supplémentation, argumentant le fait que ce bénéfice serait en réalité consécutif à une atteinte du foie46,47 par excès de peroxydation ;
- La lutte contre l’athérosclérose semblerait nécessiter au moins 1 g, mais deviendrait significative (avec un effet croissant linéaire) à partir de 2 g / jour.
Quantités recommandées en oméga 3 selon les indications cardio-vasculaire9
Dans le cadre de l’optimisation des fonctions cérébrales, les études ayant montré des effets favorables en cas de dépression associée ou non à des troubles bipolaires mentionnent des dosages efficaces de 1 à 2,5 g d’EPA10-13. Une étude met en évidence l’importance d’associer une teneur la plus faible possible en DHA pour maximiser l’effet de réduction de l’inflammation dans le cas de dépression14.
Dans le cadre de troubles neurodégénératifs, de la mémoire ou de déclin cognitifs, les doses recommandées en DHA s’échelonnent de 500 mg à 1500 mg par jour15,16.
En cas de troubles immunitaires ou inflammatoires chroniques, les quantités proposées sont également de 1 à 3 g EPA par jour en fonction de l’indication.
Oméga 3 et prévention cardio-vasculaire, que disent les études récentes ?
Plusieurs méta-analyses montrent une absence d’effets significatifs d’une supplémentation en EPA/DHA sur le plan cardiovasculaire ou chez les diabétiques. Deux d’entre-elles, publiées dans la revue JAMA en 201217 et 201818, le suggèrent. Toutefois, il est important de préciser que la plupart des études concernées considèrent des doses insuffisantes pour obtenir un indice oméga 3 membranaire synonyme de prévention cardiovasculaire, à savoir une quantité supérieure à 1800 mg par jour. Cet indice oméga 3 est pourtant un marqueur particulièrement intéressant et défini depuis plus de dix ans19. Or il n’est généralement pas dosé dans ces études, il s’agit pourtant d’un point essentiel pour déterminer l’efficacité d’une supplémentation. En effet, selon l’état nutritionnel en oméga 3 de la personne, les effets de la supplémentation peuvent apparaître très différents. A titre d’exemple, le risque de maladies cardio-vasculaires est réduit de 30 % lorsque cet indice évolue de 4 à 8 % selon une étude récente20(p3). Par ailleurs, la prévention dans ces méta-analyses était considérée comme non significative par les auteurs bien que l’amélioration était de 7 %. La plupart des études épidémiologiques (NDLR : ayant un poids plus important que les études cliniques menées) montrent, elles, une corrélation positive entre le statut membranaire en EPA/DHA et la prévention des maladies coronariennes. Une autre méta-analyse parue dans JAMA confirmait l’intérêt de consommer du poisson gras 1 à 2 fois par semaine dans le cadre de la prévention cardio-vasculaire, y compris en considérant les contaminants9. La méta-analyse publiée en 2012 dans JAMA a étudié les effets cardioprotecteurs d’une supplémentation en oméga 3 en prévention secondaire, c’est à dire chez les personnes ayant déjà eu une pathologie. Ces résultats ne peuvent donc pas être extrapolés à la population générale. Par ailleurs, les doses utilisées en référence étaient de 1000 mg pendant 1 an, soit un dosage et une durée pouvant être considérés comme insuffisants en cas de prévention secondaire. A l’inverse, une revue de littérature de 2009, incluant plus de 39 000 patients ayant souffert d’accident cardio-vasculaire et soumis à une supplémentation moyenne de 1800 mg pendant plus de 2 ans, a démontré quant à elle un effet protecteur des oméga 321. D’une manière générale, les études ou méta-analyses récentes mettant en évidence l’effet protecteur des oméga 3 en cas de supplémentation à dose suffisante (plus de 1800 mg par jour) sont nombreuses et bien menées21-23.
La stabilité des oméga 3 est LE critère essentiel
Dans ce contexte plutôt positif des effets des oméga 3 sur la prévention cardiovasculaire, se pose légitimement la question de l’intérêt de la supplémentation. Certaines études datant des années 80 montrent une augmentation de la mortalité cardiovasculaire à la suite d’une supplémentation en EPA/DHA sur le long terme. Ces résultats ont toutefois été peu confortés et il s’agit avant tout d’études d’observation et non d’intervention. Plusieurs sont en en cours, intégrant de vastes cohortes. Elles devraient apportées une tendance plus précise (notamment pour des posologies > 4 g/j). Nous parlons bien ici du cas de l’EPA et/ou du DHA et non de l’ALA, car concernant ce dernier, il n’y a aucun élément remettant en question son intérêt.
Les effets délétères d’une supplémentation en oméga 3 sont multiples, notamment un risque majoré de péroxydation lipidique24-26 et une production accrue d’acroléïne, de lipofuscine, de céroïdes, des pigments impliqués dans le vieillissement cellulaire27 et les maladies neurodégénératives28, notamment par manque de vitamine E. En effet, au regard du nombre de doubles liaisons des acides gras poly-insaturés, leur sensibilité à l’oxydation est très importante. Il a été démontré qu’une supplémentation « mobilise » si fortement la vitamine E que cette dernière ne suffit pas à éviter cette peroxydation, y compris lorsque l’on en rajoute dans le complément alimentaire à forte dose (l’effet peut alors être pire, sauf en cas d’utilisation d’extrait de romarin29,30 ou lorsque la supplémentation en EPA/DHA demeure faible). Par ailleurs, le taux d’EPA ou de DHA non oxydé chute alors fortement31.
Plusieurs études ont mis en évidence d’autres effets délétères d’une supplémentation en EPA et DHA sous forme d’huile de poisson, notamment une augmentation des risques d’immunosuppression32-35, d’Alzheimer36, une atteinte du fonctionnement mitochondrial37 et neuronal (notamment par excès d’acroléine), un dysfonctionnement thyroïdien ou encore une augmentation de l’incidence du cancer (notamment de la prostate). C’est là encore une question de bon-sens lorsque l’on connait la modulation de l’EPA sur le métabolisme des prostaglandines, des leucotriènes et des thromboxanes. Par ailleurs, l’EPA et le DHA possèdent des effets pro-oxydatifs évidents lorsque l’oxydation est initiée, majorant de fait les troubles évoqués. C’est donc bien là toute la question : comment réussir à apporter des oméga 3 intègres sans augmenter les risques oxydatifs par lipopéroxydation. Sur ce point, force est de constater qu’au regard des qualités proposées, les compléments alimentaires n’apparaissent pas comme une solution optimale.
Tous ces arguments demeurent recevables, mais ils méritent d’être nuancés. En premier lieu, le statut antioxydant général, donc la qualité de l’alimentation quotidienne, est essentiel. Si la supplémentation est proposée sur un terrain oxydatif (à fortiori si le complément est de mauvaise qualité) et/ou si l’alimentation est pauvre en antioxydants, elle ne peut qu’accentuer les risques de péroxydation. Ce point recentre le débat de fond sur le véritable sujet : l’importance d’optimiser le statut nutritionnel par les aliments, intégrant les nutriments dans une matrice alimentaire, avant toute démarche de supplémentation. Ce statut n’est pourtant généralement pas pris en compte par les études critiquant (dans un sens ou un autre) l’intérêt des oméga 3. Il s’agit pourtant d’un point essentiel source de raccourcis caricaturaux trompeurs dans l’esprit d’un grand nombre, notamment des médias. Les études épidémiologiques ne remettent pas en question l’importance des oméga 3 sous forme alimentaire dans la prévention cardio-vasculaire. Les niveaux d’oxydation apparaissent délétères uniquement dans le cadre d’une consommation de compléments alimentaires et non d’aliments cuits de manière douce. Prenons quelques exemples.
Comment mesure-t-on la péroxydation des oméga 3 ?
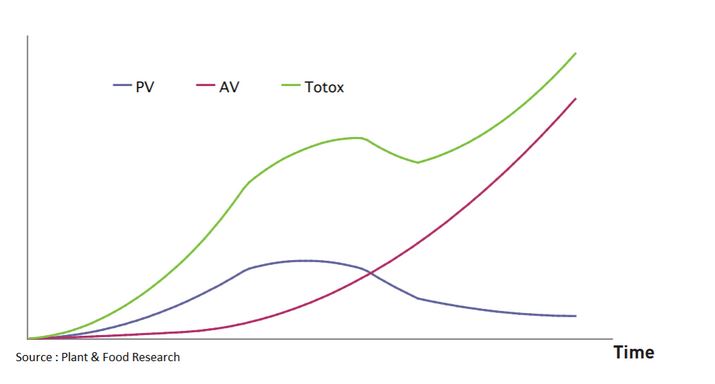
Lorsqu’une graisse s’oxyde, plusieurs composés sont produits, certains sont qualifiés de primaires et d’autres de secondaires.
- Les premiers sont mesurés à travers l’indice de peroxyde (PV, devant être inférieur à 5 meq/kg),
- Les seconds grâce à l’indice d’anisidine (AV devant être inférieur à 20 meq/kg)
- Et l’indice général est qualifié de TOTOX (il correspond à l’addition du double de l’indice de peroxyde et de l’indice d’anisidine, il doit être inférieur à 26 meq/kg).
Cinétique d’oxydation des lipides
Dans le cas du saumon en conserve, le PV moyen est de 2,6 et l’AV de 4,338.
Concernant la sardine en conserve (de métal), le produit demeure stable au cours du temps mais le niveau de péroxydation initiale (PV) apparaît au-dessus de la valeur cible de 5 mg/kg39.
Le maquereau surgelé atteint quant à lui le seuil supérieur de tolérance de péroxydation après un à deux mois de surgélation (-18°C)40, justifiant encore une fois d’éviter de conserver les poissons gras au congélateur pendant de nombreux mois.
La méthode de fumage ne protège pas de la péroxydation elle non plus mais elle ne dépasse pas le seuil considéré comme critique41. Ce résultat est toutefois à nuancer par le fait que le fumage génère des hydrocarbures cancérigènes42.
La cuisson à la vapeur demeure la meilleure solution pour limiter cette péroxydation (dans le cas du saumon, le TOTOX est de 4,4)43.
Le mode de préparation joue également : le fait de hacher la viande permet de réduire l’oxydation par l’action protectrice des autres nutriments, notamment les protéines44.
Bien entendu, l’état de fraîcheur initiale du poisson intervient.
Enfin, l’utilisation d’une marinade à base de végétaux (ou l’adoption d’une alimentation riche en fruits et légumes) semble le meilleur moyen d’éviter cette oxydation, notamment grâce à la présence de composés phénoliques45,46.
Notons que les oméga 3 présents dans les œufs semblent mieux protégés de la péroxydation grâce à la matrice alimentaire31, y compris lorsque l’alimentation des poules est riche en oméga 347. La présence de fer (hème) dans les aliments augmente le risque de péroxydation, comme dans le maquereau par exemple.
Que disent les analyses sur les risques d’oxydation des compléments alimentaires ?
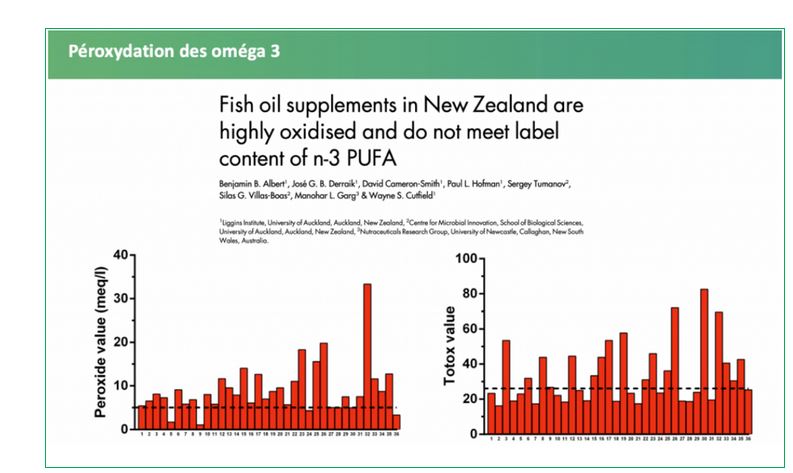
De nombreuses études délivrent un constat sans appel, les compléments alimentaires sont bel et bien oxydés48-53,54, autant en Europe qu’en Amérique du nord :
- Le seuil limite d’indice de peroxyde est dépassé dans la plupart des compléments alimentaires, jusqu’à 93 % dans certains cas. Les seuils de dépassement peuvent atteindre jusqu’à 6 fois la limite maximale et les supplémentations pour enfants apparaissent encore plus touchées51. Ces chiffres sont d’autant plus inquiétants que les tests étaient réalisés bien avant l’atteinte de la date limite de durabilité (DDM)… ce qui sous-entend que le niveau d’oxydation serait bien plus élevé (pour information 22 jours de conservation augmente l’indice de peroxyde de 20 %49). Il ne s’agit pas d’incriminer les industriels à l’origine de la vente de ces produits, toutefois une réglementation plus stricte destinée à encadrer le niveau de péroxydation mériterait d’être instaurée, notamment en réduisant la date de durabilité minimale ;
- Il serait nécessaire de chauffer les huiles au-delà de 225°C pendant 25 minutes pour atteindre des seuils d’oxydation équivalents à ceux des compléments alimentaires…50
La teneur en marqueurs d’oxydation de l’huile de poisson vendue au détail testée par rapport aux seuils internationaux recommandés (lignes pointillées)54.
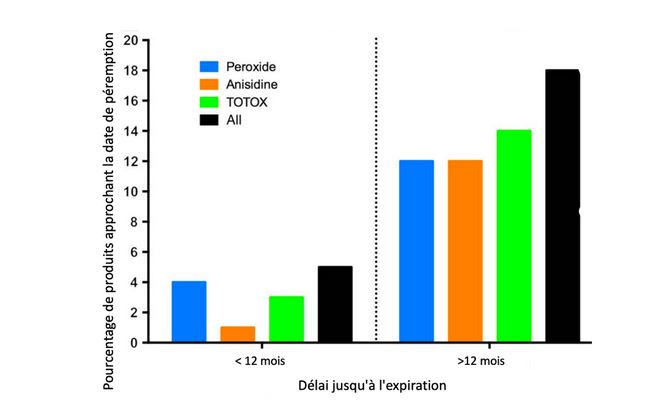
Proportion de produits qui se rapprochent des limites de sécurité en fonction du délai depuis la mise en gélule51.
La solution est-elle de déconseiller totalement les oméga 3 ?
Certains auteurs vont jusqu’à reconsidérer le caractère essentiel des acides gras poly-insaturés. Là aussi, et c’est ce que montrent de nombreuses études concernées, la fonctionnalité de la delta-6-désaturase et le statut en cofacteurs (en particulier en Mg et en vit. B6) déterminent fortement la capacité de l’organisme à fabriquer ses propres acides gras poly-insaturés à partir d’acides gras à chaîne plus courte. Un statut important en acide arachidonique (ce qui est le cas chez la plupart de la population occidentale) vient également moduler le besoin en EPA. En effet, plus les apports en acide arachidonique seront importants, plus ceux en EPA devront l’être également pour maintenir une balance équilibrée. Il est vrai que dans un contexte où le statut nutritionnel serait optimal et l’enzyme fonctionnelle (voir mon article Les oméga 3) la question de la réduction des apports en acides gras poly-insaturés alimentaires apparaîtrait légitime, notamment dans l’objectif de limiter la péroxydation. Or ce n’est pas le cas de la majorité de la population, consommant par ailleurs peu d’antioxydants. Ainsi, dans un cas comme dans l’autre, la situation apparaît délétère.
Je reviens toujours au même point – déterminant – à savoir l’importance de maintenir l’homéostasie en évitant tout excès, dans un sens ou un autre (à savoir ici la supplémentation à long terme et à fort dosage). A noter par ailleurs que l’agence européenne de contrôle réglementaire (EFSA) confirme l’absence de risques de saignements jusqu’à 5 g/j55.
En conclusion
Ces éléments ne remettent à mon sens pas en question l’intérêt d’une supplémentation ponctuelle en cas de déficit identifié, notamment par manque d’apports alimentaires. Si vous y avez recours, je vous recommande :
- De demander au fabricant les résultats d’analyse de péroxydation.
- D’acheter ceux qui sont produits le plus récemment possible.
- De les conserver au congélateur (oui, oui !).
- D’éviter les formes en flacons (au profit des capsules) et/ou aromatisées tout en privilégiant la protection par des extraits végétaux (par exemple romarin).
Une façon très empirique d’évaluer le niveau d’oxydation potentielle peut être de percer une capsule pour la sentir et vérifier qu’elle ne sent pas… le poisson avarié (quand elle n’est pas aromatisée bien sûr). Un tel geste ne garantira pas la faible oxydation de l’huile mais si elle sent mauvais, vous saurez alors qu’il faut la jeter…
Quant à la supplémentation en EPA et DHA à fortes doses sur le long terme, elle peut être discutée, notamment en cas de recours à un complément alimentaire de mauvaise qualité, mais elle ne remet nullement en question l’importance du statut membranaire en EPA/DHA. Or ce statut est dépendant de la prédisposition individuelle, de la fonctionnalité de la delta 6 désaturase, de l’apport conjoint d’acide arachidonique, donc de l’alimentation, y compris des apports glucidiques. C’est pourquoi réaliser un profil en acides gras membranaires doit permettre d’orienter la prise de décision quant à l’intérêt d’une supplémentation en EPA/DHA, notamment dans le cadre d’une indication cardiovasculaire, en accompagnement de cancer, de troubles immunitaires, inflammatoires ou de la thyroïde. Un bilan de stress oxydatif peut également préciser le « terrain » et donc les risques de péroxydation. Certains vont jusqu’à remettre en question l’intérêt général des oméga 3 à longue chaîne, ce n’est à ce jour pas ma position, encore moins concernant la forme végétale alimentaire (acide alpha-linolénique ou ALA). Cette dernière a en effet bien démontré son effet protecteur et sa moindre sensibilité oxydative, notamment dans le cadre d’une alimentation de type méditerranéen. Pour autant, à peine 1 % de la population française en consomme suffisamment56. Le reste nous amène dans des réflexions physiologiques, biochimiques, conceptuelles (et commerciales ?) que nous ne maîtrisons pas, tant tout est interdépendant. Nous tombons alors, via ces conclusions d’études, dans les mêmes travers que le raisonnement allopathique. Conservons notre humilité.
Anthony Berthou
Sources :
- Breivik H, Haraldsson GG, Kristinsson B. Preparation of highly purified concentrates of eicosapentaenoic acid and docosahexaenoic acid. J Amer Oil Chem Soc. 1997;74(11):1425-1429. doi:10.1007/s11746-997-0248-0
- Burri L, Hoem N, Banni S, Berge K. Marine Omega-3 Phospholipids: Metabolism and Biological Activities. Int J Mol Sci. 2012;13(11):15401-15419. doi:10.3390/ijms131115401
- Ulven SM, Holven KB. Comparison of bioavailability of krill oil versus fish oil and health effect. Vasc Health Risk Manag. 2015;11:511-524. doi:10.2147/VHRM.S85165
- Schuchardt JP, Schneider I, Meyer H, Neubronner J, von Schacky C, Hahn A. Incorporation of EPA and DHA into plasma phospholipids in response to different omega-3 fatty acid formulations–a comparative bioavailability study of fish oil vs. krill oil. Lipids Health Dis. 2011;10:145. doi:10.1186/1476-511X-10-145
- Kato-Kataoka A, Sakai M, Ebina R, Nonaka C, Asano T, Miyamori T. Soybean-Derived Phosphatidylserine Improves Memory Function of the Elderly Japanese Subjects with Memory Complaints. J Clin Biochem Nutr. 2010;47(3):246-255. doi:10.3164/jcbn.10-62
- Neubronner J, Schuchardt JP, Kressel G, Merkel M, von Schacky C, Hahn A. Enhanced increase of omega-3 index in response to long-term n-3 fatty acid supplementation from triacylglycerides versus ethyl esters. Eur J Clin Nutr. 2011;65(2):247-254. doi:10.1038/ejcn.2010.239
- West AL, Burdge GC, Calder PC. Lipid structure does not modify incorporation of EPA and DHA into blood lipids in healthy adults: a randomised-controlled trial. Br J Nutr. 2016;116(5):788-797. doi:10.1017/S0007114516002713
- Levine KE, Levine MA, Weber FX, Hu Y, Perlmutter J, Grohse PM. Determination of Mercury in an Assortment of Dietary Supplements Using an Inexpensive Combustion Atomic Absorption Spectrometry Technique. J Autom Methods Manag Chem. 2005;2005(4):211-216. doi:10.1155/JAMMC.2005.211
- Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA. 2006;296(15):1885-1899. doi:10.1001/jama.296.15.1885
- Jazayeri S, Tehrani-Doost M, Keshavarz SA, et al. Comparison of therapeutic effects of omega-3 fatty acid eicosapentaenoic acid and fluoxetine, separately and in combination, in major depressive disorder. Aust N Z J Psychiatry. 2008;42(3):192-198. doi:10.1080/00048670701827275
- Lespérance F, Frasure-Smith N, St-André E, Turecki G, Lespérance P, Wisniewski SR. The efficacy of omega-3 supplementation for major depression: a randomized controlled trial. J Clin Psychiatry. 2011;72(8):1054-1062. doi:10.4088/JCP.10m05966blu
- Noaghiul S, Hibbeln JR. Cross-national comparisons of seafood consumption and rates of bipolar disorders. Am J Psychiatry. 2003;160(12):2222-2227. doi:10.1176/appi.ajp.160.12.2222
- Peet M, Horrobin DF. A dose-ranging study of the effects of ethyl-eicosapentaenoate in patients with ongoing depression despite apparently adequate treatment with standard drugs. Arch Gen Psychiatry. 2002;59(10):913-919.
- Logan AC. Omega-3 fatty acids and major depression: a primer for the mental health professional. Lipids Health Dis. 2004;3:25. doi:10.1186/1476-511X-3-25
- Bauer I, Hughes M, Rowsell R, et al. Omega-3 supplementation improves cognition and modifies brain activation in young adults. Hum Psychopharmacol. 2014;29(2):133-144. doi:10.1002/hup.2379
- Narendran R, Frankle WG, Mason NS, Muldoon MF, Moghaddam B. Improved working memory but no effect on striatal vesicular monoamine transporter type 2 after omega-3 polyunsaturated fatty acid supplementation. PLoS ONE. 2012;7(10):e46832. doi:10.1371/journal.pone.0046832
- Rizos EC, Ntzani EE, Bika E, Kostapanos MS, Elisaf MS. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA. 2012;308(10):1024-1033. doi:10.1001/2012.jama.11374
- Aung T, Halsey J, Kromhout D, et al. Associations of Omega-3 Fatty Acid Supplement Use With Cardiovascular Disease Risks: Meta-analysis of 10 Trials Involving 77 917 Individuals. JAMA Cardiol. 2018;3(3):225-234. doi:10.1001/jamacardio.2017.5205
- von Schacky C, Harris WS. Cardiovascular risk and the omega-3 index. J Cardiovasc Med (Hagerstown). 2007;8 Suppl 1:S46-49. doi:10.2459/01.JCM.0000289273.87803.87
- Harris WS, Del Gobbo L, Tintle NL. The Omega-3 Index and relative risk for coronary heart disease mortality: Estimation from 10 cohort studies. Atherosclerosis. 2017;262:51-54. doi:10.1016/j.atherosclerosis.2017.05.007
- Marik PE, Varon J. Omega-3 dietary supplements and the risk of cardiovascular events: a systematic review. Clin Cardiol. 2009;32(7):365-372. doi:10.1002/clc.20604
- Tenenbaum A, Fisman EZ. Omega-3 polyunsaturated fatty acids supplementation in patients with diabetes and cardiovascular disease risk: does dose really matter? Cardiovasc Diabetol. 2018;17. doi:10.1186/s12933-018-0766-0
- Alexander DD, Miller PE, Van Elswyk ME, Kuratko CN, Bylsma LC. A Meta-Analysis of Randomized Controlled Trials and Prospective Cohort Studies of Eicosapentaenoic and Docosahexaenoic Long-Chain Omega-3 Fatty Acids and Coronary Heart Disease Risk. Mayo Clin Proc. 2017;92(1):15-29. doi:10.1016/j.mayocp.2016.10.018
- Chan PH, Fishman RA. Altérations de l’intégrité de la membrane et des constituants cellulaires par l’acide arachidonique dans les cellules de neuroblastome et de gliome. Published online September 23, 1982.
- Bate C, Reid S, Williams A. Les inhibiteurs de la phospholipase A2 ou les antagonistes du facteur d’activation plaquettaire empêchent la réplication du prion. 2001;J Neurosci Res:65 (6): 565-72.
- Klein A, Lishner M, Bruser B, Curtis JE, Amato DJ, Malkin A. Cortisol catabolism by lymphocytes of patients with chronic lymphocytic leukemia. Biochem Cell Biol. 1990;68(4):810-813.
- Richter T, Munch G, Luth HJ, Arendt T, R Kientsch-Engel, Stahl P, Fengler D, Kuhla B. Réactivité immunochimique d’anticorps spécifiques de “produits de glycation avancée” avec des “produits de lipoxydation avancés.” 2005;Neurobiol vieillissement:26 (4): 465-74.
- Lovell MA, Xie C, Markesbery WR. L’acroléine, produit de la peroxydation des lipides, inhibe l’absorption du glucose et du glutamate dans les cultures neuronales primaires. 2000;Biol Med:29 (8): 714-20.
- Sydenham E, Dangour AD, Lim W-S. Omega 3 fatty acid for the prevention of cognitive decline and dementia. Cochrane Database Syst Rev. 2012;(6):CD005379. doi:10.1002/14651858.CD005379.pub3
- O’Sullivan A, Mayr A, Shaw NB, Murphy SC, Kerry JP. Use of Natural Antioxidants to Stabilize Fish Oil Systems. Journal of Aquatic Food Product Technology. 2005;14(3):75-94. doi:10.1300/J030v14n03_06
- Cillard J, Cillard P. Mécanismes de la peroxydation lipidique et des anti-oxydations. 2006;Ol Corps Gras Lipides:13(1):24?9.
- Switzer KC, McMurray DN, Morris JS, Chapkin RS. (n-3) Polyunsaturated fatty acids promote activation-induced cell death in murine T lymphocytes. J Nutr. 2003;133(2):496-503. doi:10.1093/jn/133.2.496
- Klein A, Bruser B, Robinson JB, Pinkerton PH, Malkin A. Effect of a non-viral fraction of acquired immunodeficiency syndrome plasma on the vulnerability of lymphocytes to cortisol. J Endocrinol. 1987;112(2):259-264.
- Klein A, Bruser B, Malkin A. The effect of fatty acids on the vulnerability of lymphocytes to cortisol. Metab Clin Exp. 1989;38(3):278-281.
- Klein A, Bruser B, Malkin A. Albumin and the unique pattern of inhibitors of cortisol catabolism by lymphocytes in serum of cancer patients. Tumour Biol. 1989;10(3):149-152.
- Lovell MA, Xie C, Markesbery WR. Acrolein, a product of lipid peroxidation, inhibits glucose and glutamate uptake in primary neuronal cultures. Free Radic Biol Med. 2000;29(8):714-720.
- Hillered L, Chan PH. Role of arachidonic acid and other free fatty acids in mitochondrial dysfunction in brain ischemia. J Neurosci Res. 1988;20(4):451-456. doi:10.1002/jnr.490200407
- Ortiz J, Vivanco JP, Aubourg SP. Lipid and sensory quality of canned Atlantic salmon (Salmo salar): Effect of the use of different seaweed extracts as covering liquids. European Journal of Lipid Science and Technology. 2014;116(5):596-605. doi:10.1002/ejlt.201300239
- Selmi S, Monser L, Sadok S. The Influence of Local Canning Process and Storage on Pelagic Fish from Tunisia: Fatty Acid Profiles and Quality Indicators. Journal of Food Processing and Preservation. 2008;32(3):443-457. doi:10.1111/j.1745-4549.2008.00189.x
- Nazemroaya S, Sahari MA, Rezaei M. Effect of frozen storage on fatty acid composition and changes in lipid content of Scomberomorus commersoni and Carcharhinus dussumieri. Journal of Applied Ichthyology. 2009;25(1):91-95. doi:10.1111/j.1439-0426.2008.01176.x
- I K, C N, Z.e S, A K. Lipid oxidation and lysine availability in Atlantic mackerel hot smoked in mild conditions. Bulletin of the Sea Fisheries Institute. 2004;(1). Accessed January 18, 2019. http://agro.icm.edu.pl/agro/element/bwmeta1.element.agro-article-87e4cbf9-edb6-4c1c-8339-0268d4704935
- Stoyhwo A, Sikorski ZE. Polycyclic aromatic hydrocarbons in smoked fish – a critical review. 2005;Food Chem.:91(2):303?11.
- Effects of different cooking procedures on lipid quality and cholesterol oxidation of farmed salmon fish (Salmo salar). – PubMed – NCBI. Accessed January 17, 2019. https://www.ncbi.nlm.nih.gov/pubmed/15291510
- Domiszewski Z. Effect of heating fatty fish: Baltic herring (Clupea harengus membras), European sprat (Sprattus sprattus) and rainbow trout (Oncorhynchus mykiss) on lipid oxidation and contents of eicosapentaenoic and docosahexaenoic acids. 2013;nt J Food Sci Technol:;48(4):786/93.
- Halliwell B, Zhao K, Whiteman M. The gastrointestinal tract: a major site of antioxidant action? Free Radic Res. 2000;33(6):819-830.
- Lapidot T, Granit R, Kanner J. Lipid hydroperoxidase activity of myoglobin and phenolic antioxidants in simulated gastric fluid. J Agric Food Chem. 2005;53(9):3391-3396. doi:10.1021/jf040400w
- Botsoglou E, Govaris A, Fletouris D, Botsoglou N. Lipid oxidation of stored eggs enriched with very long chain n-3 fatty acids, as affected by dietary olive leaves (Olea europea L.) or α-tocopheryl acetate supplementation. Food Chem. 2012;134(2):1059-1068. doi:10.1016/j.foodchem.2012.03.014
- Oksidasjonsnivå i marine omega-3 produkter tilgjengelig for norske forbrukere. Accessed January 17, 2019. https://oda.hioa.no/nb/oksidasjonsniva-i-marine-omega-3-produkter-tilgjengelig-for-norske-forbrukere
- Omega-3 LC PUFA Contents and Oxidative Stability of Encapsulated Fish Oil Dietary Supplements: International Journal of Food Properties: Vol 13, No 3. Accessed January 17, 2019. https://www.tandfonline.com/doi/abs/10.1080/10942910802652222
- Halvorsen BL, Blomhoff R. Determination of lipid oxidation products in vegetable oils and marine omega-3 supplements. Food Nutr Res. 2011;55. doi:10.3402/fnr.v55i0.5792
- Jackowski SA, Alvi AZ, Mirajkar A, et al. Oxidation levels of North American over-the-counter n-3 (omega-3) supplements and the influence of supplement formulation and delivery form on evaluating oxidative safety. J Nutr Sci. 2015;4:e30. doi:10.1017/jns.2015.21
- Ritter JCS, Budge SM, Jovica F. Quality analysis of commercial fish oil preparations. J Sci Food Agric. 2013;93(8):1935-1939. doi:10.1002/jsfa.5994
- Opperman M, Benade S. Analysis of the omega-3 fatty acid content of South African fish oil supplements: a follow-up study. Cardiovasc J Afr. 2013;24(8):297-302. doi:10.5830/CVJA-2013-074
- Albert BB, Derraik JGB, Cameron-Smith D, et al. Fish oil supplements in New Zealand are highly oxidised and do not meet label content of n-3 PUFA. Sci Rep. 2015;5:7928. doi:10.1038/srep07928
- Scientific Opinion on Dietary Reference Values for cobalamin (vitamin B12). EFSA Journal. 2015;13(7):4150. doi:10.2903/j.efsa.2015.4150
- Tressou-Cosmao J, Pasteau S, Le Guillou C, Simon N. Analyse des apports nutritionnels en acides gras de la population française à partir des données INCA 2. 2015;Onidol.