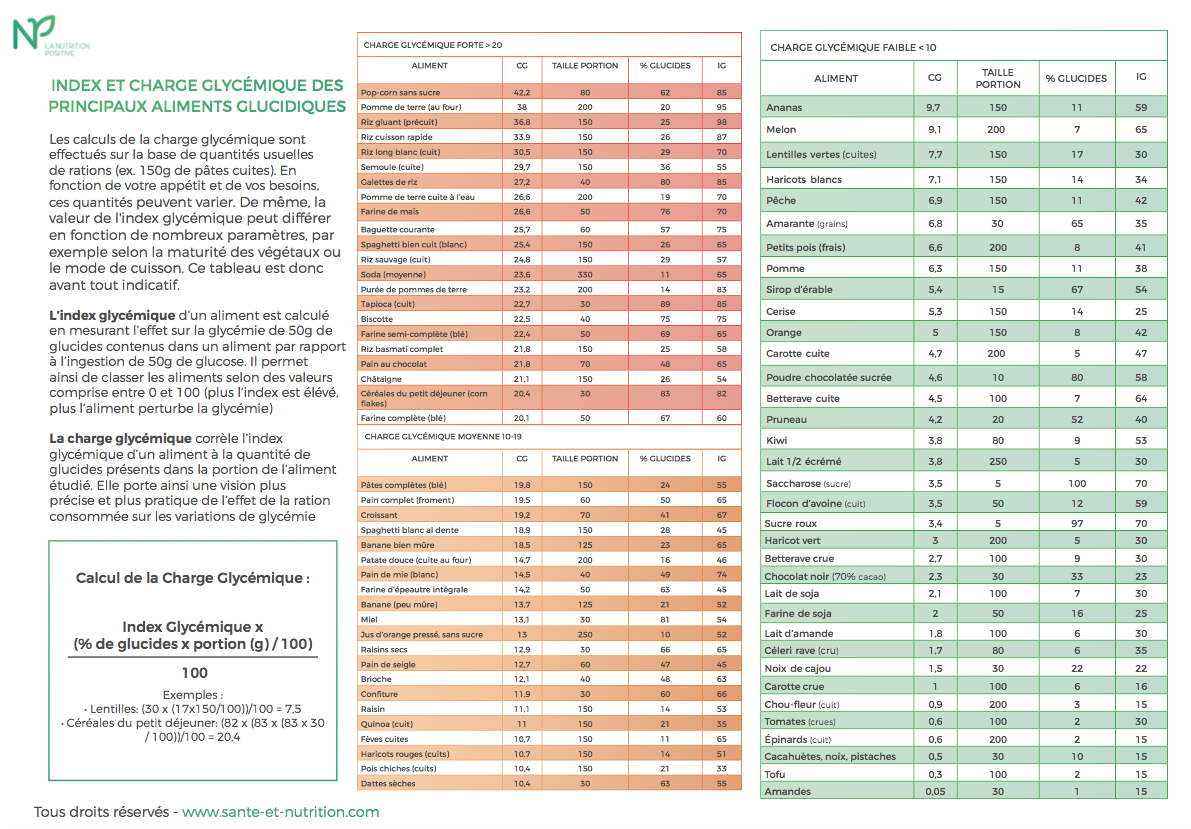
J’ai développé dans un article général sur l’index et la charge glycémique toute l’importance de veiller à la qualité des glucides consommés au quotidien dans un objectif précis : réguler la sécrétion d’une hormone au cœur de votre santé, l’insuline. J’y ai notamment détaillé les notions d’index et de charge glycémique très utiles pour vous guider dans vos choix alimentaires. Pour rappel, plus la charge glycémique de votre repas est faible, mieux vous contrôlez votre sécrétion d’insuline. Si vous ne l’avez pas lu, je vous invite à en prendre connaissance pour bien comprendre ces notions fondamentales. La bonne régulation de votre glycémie est en effet déterminante. Une glycémie stable au cours de la journée procure de nombreux bénéfices, en particulier le matin. Votre concentration et vos performances intellectuelles sont alors optimales, votre vitalité physique est régulière, votre satiété est prolongée et les envies de grignotages fortement diminuées. À long terme, vous contrôlez votre poids de forme, voire vous facilitez l’amincissement si tel est votre objectif, et surtout, vos cellules conservent une forte sensibilité à l’insuline.
A quoi sert l’insuline ?
L’insuline est au carrefour de nombreuses voies métaboliques et peut être considérée comme l’hormone du stockage. C’est elle qui vous permet de stocker dans vos muscles et dans votre foie le glucose dans le sang lorsqu’il est présent en trop grande quantité (cas d’une hyperglycémie) tout en empêchant votre organisme d’utiliser les graisses comme source d’énergie. Si vos réserves de glycogène sont déjà pleines, soit parce que vous consommez trop de glucides dans la journée, soit parce que vous ne réalisez pas assez d’activité physique pour le brûler en énergie, il va bien falloir loger cet excès de glucides quelque part. Votre foie va alors le transformer en… graisses ! Plus précisément, il fabrique des triglycérides qui vont se stocker dans les adipocytes (vos cellules graisseuses).
Ainsi, si vous souhaitez prendre du poids, rien de tel donc que d’associer les graisses et les aliments insulino-secréteurs dans votre assiette. Ce qui s’avère le cas quand vous consommez des pâtisseries, des pizzas, des frites, des biscuits, des barres chocolatées, un croissant, une viande grasse avec des pommes de terre ou encore des pâtes à la carbonara. Si cette situation se multiplie au cours des mois et des années, vos cellules vont alors s’adapter en devenant de plus en plus résistantes à l’insuline, votre pancréas va devoir travailler davantage pour obtenir le même effet, vos cellules résistent encore plus, etc. C’est le début de l’insulino-résistance pouvant mener au diabète de type II, à l’obésité voire aux pathologies inflammatoires chroniques. Pour faire simple, moins vous sécrétez d’insuline à la suite d’un repas, mieux vous préservez votre bien-être et votre santé à long terme. À noter qu’il existe de rares situations au cours desquelles il est intéressant de secréter beaucoup d’insuline, après un effort physique pour optimiser la récupération par exemple.
Mes clés pratiques pour optimiser votre glycémie au quotidien
Privilégier les aliments glucidiques à faible charge glycémique
- Faites la part-belle aux légumineuses (si vous les tolérez) : lentilles, fèves, haricots secs, pois chiches, pois cassés, soja. Bien veiller à les faire tremper avant cuisson ;
- Produits céréaliers complets, pseudo-céréales et tubercules, bio : quinoa et riz basmati (bien les rincer avant cuisson), patate douce, épeautre ou petit-épeautre et tous les dérivés fabriqués à partir de farines complètes de ces céréales (pâtes, gâteaux, etc.) si vous tolérez le gluten ;
- Pour les consommateurs de pain : du pain au levain et à fermentation longue, à base de farine complète ou semi-complète d’épeautre ou petit-épeautre, aux céréales, de seigle, de sarrasin… Le pain demeure un aliment riche en glucides et son index glycémique est moyen à élevé en fonction de sa nature, il demeure donc à consommer avec modération. De même, selon le niveau de sensibilité au gluten, privilégier des farines en contenant peu ou pas.
Pas un repas sans légumes
C’est une base essentielle pour vous apporter les fibres et les antioxydants nécessaires à la réduction de l’effet hyperglycémiant des aliments glucidiques que vous consommez au cours du repas.
Cuire modérément les aliments
Privilégiez les aliments cuits à la vapeur, Al dente ou croquants.
Éviter les aliments glucidiques à index glycémique élevé, surtout en dehors des repas
Pain blanc, pâtes blanches, riz blanc, biscottes, galettes de riz ou céréales soufflées (crackers de sarrasin compris), confiture, sucre, sodas (y compris light), jus de fruits, bonbons, pommes de terre en purée instantanée, biscuits et pâtisseries.
Préférer les fruits aux jus de fruits, y compris maison ou 100 % pur jus
Vous consommeriez en effet le sucre du fruit, sans ses fibres… or ce sont elles qui permettent de réduire la vitesse d’assimilation des sucres naturellement présents. De récentes études mettent en évidence que la consommation de fruits exerce un effet bénéfique dans la prévention du diabète, à l’inverse des jus de fruits 1, 2.
Privilégier un petit déjeuner riche en protéines et en graisses de qualité, au détriment des aliments glucidiques
Je vous invite à vous référer à la composition du petit-déjeuner dans la seconde partie du livret et à surveiller vos apports en glucides au cours de ce repas (pas plus d’un fruit, max. 20 à 30 g de flocons de céréales ou 1 à 2 tranches de pain, éviter la confiture, le miel et les jus de fruits). Comme évoqué et contrairement aux idées reçues, vous pouvez tout à fait opter pour un petit déjeuner sans céréales dès lors que celui contient suffisamment de protéines, de fibres et de graisses de qualité.
Privilégier également un déjeuner à dominante de protéines et de légumes
Idéalement sans féculents, ou à index glycémique faible et en petites quantités en cas de faim importante ou après un entraînement sportif (légumineuses, riz basmati complet, patate douce, quinoa), toujours avec des légumes.
Adopter une alimentation végétarienne en fin de journée
- La collation vers 16 h est un bon moment pour consommer un aliment sucré (de qualité) à index glycémique moyen ou faible et surtout vous éviter les hypoglycémies de fin de journée. Par exemple un fruit avec une petite poignée d’oléagineux et pourquoi pas un ou deux carrés de bon chocolat noir riche en cacao si vous l’aimez.
- Au dîner, faire la part-belle aux légumineuses
Apprendre à vous déshabituer du goût sucré
Il ne s’agit pas de supprimer totalement le sucre si vous souhaitez absolument en conserver, mais la saveur sucrée créé une véritable dépendance : Le sucre appelle le sucre. Celui-ci permet d’ailleurs à certains de s’apaiser ponctuellement en cas de stress… avant de favoriser les variations d’humeur du fait de la perturbation de la glycémie et de donner à nouveau envie de consommer… du sucre. C’est un véritable cercle vicieux.
Même s’il est naturel et riche de nombreuses propriétés, le miel demeure un aliment à index glycémique relativement élevé à consommer modérément (plus il est foncé et liquide, plus son index glycémique est faible), de même que le sirop d’érable ou que les formes complètes de sucre (rapadura par exemple). Je vous déconseille le fructose en poudre qui favorise l’insulino-résistance à long terme et l’accumulation de graisses dans le foie (stéatose), de même que les sirops d’agave qui s’avèrent par ailleurs souvent de mauvaise qualité. Le sucre de coco possède un index glycémique moyen.
Les édulcorants, la solution ?
Les édulcorants (tous) entretiennent fortement l’attrait pour la saveur sucrée, font souvent consommer davantage l’aliment qui en contient et augmentent surtout l’insulino-résistance à long terme, tout en altérant la diversité de votre microbiote 3,4. Autant dire que vous ne retirerez aucun bénéfice à leur consommation. Rien de tel que de profiter avec modération du sucre naturellement présent dans les aliments, les fruits par exemple, et de réserver la consommation de sucre ajouté à des occasions, en conscience. Vous constaterez vite à quel point on peut se déshabituer du goût très sucré insidieusement entretenu par la plupart des produits transformés, avec à la clé vitalité et forme générale !
Bouger, bouger, bouger !
Un des nombreux bienfaits de l’activité physique régulière est d’optimiser la sensibilité de vos cellules à l’insuline. En effet, toujours selon ce principe d’adaptation, lorsque vous réalisez régulièrement un effort musculaire, vous épuisez en partie vos réserves de glycogène pour fabriquer de l’énergie, de manière variable en fonction de l’intensité et de la durée de cet effort. Vos muscles ont donc besoin de capter plus facilement le glucose présent dans votre sang pour reconstituer ses réserves. Les récepteurs cellulaires à l’insuline, que l’on nomme les GLUT (en particulier le GLUT4), deviennent alors plus efficaces et plus nombreux sous l’effet de la répétition des efforts au fil des mois.Vos cellules deviennent ainsi plus performantes. Pratiquer une activité régulière est donc un des meilleurs moyens de vous prévenir du diabète 5-9.
Pratiquer une activité de gestion des émotions
Il a été montré que la méditation a des effets comparables à l’activité physique sur le stress. En revanche, l’exercice physique reste plus efficace pour diminuer la glycémie 10-17. L’efficacité combinée de l’acupression, de l’hypnose et de la méditation ont également été démontrées sur la diminution de la glycémie 18, 19.
Les minéraux impliqués dans la régulation de la glycémie ?
Un déficit dans certains micronutriments peut altérer la réponse à l’insuline en cas de résistance à l’insuline, de difficulté d’amaigrissement voire de diabète. Ces conseils demeurent informatifs et ne considèrent pas votre situation personnelle ; je vous invite à demander conseil au préalable à votre professionnel de santé formé à la micronutrition pour adapter ces informations, surtout si vous êtes diabétique.
Le Zinc
Le Zinc est indispensable pour permettre aux protéines de l’organisme d’assurer leurs fonctions. L’insuline étant une hormone, donc formée à partir de protéines, le rôle du zinc est particulièrement important pour optimiser son bon fonctionnement. Un statut adapté est par ailleurs nécessaire pour limiter les effets d’un déficit sur les risques de complications liées au diabète 20. Vous retrouverez tous mes conseils pour optimiser vos apports dans le chapitre dédié.
Le Magnésium
Le Magnésium est impliqué dans la régulation du métabolisme du glucose et de l’insuline 21. Une carence peut augmenter la résistance à l’insuline, voire les risques de diabète de type 2 22 alors qu’un statut optimal favorise l’insulino-sensibilité 23, 24.
La vitamine D
Un statut optimal en vitamine D est nécessaire en prévention du diabète de type 2 25. En effet, les personnes présentant des taux de vitamine D élevés ont un risque de survenue de diabète plus faible. 26. Le déficit en vitamine D est d’ailleurs fréquent chez les patients atteints de diabète de type 2 27. Une relation inverse entre le taux de vitamine D et le taux d’hémoglobine glyquée est de plus constatée chez les personnes diabétiques.
Faire la part-belle aux antioxydants
La glycation (ou glycosylation non enzymatique) est une réaction chimique entre un sucre (le glucose ou le fructose) et un acide aminé (la lysine) se déroulant spontanément en cas de concentration importante en glucose. La même réaction se déroule lorsque vous faites cuire des aliments à haute température, comme lors de la caramélisation, nous avons eu l’occasion d’en développer le mécanisme. Une des conséquences de l’excès de glucose dans le sang est justement cette glycation, à l’origine d’un vieillissement accéléré et d’une perte des fonctions protéiques. On dose d’ailleurs les taux sanguins d’hémoglobine glyquée dans le cadre du suivi du diabète. Certains nutriments permettent de lutter contre les effets de cette glycation et du stress oxydatif en résultant, en particulier :
- La cannelle
Des patients atteints diabète de type 2 ont consommé l’équivalent de 3 g d’extraits de cannelle et ont constaté une diminution de leur glycémie à jeun de 10,3 % 28. Une autre étude a montré que la cannelle au même dosage améliore également la sensibilité à l’insuline 29, 30.
- La carnosine
La carnosine est une molécule naturellement présente dans les muscles et le cerveau, elle est produite à partir de deux acides aminés. Au-delà de son rôle de protection des neurones, la carnosine a démontré un effet positif pour limiter la glycation en se « sacrifiant » pour protéger les autres protéines. Une étude sur des patients diabétiques de type 2 ayant consommé 2 fois 500 mg de L-carnosine par jour pendant 12 semaines a montré une diminution significative de la glycémie et de l’hémoglobine glyquée 31. Il est alors nécessaire de consommer au moins 250 mg de carnosine, de 1 à 3 fois par jour.
- Le Sélénium
Il s’agit d’un antioxydant indispensable aux mécanismes de protection enzymatique contre le stress oxydatif (c’est un cofacteur de la glutathion péroxydase), particulièrement bénéfique pour lutter contre les effets des variations chroniques de glycémie. Plus le statut en sélénium est optimal, plus le risque de développer un diabète de type 2 est faible (diminution du risque pouvant atteindre 24 %). Il est important de privilégier les sources alimentaires de sélénium : les céréales complètes, les poissons et les noix du Brésil 32. Les dosages conseillés sont de 55 à 60 μg/jour (jusqu’à 300 μg/jour)
- Le resvératrol
Il s’agit d’un antioxydant devenu célèbre par sa présence importante dans le vin rouge. Le resvératrol est un composé végétal issu de la peau du raisin, naturellement produit par la vigne pour se défendre contre un champignon, le Botrytis. Selon plusieurs études menées chez le vers et les mouches drosophiles, le resvératrol activerait certains gènes (SIRT-1) impliqués dans la longévité (cette dernière avait alors augmenté de 20 %). Il permettrait notamment d’améliorer le contrôle glycémique et de réduire la résistance à l’insuline 33, 34. Administré à la dose de 500mg 3 fois par jour pendant 90 jours, le trans-resvératrol a induit une diminution de la sécrétion d’insuline chez les patients traités contre le diabète 35. Dans une autre étude, l’effet d’une administration de resvératrol à 250 mg par jour pendant 3 mois chez des patients recevant un traitement hypoglycémiant oral a montré une amélioration du taux d’hémoglobine glyquée et donc du contrôle glycémique 36. De même certaines études ont montré des effets positifs sur la gestion du poids et sur la prévention cardio-vasculaire en régulant la cholestérolémie et le taux de triglycérides sanguins 37. Toutefois, ces résultats ont été démentis par une étude plus récente 38. Au contraire, une autre étude menée dans le Chianti en Italie a mis en évidence une augmentation de 20 % des risques de mortalité entre les personnes consommant le plus de resvératrol comparativement à ceux en consommant le moins 39. Les dosages utilisés évaluent entre 200 et 600 mg par jour de trans-resvératrol.
- La curcumine
La consommation d’1,5 g de curcumine (soit un dosage important, bien supérieur aux quantités usuelles consommées), a engendré une meilleure sensibilité à l’insuline chez des patients diabétiques 40.
D’une manière générale, la consommation d’une alimentation riche en végétaux frais de saison et cuits à chaleur douce contribue à prévenir des effets possibles d’une insulino-résistance voire du diabète. La consommation de 2 à 3 portions (100g) de légumes et de 2 portions de fruits par jour est associée à un risque plus faible de survenue de diabète de type 2 41. La présence de polyphénols dans les aliments peuvent en effet réduire leur index glycémique (voir chapitre dédié)
- Le sarrasin
Le sarrasin contient des composés spécifiques, le D-chirio-inositol de la famille des fagopyritols, ayant démontré des effets bénéfiques (chez le rat) sur la régulation de la glycémie 42. Il contient par ailleurs une quantité importante de fibres solubles, dont la pectine, reconnues pour leur impact positif en cas de diabète de type 2 43. Enfin, les grains entiers cuits de sarrasin sont composés d’environ 10 % d’amidon résistant après cuisson (35 % quand ils sont crus et environ 5 % sous forme de farine), à savoir une forme d’amidon peu assimilée par le système digestif et réduisant l’impact glycémique du repas 44.
La Berbérine plus efficace que les médicaments ?
La Berbérine, issue de l’épine-vinette, est riche en composés alcaloïdes ayant démontré des effets bénéfiques sur la réduction du pic glycémique après ingestion d’un repas (500 mg par repas), de manière similaire à un traitement médicamenteux à base de Metformine, une molécule proposée dans le cadre du traitement du diabète 45-47.
Pratiquer le jeûne intermittent
Une récente étude parue dans la revue prestigieuse Cell en Février 2017 a mis en évidence un effet bénéfique du jeûne intermittent (4 jours par semaine) sur l’induction de gênes responsables de la synthèse de nouvelles protéines contenues dans les cellules produisant l’insuline 48. Ce qui soulève le débat de la potentielle réversibilité du diabète. D’une manière générale, les études évoquant un effet bénéfique du jeûne intermittent sur le diabète sont nombreuses 49-52.
Anthony Berthou
Sources :
- Isao Muraki et al., Fruit consumption and risk of type 2 diabetes : results from three prospective longitudinal cohort studies. BMJ 2013; 347
- Eshak ES, Iso H, Mizoue T, Inoue M, Noda M, Tsugane S. Soft drink, 100% fruit juice, and vegetable juice intakes and risk of diabetes mellitus. Clin Nutr. 2013 Apr;32(2):300-8.
- Suez J. & al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature. 2014 Oct 9;514(7521):181-6.
- Rodriguez-Palacios Alexander et al., The Artificial Sweetener Splenda Promotes Gut Proteobacteria, Dysbiosis, and Myeloperoxidase Reactivity in Crohn’s Disease–Like Ileitis Inflammatory Bowel Diseases. 2018 Apr 23;24(5):1005-1020.
- Sigal RJ, Kenny GP, Boulé NG, Wells GA, Prud’homme D, For er M, Reid RD, Tulloch H, Coyle D, Phillips P, Jennings A, Ja ey J. Effects of aerobic training, resistance training, or both on glycemic control in type 2 diabetes: a randomized trial. Ann Intern Med 2007;147:357–69.
- Miriam Reiner, Chris na Niermann, Darko Jekauc, and Alexander Woll – Long-term health benefits of physical activity – a systematic review of longitudinal studies – BMC Public Health. 2013; 13: 813.
- Thomas DE, Ellio EJ, Naughton GA. Exercise for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2006 Jul 19;(3):CD002968.
- Hawley JA – Exercise as a therapeutic intervention for the prevetion and treatment of insulin- resistance. Diabetes Metab Res Rev. 2004 Sep-Oct;20(5):383-93.
- Umpierre D, Ribeiro PA, Kramer CK, Leitão CB, Zuca AT, Azevedo MJ, Gross JL, Ribeiro JP, Schaan BD. Physical activity advice only or structured exercise training and assocition with HbA1c levels in type 2 diabetes: a systematic review and meta-analysis. JAMA. 2011 May 4;305(17):1790-9.
- Edwards MK, Loprinzi PD, Comparative effects of meditation and exercise on physical and psychosocial health outcomes : a review of randomized controlled trials, Postgrad Med, 2017 Nov :27 :1-7).
- Sigal RJ, Kenny G, Oh P, Perkins BA, Plotnikoff RC, Prud’homme D et collab. Physical Activity/Exercise and Type 2 Diabetes. A consensus statement from the American Diabetes Association. DiabetesCare 2006 Jun; 29(6): 1433-1438.
- Miriam Reiner, Chris na Niermann, Darko Jekauc, and Alexander Woll – Long-term health benefi ts of physical activity – a systematic review of longitudinal studies – BMC Public Health. 2013; 13: 813. Published online 2013 Sep 8.
- Thomas DE, Ellio EJ, Naughton GA. Exercise for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2006 Jul 19;(3):CD002968.
- Hawley JA – Exercise as a therapeutic intervention for the prevention and treatment of insulin resistance. Diabetes Metab Res Rev. 2004 Sep-Oct;20(5):383-93.
- Umpierre D, Ribeiro PA, Kramer CK, Leitão CB, Zuca AT, Azevedo MJ, Gross JL, Ribeiro JP, Schaan BD. Physical activity advice only or structured exercise training and association with HbA1c levels in type 2 diabetes: a systematic review and meta-analysis. JAMA. 2011 May 4;305(17):1790-9.
- Sigal RJ, Kenny GP, Boulé NG, Wells GA, Prud’homme D, For er M, Reid RD, Tulloch H, Coyle D, Phillips P, Jennings A, Ja ey J. Effects of aerobic training, resistance training, or both on glycemic control in type 2 diabetes: a randomized trial. Ann Intern Med 2007;147:357–69.
- Gratas-Delamarche A, Derbré F, Vincent S, Cillard J. Free Radic Res. 2014 Jan;48(1):93-108.
- Bay R, Bay F, Combined therapy using acupressure therapy, hypnotherapy, and transcendental meditation versus placebo in type 2 diabetes. J Acupunct Meridian Stud, 2011 Sep ;45(3) :183-6
- Gainey A, Himathongkam T, Tanaka H, Suksom D. Effects of Buddhist walking meditation on glycemic control and vascular function in patients with type 2 diabetes. Complement Ther Med. 2016 Jun;26:92-7.
- Soinio et al. Serum Zinc Level and Coronary Heart Disease Events in Patients With Type 2 Diabetes. Diabetes Care March 2007 vol. 30 no. 3 523-528
- Simental-Mendía LE, Sahebkar A, Rodríguez-Morán M, Guerrero-Romero F. A systematic review and meta-analysis of randomized controlled trials on the effects of magnesium supplementation on insulinsensitivity and glucose control. Pharmacol Res. 2016 Sep;111:272-282.
- Mooren FC, Krüger K, Völker K, Golf SW, Wadepuhl M, Kraus A. Oral magnesium supplementation reduces insulin resistance in non-diabetic subjects – a double-blind, placebo-controlled, randomized trial. Diabetes Obes Metab. 2011 Mar; 13(3):281-4.
- Weng LC, Lee NJ, Yeh WT, Ho LT, Pan WH. Lower intake of magnesium and dietary fiber increases the incidence of type 2 diabetes in Taiwanese. J Formos Med Assoc. 2012 Nov;111(11):651-9.
- Rodríguez-Morán M, Guerrero-Romero F. Oral magnesium supplementation improves insulin sensitivity and metabolic control in type 2 diabetic subjects: a randomized double-blind controlled trial.. Diabetes Care. 2003 Apr;26(4):1147-52.
- Cavalier E, Delanaye P, Souberbielle JC, Radermecker RP. Vitamin D and type 2 diabetes mellitus: where do we stand? Diabetes Metab. 2011 Sep;37(4):265-72.
- Pittas AG and al. Plasma 25-hydroxyvitamin D and progression to diabetes in patients at risk for diabetes : an ancillary analysis in the Diabetes Prevention Program, Diabetes Care, 2012 Mar ;35(3) :565-73
- Von Hurst PR, Stonehouse W, Coad J. Vitamin D supplementation reduces insulin resistance in SouthAsian women living in New Zealand who are insulin resistant and vitamin D deficient – a randomised, placebo-controlled trial. Br J Nutr. 2010 Feb;103(4):549-55.
- Mang B, Wolters M, Schmitt B et al. Effects of a cinnamon extract on plasma glucose, HbA, and serum lipids in diabetes mellitus type 2. Eur J Clin Invest 2006 ;36:340-4.
- Khan A, Safdar M, li Khan MM, Khattak KN, Anderson RA. Cinnamon improves glucose and lipids of people with type 2 diabetes1. Diabetes Care 2003 ;26:3215-8.
- Thomas PJ Solomon et Andrew K. Blannin, « Changes in glucose tolerance and insulin sensitivity following 2 weeks of daily cinnamon ingestion in healthy humans », European journal of applied physiology 105, no 6 (2009): 969–976.
- Houjeghani S, Kheirouri S, Faraji E, Jafarabadi MA, L-carnosine supplementation attenuated fasting glucose, triglyceides, advanced glycation end products, and tumor necrosis factor-α levels in patients with type 2 diabetes : a double-blind placebo-controlled randomized clinical trial., Nutri Res, 2018 Jan ;49 :96-106.
- Park K and AL, Toenail selenium and incidence of type 2 diabetes in U.S. men and women, Diabetes Care 2012 Jul ;35(7) :1544-51.
- Szkudelski T, Szkudelska K, Resveratrol and diabetes : from animal to huma studies, Biochim Biophy Acta, 2015 ;1852(6) :1145-54.
- Kai Liu, Rui Zhou, Bin Wang, and Man-Tian Mi. Effect of resveratrol on glucose control and insulin sensitivity: a meta-analysis of 11 randomized controlled trials. 2014 American Society for Nutrition
- Mendez-del Villar M, Gonzalez-Ortiz M, Martinez-Abundis E, Perez-Rubio KG, Lizarraga-Valsez R, Effect of resveratrol administration on metabolic syndrome, insulin sensitivity, and insulin secretion. Metab Syndr Relat Disord, 2014 ;12(10) :497-501.
- Bhatt JK, Thomas S, Nanjan MJ, Resveratrol supplementation improves glycemic control in type 2 diabetes mellitus, Nutr Res 2012 ;32(7) :537-41.
- Sahebkar A. Effects of resveratrol supplementation on plasma lipids: a systematic review and meta-analysis of randomized controlled trials. Nutr Rev. 2013 Dec;71(12):822-35.
- http://www.nature.com/news/2011/110921/full/news.2011.549.html.
- Semba RD, Ferrucci L, Bartali B, et al. Resveratrol Levels and All-Cause Mortality in Older Community-Dwelling Adults. JAMA Intern Med. 2014;174(7):1077-1084.).
- Chuengsamarn et al. Curcumin Extract for Prevention of Type 2 Diabetes. Diabetes Care. 2012 Nov; 35(11): 2121–2127.
- Wu Y, Zhang D, Jiang X, Jiang W, Fruit and vegetable consumption and risk of type 2 diabetes mellitus : a dose-response meta-analysis of prospective cohort studies, Nutr Metab Cardiovasc Dis, 2015 ;25(2) :140-7.
- Mazza G, Oomah BD. Buckwheat as a food and feed. Specialty grains for food and feed. American Association of Cereal Chemists ed. USA: 2005. p. 375-93.
- Marlett JA, McBurney MI, Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc 2002 July;102(7):993-1000.
- Canadian Grains Commission. Health Benefits of Buckwheat. 2006.
- Dong H, Zhao Y, Zhao L, Lu F. The effects of berberine on blood lipids: a systemic review and meta-analysis of randomized controlled trials. Planta Med. 2013 Apr;79(6):437-46.
- Wei W, Zhao H, Wang A, et al. A clinical study on the short-term effect of berberine in comparison to metformin on the metabolic characteristics of women with polycystic ovary syndrome. Eur J Endocrinol. 2012;166:99-105.
- Hui Dong, Nan Wang, Li Zhao, and Fuer Lu, Berberine in the Treatment of Type 2 Diabetes Mellitus: A Systemic Review and Meta-Analysis, Evidence-Based Complementary and Alternative Medicine Volume 2012, Article ID 591654.
- Cheng et al. Fasting-mimicking diet promotes Ngn3-driven β-cell regeneration to reverse diabetes. Cell, 23 février 2017.
- Halberg N, Henriksen M, Söderhamn N, Stallknecht B, Ploug T, Schjerling P, Dela . Effect of intermittent fasting and refeeding on insulin action in healthy men ». The American Physiological Society. 2005.
- Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, Cuzick J, Jebb SA, Martin B, Cutler RG, Son TG, Maudsley S, Carlson OD, Egan JM, Flyvbjerg A, Howell A. 2011. « The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trial in young overweight women ». Int J Obes (Lond) 35(5):714–727.
- Harvie M, Wright C, Pegington M, McMullan D, Mitchell E, Martin B, Cutler RG, Evans G, Whiteside S, Maudsley S, Camandola S, Wang R, Carlson OD, Egan JM, Mattson MP, Howell A. 2013. « The effect of intermittent energy and carbohydrate restriction v. daily energy restriction on weight loss and metabolic disease risk markers in overweight women ». Br J Nutr 110(8):1534–15.
- Belkacemi L, Selselet-Attou G, Hupkens E, Nguidjoe E, Louchami K, Sener A, Malaisse WJ. Intermittent fasting modulation of the diabetic syndrome in streptozotocin-injected rats. Int J Endocrinol 2012 :962012.