Pour aller à l’essentiel
- La vitamine D une vitamine liposoluble présente dans les aliments riches en graisses, notamment d’origine marine :
- Poissons gras (entre 400 et 800 UI pour 100 g) : saumon, maquereau, hareng, sardine,
- Coquillages (200 à 300 UI)
- Dans une moindre mesure les œufs.
- Selon l’étude SU.VI.MAX, l’alimentation apporte en moyenne 136 UI par jour de vitamine D, alors que l’agence européenne en recommande au moins 600 UI.
- La vitamine D est présente dans l’alimentation sous deux formes, D2 (ergocalciférol) et D3 (cholécalciférol). Elle est ensuite transformée au niveau rénal en une forme active (1,23 dihydroxyvitamine D) assurant de nombreux rôles :
- Elle favorise l’absorption du calcium et du phosphate au niveau intestinal,
- Elle favorise la bonne minéralisation de l’os, mais aussi des dents et du cartilage. Toutefois, elle ne renforce par la solidité osseuse.
- Elle limite les risques de fracture par amélioration de l’équilibre.
- Elle augmente la réabsorption rénale du calcium et du phosphate, maintenant ainsi les concentrations sanguines en ces minéraux et contribue à réguler de nombreuses fonctions neuromusculaires ou métaboliques.
- Elle module positivement l’immunité.
- Certaines cellules, notamment les cellules osseuses et parathyroïdiennes, possèdent la capacité de réguler elles-mêmes le métabolisme de la vitamine D au niveau local et de manière indépendante. Elles possèdent ce que l’on appelle une « activité autocrine ».
- L’exposition au soleil permet de compléter les apports alimentaires. La période d’avril à septembre apporte entre 2 000 et 20 000 UI par jour selon le niveau d’exposition et la pigmentation de la peau (plus la peau est foncée, moins la production est importante). Pendant l’hiver, l’organisme utilise les réserves disponibles. Toutefois, ces dernières peuvent être insuffisantes pour assurer les besoins tout au long de l’année (environ 5 000 UI par jour).
- Un déficit en vitamine D peut se manifester dans de nombreuses pathologies (cf. tableau dans le document général).
- La valeur définissant un déficit chez un adulte lors d’un dosage sanguin est de 30 ng/ml (75 nmoles/l). On parle de carence en vitamine D en cas de taux inférieur à 10 ng/ml. La mesure du taux plasmatique de vitamine D est fiable dans la plupart des cas. Il est particulièrement important de vérifier votre statut dans les situations suivantes :
- Vous avez plus de 60 ans, la capacité à fabriquer de la vitamine D3 diminuant fortement avec l’âge.
- Vous vous exposez peu au soleil et/ou vous réalisez peu d’activité physique extérieure,
- Vous n’habitez pas dans une région ensoleillée et/ou vous ne prenez pas de vacances estivales,
- Votre peau n’est pas blanche,
- La quantité recommandée en cas de supplémentation est de 75 UI/kg poids corporel/j (l’idéal en 2 prises par jour), dans la limite de 4 000 UI/j pour les adultes et les enfants de plus de 10 ans, 2 000 UI/j pour les enfants entre 2 et 10 ans et 1 000 UI pour les nourrissons (ou 100 UI par kg de poids corporel).
- La durée de supplémentation dépend du niveau de déficit et de la réponse individuelle (très variable selon les personnes), mais elle peut s’étendre sur plusieurs mois en hiver, voire tout au long de l’année chez les personnes âgée. La vitamine D3 est absolument à privilégier à la vitamine D2, sous forme huileuse pour une meilleure assimilation. L’apport de vitamine D3 sous forme d’huile de foie de poisson est à éviter car elle contient de la vitamine A, bloquant l’activité de la vitamine D et pouvant être tératogène en excès chez la femme enceinte.
- La vitamine K2, notamment la forme K2-MK7, peut être proposée en synergie en cas de supplémentation en accompagnement de l’ostéoporose, de pathologies cardio-vasculaires ou de cancers (notamment de la prostate). Considérer environ 50 μg/j.
- Je vous recommande un produit apportant environ 1000 UI de vitamine D3 par goutte, associées si besoin à de la vitamine K2-MK7.
A quoi sert la vitamine D ?
La vitamine D fait partie des sujets fortement étudiés (plus de 74 200 publications référencées en 2018) et médiatisés au cours de ces dernières années. A juste titre ! Cette vitamine joue en effet des rôles essentiels pour votre santé, bien au-delà de la prévention de l’ostéoporose.
Il existe deux formes de vitamines D : la vitamine D2 (ergocalciférol) produite par les végétaux et la vitamine D3 (cholécalciférol) produite par les animaux. Chez l’homme, ce que l’on appelle communément vitamine D est en fait la 1,25-dihydroxyvitamine D (calcitriol), activée grâce à une enzyme au niveau du rein. Il est à ce titre important de vous assurer par une analyse sanguine que vous disposez bien d’un statut suffisant en cholestérol. En effet, les risques relatifs à un excès de cholestérol sont bien connus mais ceux provoqués par un déficit vitamine D le sont moins.
La 1,25-dihydroxyvitamine D (calcitriol) possède de multiples effets métaboliques :
- Elle favorise l’absorption du calcium et du phosphate au niveau intestinal.
- Elle favorise la minéralisation du calcium sur l’os, mais également des cartilages et des dents. Elle limite les risques de fracture osseuse sans pour autant renforcer de manière significative la solidité des os.
- Elle augmente la réabsorption rénale du calcium et du phosphate, maintenant ainsi les concentrations sanguines en ces minéraux et contribue à réguler de nombreuses fonctions neuromusculaires et métaboliques.
- Elle module les fonctions immunitaires et par voie de conséquence l’inflammation. De nombreuses études ont mis en évidence des relations entre la carence en vitamine D et la prévalence de maladies inflammatoires chroniques, de maladies métaboliques (dont le diabète) et de certains cancers2-6. Un statut insuffisant en vitamine D augmente par exemple le taux de cytokines pro-inflammatoires et augmente la résistance à l’insuline5.
Quels sont les aliments riches en vitamine D ?
La vitamine D est une vitamine liposoluble. Cela signifie qu’elle est présente essentiellement dans les aliments riches en graisses, notamment d’origine marine. Malheureusement les quantités consommées sont souvent insuffisantes pour couvrir les besoins. Les aliments les plus riches sont les poissons gras, contenant entre 400 et 800 UI pour 100 g (saumon, maquereau, hareng), les coquillages (200 à 300 UI), les sardines en boîte et dans une moindre mesure les œufs. Selon l’étude SU.VI.MAX6, l’alimentation apporte en moyenne 136 UI par jour de vitamine D.
Aliments riches en vitamine D
| Aliments | Teneur en vitamine D (µg/100 g) |
| Foie de morue | 100 |
| Anguille | 27 |
| Truite arc-en-ciel | 14.5 |
| Sardine | 14 |
| Espadon | 14 |
| Anchois | 11 |
| Hareng | 9,6 |
| Aliments | Teneur en vitamine D (µg/100 g) |
| Maquereau | 6,4 |
| Thon rouge | 6 |
| Saumon | 4 |
| Œuf | 1,5 |
| Champignons de Paris | 1,1 |
| Lait entier | 1,1 |
NB : Lorsque l’on évoque le statut en vitamine D, deux unités sont utilisées pour la quantifier : l’unité internationale (UI) et le microgramme (1 μg correspond à 40 UI ou 1 UI à 0,025 μg de calciférol).
Quels sont les signes d’un déficit en vitamine D ?
Les études scientifiques récentes ont mis en évidence l’existence de carences en vitamine D3 (taux inférieur à 10 ng/ml) dans le cadre de nombreuses pathologies.
| Pathologies ostéo-articulaires | Ostéomalacie7
Rachitisme8 Déminéralisation9 Polyarthrite rhumatoïde |
| Neurologiques et Neuromusculaires | Baisse de tonus musculaire10
Sclérose en plaques Alzheimer11 Parkinson Déclin cognitif12 Fibromyalgie13 |
| Infectieuses | Sensibilité générale aux infections,
Grippe saisonnière (diminution du risque relatif de 7 %)14 Asthme Infections respiratoires Tuberculose pulmonaire |
| Digestives et endocriniennes | Maladie de Crohn
Rectocolite hémorragique Diabètes de type 115 et 216,17 |
| Cancers | Sein, colon, pancréas, utérus, des reins, des ovaires
Leucémie18-23 |
| Cardio-vasculaires | Hypertension artérielle
Syndrome métabolique |
| Obstétricales | Diabète gestationnel
Faible poids de naissance |
En pratique : comment optimiser votre statut en vitamine D ?
Prenez le soleil !
Comme vous le savez certainement, votre organisme fabrique lui-même une grande partie de la vitamine D dont il a besoin, à partir d’un précurseur du cholestérol et en présence d’UVB. On considère que s’exposer au soleil sans crème solaire 15 à 30 min par jour (12 min en moyenne), à partir du printemps et jusqu’à l’automne, permet de couvrir les besoins de la plupart de la population. La longueur d’onde du rayonnement solaire garantissant la synthèse de la vitamine D3 doit en effet être comprise entre 290 et 315 nanomètres. Le début d’après-midi est alors opportun car il s’agit de la période au cours de laquelle ces UVB prédominent. Bien entendu, il reste important de bien se protéger du soleil le reste du temps grâce à des vêtements couvrants.
A l’inverse, l’exposition estivale ne permet pas de réaliser les réserves nécessaires pour l’hiver. Elle fournit en moyenne entre 2 000 UI et 20 000 UI par jour selon la pigmentation de la peau, alors que les besoins quotidiens sont d’environ 5000 UI. Les semaines automnales avançant, les réserves s’amenuisent, il devient alors nécessaire de vérifier votre statut24. Selon l’étude SU.VI.MAX, 74 % des hommes et 78 % des femmes entre 35 et 65 ans souffriraient de déficit en vitamine D, 14 % seraient en état de carence25. Des chiffres plus récents de 2007 confirment la prévalence de ces déficits : 80 % des adultes manquent de vitamine D, dont 42 % présentent un déficit modéré à sévère26.
Comment savoir si vous manquez de vitamine D ?
La valeur seuil définissant un déficit pour un adulte est de 30 ng/ml (75 nmoles/l). Certains experts recommandent toutefois un minimum de 40 ng/ml, voire de 60 ng/ml pour prévenir certaines pathologies dont le cancer du sein27 . On parle de carence D en cas de taux inférieur à 10 ng/ml.
Vous avez d’autant plus intérêt à vérifier votre statut si :
- Vous avez plus de 60 ans, la capacité à fabriquer de la vitamine D3 diminuant fortement avec l’âge. Si vous êtes concerné(e), la supplémentation est quasi-nécessaire. Je vous invite à bien faire vérifier votre taux dès la fin de l’été pour savoir si vous devez prendre un complément alimentaire sans attendre l’entrée dans l’hiver.
- Votre peau est foncée.
- Vous vous exposez peu au soleil.
- Vous réalisez peu d’activité physique extérieure.
- Vous ne prenez pas de vacances estivales ou n’habitez pas dans une région ensoleillée.
- Vous allaitez
- Vous êtes végétarien ou végétalien
- Vous travaillez de nuit
- Vous êtes en surcharge pondérale
Peut-on se fier au dosage sanguin en vitamine D ?28
Plusieurs méthodes de dosage de la vitamine D sont utilisées pour déterminer le statut nutritionnel :
- La concentration plasmatique en 25(OH)D (également appelée calcidiol et correspondant à la forme pré-activée de la vitamine D). Cette concentration représente le niveau d’apport total en vitamine D (fabriquée par l’organisme et d’origine alimentaire). Il s’agit donc d’un reflet précis du statut nutritionnel. Toutefois, certains biais peuvent intervenir. Il a par exemple été mis en évidence une corrélation négative entre la concentration de 25(OH)D et l’indice de masse corporelle. Par ailleurs, plusieurs méthodes peuvent être utilisées selon les laboratoires, (HPLC avec détection UV, spectrométrie de masse, immuno-essais …), ne permettant pas une fiabilité totale de cette mesure.
- La concentration plasmatique libre en 25(OH)D. Il s’agit de la fraction de vitamine D présente sous forme 25(OH)D non liée à la protéine assurant la liaison de la vitamine D à l’albumine (la DBP). Une telle mesure représente moins de 1% du niveau de 25(OH)D total de l’organisme. Elle représente néanmoins un marqueur intéressant dans la mesure où cette fraction est facilement accessible aux cellules cibles, mais elle doit être considérée en tant que tel et non comme le reflet général du statut en vitamine D.
- La concentration sérique de l’hormone parathyroïdienne (PTH). La concentration sérique en PTH est en relation avec celle de 25(OH)D (via 1,25(OH)2D). Elle a d’ailleurs été suggérée comme pouvant représenter un biomarqueur possible du statut en vitamine D. Une revue de littérature regroupant 70 études a toutefois invalidé cette mesure29, car elle est par ailleurs influencée par les taux de calcium et de phosphate.
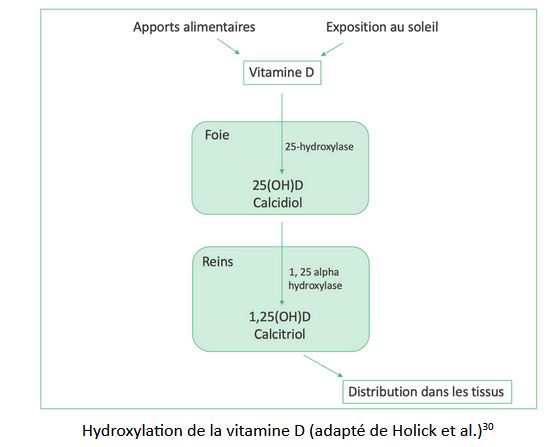
L’ensemble de ces méthodes ne sont pas fiables à 100%, et pour mieux comprendre cette notion de dosage, attardons-nous sur le schéma métabolique globale et simplifié de la vitamine D :
La plupart des mesures sanguines dosent la 25 (OH)D (calcidiol). Il s’agit de la forme de vitamine D obtenue après métabolisation par le foie via une enzyme spécifique, la 25-hydroxylase. Or l’activité de cette dernière varie de manière importante selon les individus31. Il en est de même pour la transformation de la 25(OH)D en 1,25 (OH)D ou calcitriol, la forme active de la vitamine D. C’est pourquoi les résultats du taux de 25(OH)D obtenus après une prise de sang peuvent s’avérer être un reflet exact de la la forme active de la vitamine D.
Par ailleurs, certaines cellules, notamment les cellules osseuses et parathyroïdiennes, possèdent la capacité de réguler elles-mêmes le métabolisme de la vitamine D au niveau local et de manière indépendante32. Elles possèdent ce que l’on appelle une activité autocrine et la vitamine D est dépendante d’un récepteur spécifique (VDR).
Ainsi, le taux plasmatique de vitamine D tel qu’il est mesuré classiquement par une prise de sang mérite d’être interprété avec une certaine prudence. Ce point peut d’ailleurs expliquer les fortes différences d’évolution du taux plasmatique de vitamine D d’une personne à l’autre pour une même quantité de supplémentation en vitamine D.
Le dosage classique de la vitamine D n’est plus remboursé par la sécurité sociale depuis 2014 hormis dans 6 situations clinique particulières :
- Lors d’une démarche diagnostique visant à confirmer ou infirmer un rachitisme.
- Lors d’une démarche diagnostique visant à confirmer ou infirmer une ostéomalacie.
- Au cours d’un suivi ambulatoire de l’adulte transplanté rénal au-delà de 3 mois après transplantation.
- Avant et après une chirurgie bariatrique.
- Lors de l’évaluation et de la prise en charge des personnes âgées sujettes aux chutes répétées.
- Pour respecter les résumés des caractéristiques du produit (RCP) des médicaments préconisant la réalisation du dosage de vitamine D.
Vitamine D et infections
La vitamine D est un régulateur clé de la défense immunitaire contre les infections, autant concernant l’immunité innée qu’adaptative33,34. Elle exerce des effets multiples telles que la stimulation des macrophages, la différenciation des lymphocytes B et T, la maturation des cellules dendritiques, la modulation de l’expression de TNF-alpha et du CMH, la production de composés biocides (comme les défensines) ou pro-oxydants. Elle régule également les cytokines produites par les cellules Natural Killer (Interféron-γ)35. En clair, la vitamine D3 est considérée comme un immuno-modulateur puissant et un régulateur de l’inflammation36. Elle possède par ailleurs une spécificité dans le monde des vitamines, celle de se lier aux récepteurs de plus de 400 types cellulaires différents (VDR) pour autoréguler sa synthèse (activité dite autocrine)37. Il s’agit d’ailleurs d’une des raisons pour laquelle elle est davantage considérée comme une hormone qu’une vitamine. Le récepteur VDR des cellules intestinales intervient par exemple dans le maintien de l’intégrité de la muqueuse, dans le contrôle de l’inflammation et la régulation immunitaire38. Cette capacité d’autorégulation semble particulièrement importante pour le système immunitaire. En tant qu’immuno-modulateur, la vitamine D a également montré des effets bénéfiques dans le cadre des pathologies auto-immunes39-43, notamment du diabète de type 144-46, du syndrome de Sjögren47,48
En période hivernale, le risque d’infection grippale augmente, en particulier chez les personnes âgées qui ont tendance à rester davantage chez elles alors qu’elles ont perdu une grande partie de leur capacité de synthèse de vitamine D349(p3),50,51. Les liens entre déficit en vitamine D3 et infections virales sont bien établis pour de nombreuses pathologies comme le VIH ou l’hépatite B35. Les personnes souffrant de VIH présentent en effet souvent un déficit chronique. Des niveaux élevés d’expression du récepteur à la vitamine D chez ces personnes (VDR) sont également associés à une meilleure résistance naturelle à l’infection. À l’inverse, la carence en vitamine D est liée à une inflammation et une activation immunitaire plus importantes, à un faible taux de lymphocytes (CD4+), à une progression plus rapide de la maladie et à une durée de survie plus courte chez les patients infectés. La supplémentation en vitamine D en cas de carence et le retour à des valeurs normales peuvent améliorer la récupération immunologique pendant la thérapie, voire réduire la mortalité chez les patients infectés par le VIH.
Une revue systématique a analysé les résultats de 25 essais contrôlés randomisés (11 312 participants de 0 à 95 ans)52. La supplémentation en vitamine D a réduit le risque d’infection aiguë des voies respiratoires chez tous les participants de 12%. Les personnes ayant recours à un apport quotidien ou hebdomadaire ont vu leur risque diminuer de 19% contre uniquement 3% en cas d’apport de fortes doses isolées. Si les taux initiaux étaient faibles (<25 nmol/L), le bénéfice était de 30% de réduction des risques. Toutefois, la supplémentation n’a aucun effet sur les risques de complications graves. Une autre revue systématique confirme l’intérêt d’une supplémentation quotidienne53. Une étude de cohorte américaine (Health and Nutrition Examination Survey) regroupant 18,883 participants) et publiée dans JAMA a mis en évidence que les personnes possédant un taux plasmatique de vitamine D inférieur à 10 ng/L présentaient un risque d’infections respiratoires aigues 1,4 fois plus important que celles dont le taux était supérieur à 30 ng/L54. Les risques de complication pulmonaire, d’augmentation de l’inflammation et de réduction de l’immunité présente au niveau du mucus étaient par ailleurs fortement augmentés. En cas d’hospitalisation, les patients souffrant de la grippe et présentant un taux bas de vitamine D3 sont considérés davantage à risques de complications respiratoires et de mortalité55-57. Une étude clinique publiée dans JAMA en 2014 auprès de 475 patients n’a toutefois pas constaté d’effets positifs sur les risques de mortalité ni sur la durée du séjour d’une supplémentation massive en vitamine D3 chez les personnes déficitaires58. Néanmoins, les personnes étant atteintes du moins de complications et restant peu de temps à l’hôpital furent celles qui présentaient un meilleur taux plasmatique. Par ailleurs, les personnes présentant un taux optimal de vitamine D font partie des individus les moins sujets aux infections à la suite de vaccinations, en particulier contre le virus de la grippe59,37.
En terme de dosage, un apport quotidien de 1000 UI apparait plus efficace qu’une prise occasionnelle à dose élevée60,61(p3). Selon une méta-analyse publiée dans PLOs one, les études ayant démontré une réduction des risques d’infections des voies respiratoires proposaient des doses quotidiennes entre 300 et 2000 UI62. Toutefois, la réponse de l’organisme à la suite d’une supplémentation apparait très variable selon les individus. On considère en moyenne que, pour chaque 100 UI consommées, le taux plasmatique monte d’1 ng/mL (ou 2,5 nmol/L). Ainsi, pour atteindre une valeur de 475 nmol/L, 3000 UI par jour seraient en moyenne nécessaires. Toutefois, il semble que le corps soit capable de faire remonter le taux plus rapidement en cas de valeur initiale très basse, notamment pour passer de 15 à 20 ng/mL33. Il existe par ailleurs un polymorphisme individuel important. Les cellules immunitaires disposent en effet de plus de 23 000 sites récepteurs VDR différents et plus de 9000 régions de chromatine réagissent à une supplémentation63,64. Or il semblerait que la réaction du système immunitaire à la supplémentation en vitamine D varie d’un individu à l’autre en fonction du polymorphisme du récepteur VDR.
Anthony Berthou
Sources :
- Wang Thomas J., Pencina Michael J., Booth Sarah L., et al. Vitamin D Deficiency and Risk of Cardiovascular Disease. Circulation. 2008;117(4):503-511. doi:10.1161/CIRCULATIONAHA.107.706127
- Salehpour A, Shidfar F, Hosseinpanah F, et al. Vitamin D3 and the risk of CVD in overweight and obese women: a randomised controlled trial. British Journal of Nutrition. 2012;108(10):1866-1873. doi:10.1017/S0007114512000098
- Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Endocrinol Metab Clin North Am. 2010;39(2):365-379, table of contents. doi:10.1016/j.ecl.2010.02.010
- Cantorna MT. Vitamin D and its role in immunology: Multiple sclerosis, and inflammatory bowel disease. Progress in Biophysics and Molecular Biology. 2006;92(1):60-64. doi:10.1016/j.pbiomolbio.2006.02.020
- Herrmann M, Sullivan DR, Veillard A-S, et al. Serum 25-hydroxyvitamin D: a predictor of macrovascular and microvascular complications in patients with type 2 diabetes. Diabetes Care. 2015;38(3):521-528. doi:10.2337/dc14-0180
- Hercberg S, Galan P, Preziosi P, et al. The SU.VI.MAX Study: a randomized, placebo-controlled trial of the health effects of antioxidant vitamins and minerals. Arch Intern Med. 2004;164(21):2335-2342. doi:10.1001/archinte.164.21.2335
- Bhan A, Rao AD, Rao DS. Osteomalacia as a result of vitamin D deficiency. Endocrinol Metab Clin North Am. 2010;39(2):321-331, table of contents. doi:10.1016/j.ecl.2010.02.001
- Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest. 2006;116(8):2062-2072. doi:10.1172/JCI29449
- Priemel M, von Domarus C, Klatte TO, et al. Bone mineralization defects and vitamin D deficiency: histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J Bone Miner Res. 2010;25(2):305-312. doi:10.1359/jbmr.090728
- Janssen HC, Samson MM, Verhaar HJ. Vitamin D deficiency, muscle function, and falls in elderly people. Am J Clin Nutr. 2002;75(4):611-615. doi:10.1093/ajcn/75.4.611
- Littlejohns TJ, Henley WE, Lang IA, et al. Vitamin D and the risk of dementia and Alzheimer disease. Neurology. 2014;83(10):920-928. doi:10.1212/WNL.0000000000000755
- Llewellyn DJ, Lang IA, Langa KM, et al. Vitamin D and risk of cognitive decline in elderly persons. Arch Intern Med. 2010;170(13):1135-1141. doi:10.1001/archinternmed.2010.173
- de Carvalho JF, da Rocha Araújo F a. G, da Mota LMA, Aires RB, de Araujo RP. Vitamin D Supplementation Seems to Improve Fibromyalgia Symptoms: Preliminary Results. Isr Med Assoc J. 2018;20(6):379-381.
- Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. doi:10.1136/bmj.i6583
- Baynes KC, Boucher BJ, Feskens EJ, Kromhout D. Vitamin D, glucose tolerance and insulinaemia in elderly men. Diabetologia. 1997;40(3):344-347. doi:10.1007/s001250050685
- Von Hurst PR , Stonehouse W , Coad J. La supplémentation en vitamine D réduit la résistance à l’ insuline chez les femmes sud-asiatiques qui vivent en Nouvelle-Zélande et qui sont résistantes à l’ insuline et à la vitamine D – un essai randomisé et contrôlé par placebo. 2010;Br J Nutr:103 (4): 549-55.
- Mathieu C. Vitamin D and diabetes: Where do we stand? Diabetes Res Clin Pract. 2015;108(2):201-209. doi:10.1016/j.diabres.2015.01.036
- Giovannucci E, Liu Y, Rimm EB, et al. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men. J Natl Cancer Inst. 2006;98(7):451-459. doi:10.1093/jnci/djj101
- Tissandié E, Guéguen Y, A. Lobaccaro J-M, Aigueperse J, Souidi M. Vitamine D : Métabolisme, régulation et maladies associées. M/S Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2006, Vol 22, N° 12; p 1095-1100. Published online 2006. doi:10.1051/medsci/200622121095
- Garland CF, French CB, Baggerly LL, Heaney RP. Vitamin D supplement doses and serum 25-hydroxyvitamin D in the range associated with cancer prevention. Anticancer Res. 2011;31(2):607-611.
- Marshall DT, Savage SJ, Garrett-Mayer E, et al. Vitamin D3 supplementation at 4000 international units per day for one year results in a decrease of positive cores at repeat biopsy in subjects with low-risk prostate cancer under active surveillance. J Clin Endocrinol Metab. 2012;97(7):2315-2324. doi:10.1210/jc.2012-1451
- Lehmann U, Hirche F, Stangl GI, Hinz K, Westphal S, Dierkes J. Bioavailability of Vitamin D2 and D3 in Healthy Volunteers, a Randomized Placebo-Controlled Trial. J Clin Endocrinol Metab. 2013;98(11):4339-4345. doi:10.1210/jc.2012-4287
- Hohaus S, Tisi MC, Bellesi S, et al. Vitamin D deficiency and supplementation in patients with aggressive B-cell lymphomas treated with immunochemotherapy. Cancer Med. 2018;7(1):270-281. doi:10.1002/cam4.1166
- Barger-Lux MJ, Heaney RP. Effects of above average summer sun exposure on serum 25-hydroxyvitamin D and calcium absorption. J Clin Endocrinol Metab. 2002;87(11):4952-4956. doi:10.1210/jc.2002-020636
- Chapuy MC, Preziosi P, Maamer M, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7(5):439-443.
- Vernay M. et al. Vitamin D status in the French adult population. the French Nutrition and Health Survey (ENNS 2006-2007). 2012;Usen, invs.
- Cannell JJ, Hollis BW. Use of vitamin D in clinical practice. Altern Med Rev. 2008;13(1):6-20.
- Dietary reference values for vitamin D. EFSA Journal. 2016;14(10):e04547. doi:10.2903/j.efsa.2016.4547
- Sai AJ, Walters RW, Fang X, Gallagher JC. Relationship between vitamin D, parathyroid hormone, and bone health. J Clin Endocrinol Metab. 2011;96(3):E436-446. doi:10.1210/jc.2010-1886
- Young AR. Some light on the photobiology of vitamin D. J Invest Dermatol. 2010;130(2):346-348. doi:10.1038/jid.2009.419
- Barry EL, Rees JR, Peacock JL, et al. Genetic variants in CYP2R1, CYP24A1, and VDR modify the efficacy of vitamin D3 supplementation for increasing serum 25-hydroxyvitamin D levels in a randomized controlled trial. J Clin Endocrinol Metab. 2014;99(10):E2133-2137. doi:10.1210/jc.2014-1389
- Cannell JJ, Hollis BW. Use of vitamin D in clinical practice. Altern Med Rev. 2008;13(1):6–20.
- Lang PO, Samaras N, Samaras D, Aspinall R. How important is vitamin D in preventing infections? Osteoporos Int. 2013;24(5):1537-1553. doi:10.1007/s00198-012-2204-6
- Zdrenghea MT, Makrinioti H, Bagacean C, Bush A, Johnston SL, Stanciu LA. Vitamin D modulation of innate immune responses to respiratory viral infections. Rev Med Virol. 2017;27(1). doi:10.1002/rmv.1909
- Lang PO, Aspinall R. Vitamin D Status and the Host Resistance to Infections: What It Is Currently (Not) Understood. Clin Ther. 2017;39(5):930-945. doi:10.1016/j.clinthera.2017.04.004
- Hoe E, Nathanielsz J, Toh ZQ, et al. Anti-Inflammatory Effects of Vitamin D on Human Immune Cells in the Context of Bacterial Infection. Nutrients. 2016;8(12). doi:10.3390/nu8120806
- Lang PO, Aspinall R. Can we translate vitamin D immunomodulating effect on innate and adaptive immunity to vaccine response? Nutrients. 2015;7(3):2044-2060. doi:10.3390/nu7032044
- Li YC, Chen Y, Du J. Critical roles of intestinal epithelial vitamin D receptor signaling in controlling gut mucosal inflammation. J Steroid Biochem Mol Biol. 2015;148:179-183. doi:10.1016/j.jsbmb.2015.01.011
- Jeffery LE, Wood AM, Qureshi OS, et al. Availability of 25-hydroxyvitamin D(3) to APCs controls the balance between regulatory and inflammatory T cell responses. J Immunol. 2012;189(11):5155-5164. doi:10.4049/jimmunol.1200786
- Szymczak I, Pawliczak R. The Active Metabolite of Vitamin D3 as a Potential Immunomodulator. Scand J Immunol. 2016;83(2):83-91. doi:10.1111/sji.12403
- Altieri B, Muscogiuri G, Barrea L, et al. Does vitamin D play a role in autoimmune endocrine disorders? A proof of concept. Rev Endocr Metab Disord. 2017;18(3):335-346. doi:10.1007/s11154-016-9405-9
- Yamamoto E, Jørgensen TN. Immunological effects of vitamin D and their relations to autoimmunity. J Autoimmun. 2019;100:7-16. doi:10.1016/j.jaut.2019.03.002
- Illescas-Montes R, Melguizo-Rodríguez L, Ruiz C, Costela-Ruiz VJ. Vitamin D and autoimmune diseases. Life Sci. 2019;233:116744. doi:10.1016/j.lfs.2019.116744
- Takiishi T, Gysemans C, Bouillon R, Mathieu C. Vitamin D and diabetes. Endocrinol Metab Clin North Am. 2010;39(2):419-446, table of contents. doi:10.1016/j.ecl.2010.02.013
- Dankers W, Colin EM, van Hamburg JP, Lubberts E. Vitamin D in Autoimmunity: Molecular Mechanisms and Therapeutic Potential. Front Immunol. 2016;7:697. doi:10.3389/fimmu.2016.00697
- Infante M, Ricordi C, Sanchez J, et al. Influence of Vitamin D on Islet Autoimmunity and Beta-Cell Function in Type 1 Diabetes. Nutrients. 2019;11(9). doi:10.3390/nu11092185
- Erten Ş, Şahin A, Altunoğlu A, Gemcioğlu E, Koca C. Comparison of plasma vitamin D levels in patients with Sjögren’s syndrome and healthy subjects. Int J Rheum Dis. 2015;18(1):70-75. doi:10.1111/1756-185X.12298
- Zardi EM, Basta F, Afeltra A. Levels of Vitamin D, Disease Activity and Subclinical Atherosclerosis in Post-menopausal Women with Sjögren’s Syndrome: Does a Link Exist? In Vivo. 2016;30(5):721-725.
- MacLaughlin J, Holick MF. Aging decreases the capacity of human skin to produce vitamin D3. J Clin Invest. 1985;76(4):1536-1538. doi:10.1172/JCI112134
- Tangpricha V, Pearce EN, Chen TC, Holick MF. Vitamin D Insufficiency among Free-Living Healthy Young Adults. Am J Med. 2002;112(8):659-662.
- Holick MF. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease. Am J Clin Nutr. 2004;80(6 Suppl):1678S-88S. doi:10.1093/ajcn/80.6.1678S
- Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. doi:10.1136/bmj.i6583
- de Castro Kroner J, Sommer A, Fabri M. Vitamin D Every Day to Keep the Infection Away? Nutrients. 2015;7(6):4170-4188. doi:10.3390/nu7064170
- Ginde AA, Mansbach JM, Camargo CA. Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2009;169(4):384-390. doi:10.1001/archinternmed.2008.560
- de Haan K, Groeneveld ABJ, de Geus HRH, Egal M, Struijs A. Vitamin D deficiency as a risk factor for infection, sepsis and mortality in the critically ill: systematic review and meta-analysis. Crit Care. 2014;18(6):660. doi:10.1186/s13054-014-0660-4
- Upala S, Sanguankeo A, Permpalung N. Significant association between vitamin D deficiency and sepsis: a systematic review and meta-analysis. BMC Anesthesiol. 2015;15:84. doi:10.1186/s12871-015-0063-3
- Matysiak-Luśnia K. Vitamin D in critically ill patients. Anaesthesiol Intensive Ther. 2016;48(3):201-207. doi:10.5603/AIT.a2016.0034
- Amrein K, Schnedl C, Holl A, et al. Effect of high-dose vitamin D3 on hospital length of stay in critically ill patients with vitamin D deficiency: the VITdAL-ICU randomized clinical trial. JAMA. 2014;312(15):1520-1530. doi:10.1001/jama.2014.13204
- Science M, Maguire JL, Russell ML, Smieja M, Walter SD, Loeb M. Serum 25-Hydroxyvitamin D Level and Influenza Vaccine Immunogenicity in Children and Adolescents. PLoS One. 2014;9(1). doi:10.1371/journal.pone.0083553
- He C-S, Aw Yong XH, Walsh NP, Gleeson M. Is there an optimal vitamin D status for immunity in athletes and military personnel? Exerc Immunol Rev. 2016;22:42-64.
- Takács I, Tóth BE, Szekeres L, Szabó B, Bakos B, Lakatos P. Randomized clinical trial to comparing efficacy of daily, weekly and monthly administration of vitamin D3. Endocrine. 2017;55(1):60-65. doi:10.1007/s12020-016-1137-9
- Bergman P, Lindh AU, Björkhem-Bergman L, Lindh JD. Vitamin D and Respiratory Tract Infections: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS ONE. 2013;8(6):e65835. doi:10.1371/journal.pone.0065835
- Handel AE, Sandve GK, Disanto G, et al. Vitamin D receptor ChIP-seq in primary CD4+ cells: relationship to serum 25-hydroxyvitamin D levels and autoimmune disease. BMC Med. 2013;11:163. doi:10.1186/1741-7015-11-163
- Seuter S, Neme A, Carlberg C. Epigenome-wide effects of vitamin D and their impact on the transcriptome of human monocytes involve CTCF. Nucleic Acids Res. 2016;44(9):4090-4104. doi:10.1093/nar/gkv1519