L’alimentation est au cœur de la régulation de l’immunité. Elle module en effet notre capacité à nous défendre de manière optimale, ni trop ni trop peu, selon quatre principaux mécanismes :
- Un microbiote intestinal de qualité régule positivement l’immunité.
- Un statut nutritionnel optimisé permet aux cellules immunitaires de fonctionner de manière optimale, voire de renforcer leur action ponctuellement par une supplémentation ciblée.
- Un système immunitaire équilibré tolère les protéines alimentaires consommées, au risque le cas échéant de développer des inflammations chroniques, voire des hypersensibilités alimentaires.
- Une faible contamination aux xénobiotiques préserve notre système immunitaire1. 2
Réponse immunitaire et contrôle de l’inflammation, le cœur du sujet du Covid-19 ?
La réaction inflammatoire est un mécanisme physiologique indispensable à la vie. Elle peut être d’origine infectieuse, mais également consécutive à une brûlure, une blessure ou une agression chimique par exemple. Dans le cas d’une infection, l’objectif est bien sûr de tuer les agents infectieux et de récupérer au plus vite. La fièvre fait partie des symptômes caractéristiques. Pour ce faire, le corps utilise son système immunitaire de manière … extraordinaire. Les cellules qui le constituent font en effet preuve d’une réactivité, d’une complexité, d’une communication et d’une finesse de régulation difficilement perfectibles. Et heureusement, car notre système immunitaire est confronté à un double challenge, vital, c’est bien le mot : il doit nous défendre contre tous les agents pathogènes – comme dans le cas de ce nouveau virus épidémique qu’est le Covid-19, mais aussi des bactéries, des parasites ou encore des champignons – tout en tolérant le microbiote intestinal, les protéines des aliments que nous mangeons chaque jour mais aussi et surtout nos propres protéines, les protéines du soi. Il a donc la responsabilité majeure d’arbitrer en permanence entre sa capacité de défense, au risque de souffrir d’une maladie infectieuse le cas échant, et de tolérance pour éviter toute allergie contre une protéine étrangère (alimentaire ou de l’environnement) ou toute pathologie auto-immune. Sans une immunité efficace, point de vie. Mais sans inflammation, point d’immunité.
De manière très synthétique, il est important de comprendre que nous disposons de deux systèmes immunitaires : l’immunité innée et l’immunité acquise ou adaptative. La réponse immunitaire innée est rapide (quelques heures), non spécifique et alerte le système immunitaire adaptatif si besoin. La réponse immunitaire adaptative demande quant à elle davantage de temps (plusieurs jours) mais elle est spécifique. Dans le cas de l’infection au Covid-19, c’est la réponse immunitaire adaptative qui est essentiellement impliquée comme l’a résumé un article publié dans Nature medicine le 16 Mars dernier 3. Le système permettant aux cellules immunitaires de se spécialiser et d’amplifier la défense dépend du contrôle – subtil – de l’inflammation. Cette coordination est rendue possible grâce à la sécrétion de messagers immunitaires, les cytokines. Certaines sont dites pro-inflammatoires alors que d’autres permettent au contraire de « calmer le jeu » pour éviter que le système ne s’emballe. Or qui dit inflammation, dit stress oxydatif. Le principe même du mode d’action des cellules immunitaires repose sur la production de radicaux libres (les molécules à l’origine du stress oxydatif) pour tuer l’agent pathogène4. Certaines cellules immunitaires produisent un stress oxydatif majeur notamment via le peroxyde d’hydrogène (H202)5. Ces radicaux libres permettent également aux mitochondries de fonctionner de manière adaptée en période infectieuse, de stimuler la prolifération et la différenciation des lymphocytes T6,7. Le contrôle de l’inflammation est donc vital : sans inflammation, nous mourrons par manque de défense contre l’agent pathogène. Avec un excès d’inflammation, nous mourrons à cause de « l’orage cytokinique », une expression utilisée pour décrire ce mécanisme 9. Et c’est tout le problème de l’infection au Covid-19 au même titre que d’autres pathologies virales telles que la grippe espagnole ou H5N1. Selon une étude parue dans The Lancet le 13 Mars, le virus provoque une hyperactivation du système immunitaire (en particulier des lymphocytes) à l’origine d’une production massive de cytokines (notamment IL-2, IL-7 et TNF-alpha)9. Le système s’emballe, l’inflammation atteint les tissus et peut aller jusqu’à provoquer la mort. Les lésions pulmonaires aiguës peuvent en effet résulter de cet orage cytokinique, provoquant un afflux massif de leucocytes dans les poumons du fait de l’infection, à l’origine d’une fibrose voire du syndrome de détresse respiratoire aiguë (SDRA). Les reins peuvent également être victimes de cet orage cytokinique. Une étude menée auprès de 150 malades chinois considère que l’élévation majeure d’une cytokine particulière, l’IL-6, serait un marqueur prédictif de décès 10. Un des médicaments testés en Chine, le tocilizumab, permet justement de bloquer les récepteurs de cette cytokine. C’est une des problématiques majeures de l’usage des médicaments visant à juguler l’inflammation. S’ils sont pris au début de l’infection, ils peuvent entraver le fonctionnement du système immunitaire. Une fois l’orage cytokinique présent, ils peuvent ne plus être suffisants pour le juguler.
Nous sommes ici face à une situation caractéristique de ce que j’évoque en permanence dans mes formations : rappelons-nous que la vie cellulaire est fondée sur le principe d’homéostasie. Sans inflammation, nous ne pouvons ni évoluer ni nous défendre contre les agressions extérieures. Toutefois, si cette inflammation devient systémique, pérenne et non contrôlable, c’est le point d’initiation de la désadaptation, voire de la pathologie. Dans le cas du Covid-19, elle peut même tuer. Le cœur de l’enjeu lié à la lutte contre le coronavirus est donc de contrôler la cascade inflammatoire liée à la surproduction de cytokines, davantage que le virus lui-même.
Comprendre que l’immunité est fondée sur la capacité à initier, à supporter et à contrôler un déséquilibre biologique est passionnant, bien que malheureusement empreint ici de conséquences terribles. Passionnant car cette situation illustre parfaitement ce qu’il se passe à l’échelle de la santé occidentale. Le mode de vie individuel « occidental » et l’environnement que nous avons créé à titre collectif génèrent une inflammation systémique permanente, pernicieuse, à bas bruit (dite de bas-grade) qui explique la grande majorité, si ce n’est la totalité, des maladies dites de civilisation. Il ne s’agit nullement de considérer que c’est notre mode de vie qui est responsable des complications de l’infection au Covid-19. Nous sommes confrontés ici à une situation aiguë, comme il en a toujours existé et encore régulièrement. Néanmoins, même si nous ne disposons pas encore de données pour objectiver un lien entre les risques de complication et l’inflammation de bas-grade, il est évident que l’état biologique dans lequel nous sommes au moment de l’infection joue un rôle significatif dans la façon dont le système immunitaire va pouvoir y faire face. Les personnes les plus à risque sont d’ailleurs celles qui, au-delà de l’âge, souffrent d’inflammation chronique, de diabète, de maladies cardiovasculaires, d’insuffisance rénale, de cancer ou encore de maladies auto-immunes. Or toutes ces pathologies sont associées à une inflammation de bas-grade systémique. L’âge, le tabagisme ou encore la sédentarité sont également des facteurs y contribuant.
Les chercheurs commencent à émettre des hypothèses sérieuses sur le sujet. Une étude parue dans The Lancet le 11 Mars est particulièrement intéressante en ce sens 11. Selon les auteurs, les personnes atteintes et souffrant de diabète ou d’hypertension artérielle verraient leurs risques augmenter à cause de … leur traitement.En effet, ils ont su démontrer que le coronavirus s’accroche davantage aux récepteurs pulmonaires chez ces personnes, facilitant ainsi sa pénétration dans l’organisme. Or certains des traitements utilisés (inhibiteurs de l’enzyme de conversion de l’angiotensine II ou ACE2) agissent justement sur ces récepteurs dans le but de diminuer l’inflammation. L’usage chronique des médicaments engendre alors un mécanisme bien connu dans le monde de l’allopathie, celui de la modification de la sensibilité des récepteurs. Les chercheurs de l’étude parue dans The Lancet précisent toutefois que d’autres traitements, fondés sur le blocage de canaux calciques, ne présenteraient pas ces effets secondaires. L’augmentation des risques de complications à la suite de la prise d’anti-inflammatoires non stéroïdiens tels que l’ibuprofène, surtout chez les jeunes, pourrait être liée à la modification de la capacité de régulation de l’inflammation au cours de l’infection. De même, une équipe de chercheurs a clairement précisé en Février que le recours aux corticostéroïdes n’était pas recommandé en cas d’infection au Covid-1912. Notons également que des atteintes hépatiques pourraient exister chez les patients atteints du Covid-19 du fait du ciblage de ces cellules par les virus et via ACE213. Le foie est d’ailleurs de plus en plus considéré comme un organe cible potentiel14 et des liens étroits avec le microbiote intestinal émergent (voir partie dédiée dans l’article). Environ 10% des patients atteints du Covid-19 souffrent en effet de troubles digestifs, notamment de diarrhées.
Plusieurs auteurs indiquent que les récepteurs à ACE2 sont essentiellement situés au niveau de l’épithélium intestinal15, donc que le coronavirus pourrait interagir avec le microbiote intestinal16. Les poumons possèdent également leur propre microbiote et les liens entre les deux organes ne sont pas encore totalement compris. Toutefois, les personnes souffrant d’infections respiratoires présentent généralement des troubles intestinaux. Il a été démontré, dans le cas de la grippe, que la modulation du microbiote intestinal peut réduire la pneumonie et inverser certains effets secondaires des antibiotiques afin d’éviter la réplication précoce du virus dans l’épithélium pulmonaire17. La commission nationale de la santé chinoise aurait elle-même soumis la piste du recours à des probiotiques auprès des patients atteints d’une infection grave à Covid-19 dès la 5ième version de ses recommandations18. Il est donc plus que probable que la qualité du microbiote joue un rôle essentiel dans la réponse immunitaire face à cette maladie infectieuse, raison pour laquelle j’ai souhaité développer les conseils relatifs à cette partie dans l’article.
De cette situation ressortent deux points majeurs :
1. Un état nutritionnel optimal permettant de contrôler positivement le stress oxydatif est essentiel19–23.
Une baisse des défenses antioxydantes a en effet été reportée chez de nombreuses personnes sujettes aux infections virales comme la grippe, le HIV ou les hépatites 21. Pour autant, Il faut laisser ce stress oxydatif s’initier pour qu’il puisse permettre au système immunitaire de fonctionner de manière optimale sans générer de réponse exacerbée inadaptée, donc éviter tout recours à des anti-inflammatoires sans avis médical.
2. Si la modification immédiate de votre mode de vie ne représente pas une solution de guérison face à une situation aiguë majeure telle que l’infection au Covid-19, il n’en demeure pas moins que vous n’aurez que des bénéfices à adopter un mode de vie favorable au contrôle positif de l’inflammation. Il s’agit en effet du levier principal sur lequel vous pouvez être acteur, tout de suite. Il ne peut que vous aider à vous prévenir et à mieux lutter contre l’infection. Or, nous allons le voir, le mode de vie influence fortement la régulation de cette inflammation de bas-grade notamment via la gestion des émotions (dont le stress), le sommeil, l’activité physique, la pollution et bien sûr… l’alimentation 24–31.
Au-delà de la problématique infectieuse actuel, l’inflammation de bas-grade explique d’ailleurs en grande partie l’émergence de pathologies telles que l’obésité, le diabète, les maladies cardiovasculaires, les maladies auto-immunes, les cancers, les maladies neurodégénératives ou encore les maladies inflammatoires chroniques. Pour la première fois, une étude de cohorte de près de 3,7 millions de personnes au Royaume-Uni parue dans The Lancet Diabetes en 2018 a mis en évidence que le mode de vie occidental est à l’origine d’une possible diminution de l’espérance de vie des générations à venir32. Un autre article, paru dans Cell Metabolism en novembre 2019, résume très bien les conséquences d’une alimentation inadaptée sur l’inflammation de bas-grade et sur l’immunité33. Contrôler positivement l’inflammation est le travail de toute une vie, ou plus précisément le fruit des comportements de toute une vie. Je vais vous développer ici les solutions nutritionnelles que je vous recommande vivement dans un contexte d’urgence, celui associé au Covid-19. Il est bien sûr dramatique au regard du nombre de décès. Toutefois, nous pouvons aussi considérer cette situation comme une opportunité. Celle de se poser foncièrement la question de l’impact de nos choix de vie sur notre santé. Vous le percevez certainement comme moi, le changement de conscience collective s’accélère, de nouvelles attentes émergent et c’est la moitié pleine du verre. Et l’alimentation mérite d’y occuper une place centrale.
Les conseils que je vous partage ici sont simplement le fruit de mon expérience. Voilà désormais plus d’une semaine que je travaille à compiler toutes les données pour vous les partager ici. Si vous lisez l’intégralité de l’article, vous constaterez que des centaines de publications sont citées, y compris les plus récentes. J’aurais pu vous proposer un concert à domicile, mais si je suis certain d’une chose, c’est que ça n’aurait pas été un cadeau ! Plus sérieusement, écrire cet article est une façon d’apporter ma pierre à l’édifice. J’espère de tout cœur que ces conseils vous seront utiles dans un moment où (re)centrer l’humain au cœur des priorités devient essentiel.
Je vous propose deux niveaux de lecture. Une première partie, synthétique et pratique, si vous souhaitez aller à l’essentiel et une seconde, plus documentée, pour les plus curieux d’entre vous.
Bonne lecture et… Prenez-soin de vous et de vos proches !
Quelle alimentation adopter au quotidien ?
La priorité est bien sûr de conserver une alimentation équilibrée, confinement ou pas. Il n’existe à ce jour pas de pénurie d’approvisionnement, c’est donc tout à fait possible. En lisant les 10 points clés, peut-être allez-vous vous dire que, finalement, ils sont similaires à ceux évoqués habituellement et foncièrement vous aurez raison. Les conseils que je vous propose ont en effet pour objectif de contrôler positivement l’inflammation de bas-grade, ils sont donc d’autant plus valables dans le contexte actuel. Pour autant, ces points clés ne sont pas écrits par hasard, ils représentent la synthèse de tout ce qui est développé par la suite. Chaque aliment proposé est justifié dans le but d’optimiser votre immunité.
Les 10 points clés pour votre immunité
1. Chouchoutez votre microbiote intestinal
Il s’agit en effet de LA priorité nutritionnelle. Le microbiote joue un rôle essentiel dans la maturité du système immunitaire et dans la modulation de l’inflammation. Plusieurs études récentes mettent en évidence un lien possible entre certains récepteurs présents au niveau de l’épithélium pulmonaire mais aussi intestinal.
2. Privilégiez une alimentation à dominante végétale, la plus riche possible en antioxydants
Les antioxydants sont essentiels pour prendre soin du microbiote intestinal et contrôler le stress oxydatif, donc l’inflammation. Le modèle méditerranéen reste plus que jamais la référence. A l’inverse, la consommation de viande en particulier est à limiter au profit des œufs, du poisson et de la volaille, le tout de manière modérée pour des raisons nutritionnelles autant qu’environnementales. Attention, viande ne signifie pas protéines. En effet, il est essentiel de préserver vos apports en protéines car tout votre système immunitaire est fondé sur celles-ci (autant les cellules immunitaires que les anticorps et les cytokines produites). Vous retrouverez tous mes conseils sur les apports en protéines par ici si besoin : Comment optimiser vos apports en protéines ?
3. Privilégiez les aliments à faible charge glycémique
La charge glycémique permet de quantifier les variations du taux de sucre (la glycémie) dans le sang. Une alimentation à faible charge glycémique fait partie des piliers de l’alimentation-santé, avant tout car elle limite la sécrétion d’insuline de manière chronique favorisant l’inflammation pernicieuse et elle aider à réguler le poids en cette période de confinement. Pour plus d’infos, voir mon article : Pourquoi adopter une alimentation à faible charge glycémique ?
4. Préférez la cuisson à la vapeur douce
C’est le meilleur moyen de préserver les vitamines et les antioxydants présents dans les aliments. À l’inverse, le roussissement ou le brunissement des aliments (produisant des corps de Maillard) favorise le stress oxydatif (plus d’info ici). Donc, moins votre aliment est coloré par la cuisson, mieux c’est !
5. Faites la part belle aux graisses de qualité, notamment aux oméga 3
Les oméga 3 permettent de contrôler positivement l’inflammation et de prendre soin du microbiote intestinal, à l’inverse des oméga 6. Ils jouent également un rôle positif sur l’immunité.
6. Privilégiez une alimentation d’origine biologique et sans contaminants
Les contaminants, en particulier les pesticides et autres biocides, sont reconnus pour être des composés « immunotoxiques ». En d’autres termes, ils altèrent le fonctionnement de l’immunité.
7. Le jeûne intermittent, oui et non
Si vous pratiquez déjà le jeûne intermittent et que vous n’avez pas perdu de poids depuis plusieurs mois, c’est une habitude tout à fait adaptée pour mieux contrôler l’inflammation et soutenir l’immunité. Le cas échéant, je vous déconseille d’initier seul (sans accompagnement par un professionnel formé) un tel changement dans cette période particulière.
8. Quid du régime cétogène ?
Les études ne sont pas unanimes sur le sujet. Certains facteurs semblent positifs pour l’immunité, d’autres moins. Si vous suivez un régime cétogène depuis plusieurs mois, que vous n’avez pas remarqué d’altération de votre santé, de perte de poids, de fonte musculaire ou de baisse de vitalité, il n’y a aucune raison de ne pas le poursuivre. Si ce n’est pas le cas ou si vous n’avez pas encore initié ce régime, je vous déconseille de le débuter ou de le poursuivre dans de telles conditions.
9. Alcool, plus que jamais avec modération
Comme vous devez vous en douter, une consommation excessive d’alcool, surtout de manière chronique, altère le fonctionnement du système immunitaire. Une consommation modérée (1 à 2 verres de vin rouge par jour) semble toutefois, si ce n’est exercer des effets bénéfiques, au moins ne pas porter préjudice à l’immunité sauf en cas d’infection, chez les personnes âgées et/ou fragilisées au niveau immunitaire.
10. Prenez soin de votre hygiène de vie
– Le sommeil est un des piliers de votre immunité. Il doit être priorisé, notamment dans cette période de confinement où il est plus facile de se désynchroniser de nos rythmes habituels, voire de se coucher plus tard après avoir regardé la télévision (ou au mieux lu un livre).
– L’activité physique ? Grande question. Évidemment, pratiquer une activité est bénéfique pour votre immunité. Mais confinement oblige, il faut s’adapter. Des exercices adaptés à votre état physique, 20 à 30min par jour avec des variations d’intensité, sont conseillés. Idéalement bien ventiler la pièce, voire pratique dans votre jardin ou sur un balcon si vous en avez un.
– Restez zen. Ce conseil est plus ou moins évident à suivre dans ce contexte particulier et en fonction de la situation de chacun. Il est toutefois bien établi que le stress psychologique altère l’immunité et qu’à l’inverse, des pratiques comme la méditation ou les pensées positives, la renforcent.
– Le tabac. Si vous le pouvez, c’est le moment pour arrêter de fumer car c’est un facteur de risque connu envers les infections respiratoires.
Reste la question de la disponibilité des aliments pendant cette période de confinement. A ce jour, il n’y a pas de pénurie. Une question se pose concernant les fruits et les légumes dans les semaines à venir compte tenu du manque de main d’œuvre pour les récolter (ce qui nous ramène aux questions de fond sur la gestion de la chaîne alimentaire, mais c’est un autre sujet). Le surgelé est pour l’instant une solution optimale pour s’approvisionner. Voici quelques conseils complémentaires simples quand vous rentrez de vos courses pour limiter les risques de propagation en cette période d’isolement :
- Si possible, au delà de vous lavez les mains, laissez l’épicerie dans une autre pièce (garage, buanderie) au moins une journée et ne déposez pas vos sacs sur une table ou un plan de travail.
- Laissez tremper tous vos fruits et légumes avec de l’eau et du vinaigre.
- Nettoyez les emballages que vous entreposez, surtout au réfrigérateur (avec de l’eau vinaigrée).
- Encore une fois, bannissez les produits ultra-transformés, surtout les biscuits et confiseries, c’est le meilleur moyen de ne pas vous laissez tenter en période de confinement face à l’ennui…
- Mangez brut (non transformé), bannissez les produits ultra-transformés et les produits céréaliers raffinés (pâtes, riz et pain blanc).
- Prenez le temps de bien mastiquer, surtout les produits animaux.
- Privilégiez les végétaux prébiotiques et variez votre alimentation. S’il existe bien un consensus scientifique quant aux aliments que vous pouvez privilégier pour prendre soin de votre microbiote intestinal, ce sont les aliments prébiotiques. Les fruits, les légumes et les céréales complètes représentent la source principale grâce à leur richesse en fibres fermentescibles. Les aliments qui en contiennent le plus sont les bananes, les artichauts, l’ail, les oignons, les topinambours, le potiron, les poireaux, les asperges, les salsifis, les feuilles de chicorée, le seigle complet.
- Consommez des aliments riches en polyphénols, en flavonoïdes et en quercétine : oignons (surtout rouges et idéalement crus selon tolérance), ail (de préférence cru ou mariné/confit dans l’huile), câpres, choux (dont le brocoli), poireaux, épinards, pommes, petites baies colorées (mûres, myrtilles, framboises, etc.), agrumes, thé vert bio, chocolat riche en cacao (70% mini, 85% idéalement), café (2 à 3 maximum par jour), gingembre, curcuma (avec de l’huile).
- Privilégiez les fruits et légumes les plus frais possible (dans la mesure du possible) et de saison, crus selon tolérance digestive ou cuits à la vapeur douce (ne pas roussir les aliments). Les arroser de jus de citron.
- Préférez les fruits et légumes surgelés aux conserves ou aux produits plus ou moins frais.
- Pensez aux aliments lactofermentés : légumes lactofermentés, kéfir, komboucha, pain au levain 100% à fermentation longue, etc. La quantité à consommer est à adapter selon votre propre sensibilité intestinale.
- Les aliments contenant de l’amidon résistant sont intéressants : grains de céréales entiers, sarrasin, légumineuses, riz consommé froid après cuisson.
- Bien faire tremper vos légumineuses, au moins 12h (y compris les lentilles) avant cuisson et bien les cuire.
- Si vous souffrez de troubles digestifs, de maladie auto-immune ou inflammatoire chronique : évitez les pommes de terre, tomates, aubergines, poivrons, arachides et noix de cajou. Selon votre situation individuelle, envisager de réduire voire arrêter les produits à base de gluten et de produits laitiers animaux (voir mon article 6 bonnes raisons d’arrêter le gluten).
- Privilégiez les graisses de qualité : Au moins 2 cuillères à soupe d’huile de colza vierge première pression à froid conservée au réfrigérateur (maximum 3 mois) crue en assaisonnement, 1 à 2 cuillères à soupe d’huile d’olive vierge extra, des petits poissons gras y compris en boite 2 fois par semaine (sardines, maquereaux, anchois), des noix, des amandes et des noisettes chaque jour (au moins 60g dont 30g de noix), des œufs issus de la filière bleu blanc cœur si vous n’avez pas de poulailler (idéalement 1 à 2 œufs coque ou mollet au petit déjeuner). Il est important que les aliments riches en oméga 3, et surtout les compléments alimentaires, soient le moins soumis possible à l’oxydation, au risque d’augmenter fortement le stress oxydatif. Voir mes conseils et précautions d’achat.
- Limitez votre consommation de viande (et non de protéines), surtout d’élevage intensif au profit de la volaille, du poisson et des œufs. Privilégiez les filières courtes dont les animaux ont été élevés au foin, dans les pâturages ou de la filière bleu blanc cœur. Au regard de l’importance du zinc, veillez à conserver une consommation de produits animaux ou alors vous supplémenter (voir les conseils dédiés).
- Optez pour une alimentation la plus pauvre possible en contaminants et molécules chimiques : origine biologique voire idéalement de biodynamie, supprimer tous les édulcorants de votre alimentation et de manière générale les additifs au maximum (notamment le carboxymethylcellulose E466 et le polysorbate 80 E433). L’alimentation brute et locale a plus que jamais du sens dans le contexte actuel. Évitez les produits cosmétiques contenant du dioxyde de titane E171, les composés plastiques contenant des bisphénols ou des phtalates (voir chapitre sur les contaminants). Utilisez des poêles et casseroles en inox, pas en Téflon (surtout pas rayé) ni en aluminium.
- Limitez (si vous le pouvez) le recours aux antibiotiques et surtout aux anti-inflammatoires : demandez conseil à votre médecin. Si vous êtes diabétique, à risque cardiovasculaire ou si vous avez un traitement contre l’hypertension artérielle : interrogez votre médecin sur l’intérêt de changer votre traitement.
Compléments alimentaires : Lesquels sont utiles ? Dans quelles situations ?
Après le papier-toilette, les compléments alimentaires
Les compléments alimentaires connaissent eux-aussi, après les gels hydroalcooliques et le papier WC, leur heure de gloire. A qui sert cet engouement ? A en croire les ruptures de stock de la plupart des laboratoires et les messages jouant du marketing de la peur sous couvert d’arguments pseudo-scientifiques, avant tout à l’économie du complément alimentaire. Or n’est-ce pas justement une des leçons à tirer de la situation actuelle ? Quelle est la véritable place de ces compléments alimentaires ? Je ne remets pas ici en question l’intérêt possible d’une supplémentation dans un contexte infectieux, je suis le premier convaincu de l’importance de certains micronutriments et je vais d’ailleurs vous faire part de mes recommandations. Toutefois, pourquoi se ruer sur de la vitamine C si c’est pour continuer à manger des produits ultra-transformés, des biscuits secs à la pizza surgelée, en passant par le coca et les Pringles ? Je provoque (un peu) mais n’oublions pas que le but d’un complément alimentaire n’est pas de s’absoudre des principes fondamentaux d’une alimentation respectueuse de la santé, à savoir brute, locale, de saison et d’origine biologique ou contrôlée. On le découvre chaque jour un peu plus encore, la synergie d’action entre les différents micronutriments et le respect de l’intégrité de la matrice alimentaire sont des facteurs au moins aussi, si ce n’est plus importants que le micronutriment lui-même. Je pourrais également longuement vous parler de ce sujet passionnant qu’est l’épigénétique (une autre fois !). Donc, mon conseil est de ne pas tomber dans le piège de la pilule miracle, surtout quand il est subtilement orchestré par des intérêts économiques. Nous réagissons pour la plupart de la même façon. Face à une menace, nous cherchons toutes les solutions possibles pour mieux y faire face. Dans le cas du Covid-19, les compléments alimentaires font partie de l’arsenal des outils à notre disposition et il est plus simple de commander des compléments alimentaires sur internet que de rester confiné. Un tel acte contribue également à se rassurer et c’est en soi une très bonne chose. Certes. Pour autant, ces compléments alimentaires ne doivent pas nous détourner de la priorité nutritionnelle : la qualité de ce que nous mettons dans notre assiette au quotidien.
Les 3 produits que je recommande à tout le monde en prévention (surtout si vous avez plus de 60 ans) et par ordre de priorité
1. Vitamine D
Indéniablement, la vitamine D est LA vitamine prioritaire pour optimiser le fonctionnement immunitaire, en particulier en cette période de sortie hivernale. Les études et méta-analyses ayant démontré son intérêt sont nombreuses et fiable. En pratique :
- Je vous recommande un apport quotidien de 1000 à 3000 UI/j pour optimiser la réponse immunitaire (à pendre idéalement le soir), il sera plus efficace qu’une prise occasionnelle plus élevée sous forme d’ampoule. L’idéal serait de connaitre votre taux actuel pour adapter la posologie.
- Si vous savez que vous êtes déficitaire à la suite d’une prise de sang, si vous êtes positif au test ou si vous avez plus de 60 ans, je vous recommande plutôt la dose de 75 UI par kg de poids corporel par jour.
- Chez l’enfant (entre 1 et 5 ans : 400 UI/j. Il n’a pas été démontré d’effets bénéfiques supérieurs d’une forte dose (2000 UI vs 400 UI).
2. Zinc
A l’image de la vitamine D, le zinc est LE minéral du système immunitaire. En pratique :
- Réaliser idéalement une prise de sang pour vérifier votre taux (zinc érythrocytaire).
- Au regard de son importance dans le fonctionnement immunitaire, si vous êtes à risque immunitaire, végan ou végétalien, si vous avez plus de 60 ans, voire à titre préventif, je vous recommande 10 à 15 mg de bisglycinate de zinc. Attention aux excès, délétères. Ne pas dépasser cette dose sans recommandation professionnelle.
- En savoir plus sur le zinc : Comment optimiser son statut en Zinc.
3. Vitamine C
Les bénéfices préventifs de la supplémentation en vitamine C sont surtout valables pour les personnes déficitaires en vitamine C (soit une majorité de la population au regard de l’alimentation spontanée) ou « à risques » : faibles consommateurs de fruits et légumes frais, personnes âgées, fumeurs, personnes souffrant de maladies inflammatoires chroniques ou auto-immunes.
En pratique, je vous recommande 1 à 2 grammes par jour, à répartir idéalement en 5 prises dans la journée. Les formes « basiques » de vitamine C, idéalement de l’ascorbate de sodium ou de calcium, à défaut de l’acide ascorbique sont tout à fait adaptées. Les formes dites retard et liposomales sont très coûteuses au regard du peu de bénéfice attendu. De même, les compléments alimentaires associant de la vitamine C avec des flavonoïdes ne sont pas nécessaires, la synergie d’action ne valant que lorsque ces composés sont intégrés dans une matrice alimentaire, donc dans un aliment. Les comprimés d’acérola peuvent être une solution mais attention à bien vérifier la teneur en vitamine C. Par ailleurs, de nombreuses marques rajoutent de l’acide ascorbique à des extraits d’acérola titrés en vitamine C. C’est de l’abus de confiance.
En complément de la nutrition, selon votre sensibilité immunitaire
4. Échinacée
1 cuillère à café dans un peu d’eau 1 à 2 fois par jour.
5. Propolis
20 gouttes, 3 fois par jour, de teinture mère (1 goutte par kg de poids corporel par jour).
N.B. L’huile essentielle de Ravinstara est également conseillée à titre préventif
Je pourrai également proposer le Magnésium au regard de ses rôles dans le métabolisme énergétique, y compris antiviral (voir mon article sur le sujet).
En complément (par ordre de priorité) : si vous souffrez du syndrome du côlon irritable, d’une maladie auto-immune ou inflammatoire chronique ou si vous êtes fragilisé au niveau immunitaire.
1. Probiotiques
Pour bien comprendre leur intérêt, je vous invite à découvrir mon article complet sur le sujet : Comment bien choisir ses probiotiques ?. En pratique :
- L’action des probiotiques est intéressante avant tout sur le long terme, au moins pendant 3 mois 5 jours par semaine.
- 10 à 20 milliards, 15min avant le petit déjeuner (à conserver au réfrigérateur).
2. Quercétine
Contrairement à ce que véhiculent certains sites internet, la quercétine, même si elle représente l’antioxydant de choix dans le contexte de coronavirus, n’est pas LA molécule miracle.
En pratique :
- Au regard du contexte et surtout si vous consommez peu de fruits et légumes, une supplémentation à hauteur d’1g par jour (500mg midi et soir) au cours du repas se justifie.
- Associer systématiquement des végétaux riches en flavonoïdes et boire du thé au cours de la journée.
3. Glutamine
La glutamine est intéressante dans le cadre de l’immunité à double titre. D’une part, il s’agit d’un modulateur important de la fonction des cellules immunitaires. D’autre part, les cellules intestinales garantes de l’intégrité de la muqueuse en ont également besoin. En pratique :
- 5g par jour pendant 1 à 2 mois.
4. Champignons japonais (maïtaké, reishi, shiitake, cordyceps)
Ces champignons japonais sont riches en certains composants de la famille des polysaccharides particulièrement intéressants pour soutenir l’immunité : les bêta – (1,3/1,6) – glucanes.
En pratique :
- Vous pouvez consommer des champignons dans votre alimentation mais les quantités de béta-glucanes consommés sont faibles.
- 3 gélules de 500 mg par jour d’extraits standardisés pendant un repas.
Si vous prenez un traitement médicamenteux, si vous fumez, si vous buvez beaucoup d’alcool, si vous êtes fortement exposé à des polluants ou si vous mangez très peu de fruits et légumes.
N-Acetyl-Cystéine (NAC) + glycine
Le glutathion est un acteur majeur du soutien immunitaire. Toutefois, la forme active (le glutathion réduit) proposée en complément alimentaire est non seulement particulièrement onéreux mais surtout fortement dégradé dans l’intestin. En pratique, je vous recommande plutôt :
- 500 milligrammes à 1g par jour de N-acétyl-cystéine (NAC) associée à 5 à 10g de glycine390 permettent au corps de fabriquer son propre glutathion.
Supplémentation envisageable après avoir objectivé le déficit par analyse de sang (attention aux excès)
Vitamine A
- 600 à 800 ug par jour.
Vitamine E
- Peut-être proposée systématique à la personne âgée de plus de 65 ans.
- Privilégier une forme naturelle contenant tous les isomères de vitamine E (pas uniquement de l’alpha-tocophérol) à hauteur de 15 à 30mg par jour.
Sélénium
- 50 à 75 µg par jour sous forme de L-sélénométhionine.
Fer
- Il est essentiel de vérifier votre ferritine par une prise de sang en dehors de toute période d’inflammation (si tel est le cas, demandez plutôt à votre médecin le dosage du récepteur soluble à la transferrine). Je vous déconseille vivement de consommer des compléments alimentaires contenant du fer sans avoir vérifié que vous en manquez, type multi-minéraux « tout en un ». De même pour le cuivre.
- 14 à 28 mg par jour selon tolérance digestive.
- Vitamine D : 75 UI/k poids corporel/j + Vitamine C : 200 mg toutes les 1 à 2 h + Vitamine B6 : 2 mg / jour, voire 20mg de Pyridoxal-5-phosphate (P5P) en cas de déficit identifié.
- Zinc : 20 mg/j
- Glutamine : 10g par jour
- Quercétine : 2x500mg 2 fois par jour
- Champignons riches en bêta-glucanes : 2×500 mg 2 fois par jour
+ Selon les situations :
- NAC + glycine selon la situation
- Artémisia (Artemisia annua)
Artemisia annua est une plante traditionnellement utilisée en médecine chinoise et reconnue pour son action antiparasitaire, notamment en cas de paludisme (malaria) ou de babesiose, une des co-infections de la maladie de Lyme. Il n’existe pas d’étude significative des effets d’Artemisia Annua sur le coronavirus. Toutefois, au regard de ses effets particulièrement intéressants sur d’autres infections virales, compte tenu des résultats préliminaires obtenus avec l’hydroxychloroquine (Plaquenil) même si le mécanisme d’action est différent, c’est une piste à ne vraiment pas négliger à mon sens. En pratique :
– Elle peut être utilisée en infusion (de préférence dans du lait entier que dans de l’eau, à adapter selon votre tolérance laitière), en teinture mère, en poudre (gélule), en jus de plante fraîche (1 cuillère à soupe par jour en utilisant un extracteur) ou en macération à froid.
– En cas d’infection, l’important est de consommer l’ensemble des principes actifs à hauteur d’environ 5g par litre. Vous pouvez par exemple boire cette quantité chaque jour ou consommer 3 fois 500 mg en gélules matin, midi et soir pendant 7 à 10 jours, puis réduire la prise à 1,5g par jour 2 semaines par mois (pas de prise continue).
– Cette plante n’est actuellement pas autorisée en France sous forme de complément. Si vous souhaitez la cultiver vous-même, je vous recommande les conseils de l’herbaliste Christophe Bernard.
- Renouée du Japon
Plante herbacée cultivée en Chine, Corée, Japon et Sibérie, la renouée du Japon est une plante de référence dans le cadre de la maladie de Lyme. Elle semble également dotée d’effets antiviraux ayant fait l’objet de plusieurs études in vitro relatives à la grippe, à l’Herpès, au coxsackie, à l’hépatite B, à l’EBV. En pratique :
– 4 x 500 mg par jour
- N.B. L’huile essentielle de Laurier Noble est proposée en aromathérapie. Les HE de cannelle (écorce), de Thym à thymol et de Giroflier peuvent également être envisagés (attention, particulièrement agressives, elles sont à utiliser après conseil auprès d’un professionnel formé).
En conclusion de cette première partie
Voici donc les principaux conseils que je peux vous partager concernant la gestion nutritionnelle de cette période si particulière qu’est le confinement associé à l’épidémie de coronavirus. Encore une fois, une partie de cet article est dédiée à la présentation des intérêts et des limites des compléments alimentaires sur la base des données de littérature scientifique, ce qui ne signifie en rien qu’il faille les considérer comme une priorité. Ce sont bien des « compléments » à l’alimentation. Aussi utiles soient-ils pour soutenir l’immunité en cette période, je vous invite à les laisser à leur juste place pour centrer la priorité sur vos choix alimentaires. Attention aux sirènes d’internet…
Que puis-je vous préciser en conclusion si ce n’est de vous inciter à nouveau à prendre soin de vous, de vos proches et de profiter de cette « opportunité » pour évoluer vers un mode de vie respectueux de notre santé, la nôtre, celle de nos enfants et de notre planète ? Car, même si ce sujet passe à juste titre au second plan en cette période de médecine de guerre, la préservation de l’environnement demeure l’enjeu de fond. Je n’irai pas jusqu’à dire que ce qu’il nous arrive est la conséquence de nos comportements et que la mortalité liée au Covid-19 apparait bien mineure au regard d’autres crises sanitaires et alimentaires catastrophiques dans le monde. Je n’en ai pas la compétence et d’autres le font déjà. Néanmoins, les personnes les plus âgées sont aujourd’hui les plus fragilisées face à cette situation. Alors, faisons-en sorte, par nos décisions mais aussi et surtout par nos actes, que nos enfants ne le soient pas dans les années à venir.
Si vous souhaitez découvrir en détails les justifications de mes conseils, vous trouverez tous les détails dans cette seconde partie, destinée aux plus avertis.
L’écosystème intestinal est au cœur de votre immunité
Il s’agit en effet de LA priorité nutritionnelle34. Je parle bien ici d’écosystème et non pas uniquement de microbiote. Celui-ci est constitué d’environ 100 000 milliards de bactéries, mais aussi de levures et de virus, notamment ce que l’on nomme des bactériophages, environ 10 fois plus nombreux que les bactéries. D’après une étude publiée dans Nature en 201035, l’information génétique présente dans notre intestin – le métabolome – est 150 fois plus importante que le génome humain. Environ 160 espèces de bactéries différentes (1000 selon certains auteurs) colonisent le microbiote intestinal36. Les grandes familles – les phyla microbiens – sont pour 90% des Firmicutes (bactéries dites gram-positif) et des Bacteroidetes (bactéries dites gram-négatif)37. Viennent ensuite les Actinobactéries, les Protéobactéries, les Fusobactéries et les Verrucomicrobies.
La muqueuse intestinale
L’intestin constitue la surface privilégiée des échanges entre l’environnement et le monde intérieur. La muqueuse intestinale ne représenterait d’ailleurs pas moins de 300m2 de surface ! Une étude de 2014 semble néanmoins relativiser ce chiffre, considérant que la surface serait en réalité de… 32m238. Une telle erreur (d’un facteur 10) serait liée au fait que le calcul aurait été extrapolé à partir de mesures réalisées historiquement sur des individus décédés. Quoi qu’il en soit, l’intestin demeure une zone d’échange considérable. La muqueuse est composée de plusieurs types de cellules. La principale est l’entérocyte, constitué des microvillosités en charge d’assimiler les nutriments (glucides, lipides, protéines) et les micronutriments (vitamines, minéraux, oligoéléments, actifs végétaux, etc.). Cette cellule joue un rôle essentiel dans la mesure où, d’une part elle est responsable de l’assimilation, d’autre part elle garantit l’étanchéité entre le milieu intérieur et le milieu « extérieur », à savoir la lumière de l’intestin, d’où son nom de barrière intestinale. La muqueuse intestinale assure donc une perméabilité sélective. Toutefois, ses rôles ne s’arrêtent pas là. Elle assure également la sécrétion de mucus permettant de la protéger contre l’acidité gastrique, elle produit de nombreux peptides et hormones gastro-intestinales grâce aux cellules dites entéro-endocrines qui valent à l’intestin le surnom de second cerveau ou système nerveux entérique. Et, pour ce qui nous intéresse ici, elle module l’immunité.
L’écosystème intestinal est un double acteur immunitaire. La muqueuse et le microbiote garantissent avant tout une protection physique contre les agents pathogènes. Il s’agit de la première ligne de défense. Par ailleurs, cet écosystème va déterminer en partie la façon dont l’immunité est capable de réagir face aux microbes. Il est donc indispensable que le système immunitaire puisse instaurer un dialogue harmonieux entre les cellules et les bactéries du microbiote intestinal, au risque de créer une véritable zizanie aux conséquences potentiellement graves pour la santé. Pour ce faire, la muqueuse intestinale dispose d’une véritable armée :
- Les cellules de Paneth sont des cellules spécialisées, en charge de produire des composés antimicrobiens tels que le lyzozyme, les défensines ou encore le Reg3y.
- Les plasmocytes, présents dans la lamina propria, un tissu conjonctif tapissant la muqueuse, vont produire de très grandes quantités d’anticorps pour assurer la production de composés essentiels à la protection de l’organisme : les IgAs ou Immunoglobulines sécrétoires de type A, plus nombreuses que la somme de tous les autres anticorps produits par l’organisme !
- Les cellules dendritiques assurent un lien immunitaire entre le milieu intérieur et la lumière de l’intestin.
- Les plaques de Peyer sont des structures spécifiques situées dans la partie terminale de l’iléon. Il s’agit d’un ensemble de follicules lymphoïdes d’un diamètre de 5 à 6 mm, composés essentiellement de cellules immunitaires (notamment des lymphocytes B et T impliqués dans la réponse dite adaptative) et au contact d’une autre catégorie de cellules de la muqueuse intestinale, les cellules M. Des ganglions lymphatiques et d’autres follicules lymphoïdes isolés complètent la sentinelle immunitaire. Il existe par ailleurs de très nombreuses cellules circulantes comme les macrophages et les neutrophiles impliquées dans la réponse immunitaire innée.
Cette organisation, complexe (simplifiée ici), représente la principale ligne de défense immunitaire organisée de l’organisme contre les agents pathogènes. On considère (de manière empirique), qu’environ 70% de l’immunité est en contact avec la sphère intestinale39. Pour assurer un fonctionnement optimal, ces cellules communiquent certes entre elles, mais aussi avec le microbiote intestinal et avec l’ensemble de l’organisme grâce à des messagers dont je parle très régulièrement : les cytokines. Il en existe de très nombreuses (environ 60), chacune jouant un rôle spécifique permettant de transmettre une information ciblée aux autres cellules.
La nature des cytokines produites par le système immunitaire dépend en partie de la nature des bactéries présentes dans le microbiote intestinal, mais aussi de l’intégrité de la muqueuse intestinale. En effet, le système immunitaire peut reconnaitre, grâce à des récepteurs spécifiques (TLR et NLR) présents notamment sur les macrophages, certains composés de parois de bactéries ou de virus, les lipopolysaccharides ou LPS (et dans une moindre mesure des protéoglycanes, des flagellines ou de l’ATP qui n’a rien à faire dans un espace extracellulaire). Cette reconnaissance va initier la production de composés chimiques par les macrophages afin de tuer le microbe grâce à un stress oxydatif majeur et à la sécrétion de messagers inflammatoires, les cytokines (ou chimiokines), destinés à appeler en renfort les autres cellules immunitaires. Au-delà de transmettre l’information, ces messages sont à l’origine de l’inflammation, dont le but est d’accélérer le flux lymphatique pour transporter les microbes ou les cellules infectées vers les tissus lymphoïdes. La présence de ces composés peut être due à des agents pathogènes mais aussi au microbiote intestinal. En effet, certaines de ces bactéries en contiennent (ou produisent des molécules en contenant), alors reconnus par les récepteurs TLR (notamment TLR2 et TLR4) et les NOD40–43 des cellules immunitaires. En cas de présence accrue de ces composés dans le sang, il peut en résulter une activation du système immunitaire, donc une inflammation augmentant la perméabilité de la muqueuse. C’est ce que l’on nomme plus communément l’hyperperméabilité intestinale (HPI) ou endotoxinose44–50. Un tel mécanisme représente malheureusement un véritable cercle vicieux. Si la muqueuse devient plus perméable, elle va en effet laisser passer davantage de LPS, ce qui aura pour conséquence d’accroitre l’inflammation, qui va elle-même augmenter la perméabilité, etc. Vous avez compris l’histoire. Or un tel cercle vicieux inflammatoire peut avoir des conséquences systémiques importantes, bien au-delà de la sphère digestive. Les cytokines ainsi produites peuvent en effet agir sur de nombreux organes, notamment le cerveau, le foie, les reins ou encore le pancréas et « emballer » le système51,52. Il est désormais bien établi que cette inflammation pernicieuse issue du microbiote, de bas-grade, favorise l’émergence de pathologies inflammatoires chroniques, neurodégénératives, de cancers ou encore de maladies auto-immunes41,53,54. Et ce n’est pas tout, la présence chronique de ces composés microbiens influence même le métabolisme énergétique de l’homme, en augmentant notamment l’insulino-résistance, donc les risques d’obésité, de diabète, de stéatose hépatique mais aussi de la plupart des maladies de civilisation55–64. Il s’agit donc d’un mécanisme particulièrement important à appréhender. D’une part, il permet de mieux comprendre le mécanisme à l’origine de la réponse immunitaire en cas de passage de bactéries pathogènes, mais aussi de molécules considérées comme potentiellement dangereuses par le système immunitaire, y compris des peptides alimentaires ou des protéines du soi. L’actualité autour de l’intérêt à réduire voire à supprimer le gluten et les caséines laitières est un exemple65–69 (voir mon article sur le sujet). D’autre part, il met en évidence les conséquences possibles d’une perturbation du microbiote intestinal, ce que l’on nomme une dysbiose, sur l’équilibre du système immunitaire et sur la santé de manière générale.
A l’inverse, un microbiote sain participe à la régulation de la différenciation des cellules immunitaires70. Il est notamment à l’origine d’une production importante d’acides gras à chaîne courte (butyrate, acétate, propionate) particulièrement bénéfiques sur le contrôle de l’inflammation et de l’immunité. Ils favorisent en effet la différenciation des lymphocytes T vers la voie des lymphocytes T régulateurs, donc vers un meilleur contrôle de l’inflammation 1,2. Et l’histoire ne s’arrête pas là. Nous avons en effet évoqué que les IgAs produites et présentes dans le mucus de la barrière intestinale représentent une ligne de défense immunitaire majeure. Or il existe une interconnexion étroite entre ces IgAs et le microbiote intestinal. Leur présence module la composition du microbiote et, inversement, un microbiote de qualité permet de favoriser une sécrétion adaptée d’IgAs71–75. Les bactéries du microbiote interagissent également avec les lymphocytes T régulateurs pouvant, en cas de perturbation immunitaire, être à l’origine de réponses inflammatoires chroniques, voire auto-immunes76,77. De plus, une alimentation favorisant la dysbiose peut activer certaines cellules immunitaires intestinales, les microglies, et stimuler la voie TH17 augmentant l’inflammation chronique et les risques de pathologies auto-immunes telles que la sclérose en plaques78.
Vous l’aurez donc compris, l’intégrité de l’écosystème intestinal est essentielle, autant pour renforcer son immunité afin de se protéger et mieux se défendre d’une infection, que pour éviter une réponse exacerbée des cellules immunitaires à l’origine d’inflammations chroniques, d’hypersensibilités alimentaires, voire d’allergies ou de pathologies auto-immunes.
Une étude récente parue le 3 Mars 2020 dans la revue Cell précise les effets possibles du microbiote sur les risques de surinfection bactérienne à la suite d’une infection virale de type grippal (H1N1 et H3N2)1. Chez les souris grippées, la quantité de bactéries productrices d’acides gras à chaîne courte a diminué à la suite de l’infection. A l’inverse, les bactéries potentiellement pathogènes comme E. Coli ont augmenté. Après 14 jours, le microbiote est revenu à sa composition initiale. Toutefois, les souris infectées par le virus ont montré une fragilité plus importante envers des bactéries comme le pneumocoque. Lorsque le microbiote des souris infectées par le virus a été implanté à des souris saines, celles-ci sont également devenues plus sujettes au risque de surinfection bactérienne. L’acétate, un des acides gras à chaîne courte, semble le plus impliqué sur les cellules immunitaires pulmonaires (plus précisément en se fixant sur le récepteur GPR43 des macrophages).
Par ailleurs, comme j’ai pu l’évoquer en introduction, environ 10% des patients atteints du Covid-19 souffrent de troubles digestifs, notamment de diarrhées. Plusieurs auteurs indiquent que les récepteurs à ACE2 sont essentiellement situés au niveau de l’épithélium intestinal15, donc que le Covid-19 pourrait interagir avec le microbiote intestinal16. Les poumons possèdent également leur propre microbiote et les liens entre les deux organes ne sont pas encore totalement compris. Toutefois, les personnes souffrant d’infections respiratoires présentent généralement des troubles intestinaux. Il a été démontré, dans le cas de la grippe, que la modulation du microbiote intestinal peut réduire la pneumonie et inverser certains effets secondaires des antibiotiques afin d’éviter la réplication précoce du virus de la grippe dans l’épithélium pulmonaire17. La commission nationale de la santé chinoise aurait elle-même soumis la piste du recours à des probiotiques auprès des patients atteints d’une infection grave à Covid-19 dès la 5ième version de ses recommandations18. Il est plus que probable que la qualité du microbiote joue un rôle essentiel dans la réponse immunitaire, raison pour laquelle j’ai souhaité développer les conseils relatifs à cette partie dans l’article.
En pratique : comment optimiser votre immunité en prenant soin de votre microbiote ?
- Prenez le temps de bien mastiquer.
- Privilégiez les aliments prébiotiques et varier votre alimentation.
S’il existe bien un consensus scientifique quant aux aliments que vous pouvez privilégier pour prendre soin de votre microbiote intestinal, ce sont les aliments prébiotiques. Les fruits, les légumes et les céréales représentent la source principale grâce à leur richesse en fibres fermentescibles. Les aliments qui en contiennent le plus sont les bananes, les artichauts, l’ail, les oignons, les topinambours, les poireaux, les asperges, les salsifis, les feuilles de chicorée et le froment. La consommation de psyllium, environ 5g par jour, est également intéressante au-delà d’aider à réguler le transit103.
Les aliments contenant de l’amidon résistant permettent également de développer la production de butyrate et globalement d’acides gras à chaîne courte par le microbiote104–106. Les principales sources sont les graines (grains de céréales entiers), le sarrasin, les légumineuses, les aliments glucidiques contenant de l’amidon rétrograde (riz et pommes de terre consommés froids après cuisson).
- Faites la part-belle aux polyphénols.
Tous les polyphénols sont bénéfiques pour votre microbiote intestinal. Toutefois certains ont été particulièrement étudiés et leurs effets bénéfiques avérés : petites baies colorées (mûres, myrtilles, framboises, etc.), légumes, thé vert, cacao, oléagineux (noix, noisettes et amandes), céréales complètes, café, gingembre, curcuma. Préservez au maximum les propriétés de ces aliments en les consommant les plus frais possible, crus ou cuits à la vapeur et assaisonnés avec de l’huile riche en oméga 3 et 9 (huile d’olive et de colza vierges premières pression à froid). D’autres végétaux sont également bénéfiques, comme par exemple le seigle complet. D’une manière générale, le régime méditerranéen apparait comme un modèle de choix pour votre microbiote. Par ailleurs, varier votre consommation de végétaux vous est plus bénéfique pour diversifier votre microbiote et favoriser les bactéries de qualité que la sélection de tel ou tel aliment107–110. Selon une étude récente, le fait d’être omnivore ou végétarien apparait moins impactant que le niveau de diversité alimentaire111. La mise en place d’un régime végétarien semble surtout moduler la présence de certaines espèces bactériennes favorisant la production d’acides gras à chaine courte, mais elle ne change pas en profondeur la diversité et la richesse du microbiote comparativement à des omnivorses112–115.
- Consommer des aliments lactofermentés
Ils peuvent être considérés comme des probiotiques naturels contribuant à renforcer l’immunité116 : légumes lactofermentés, kéfir, komboucha, cornichons, etc. La quantité à consommer est à adapter selon votre propre sensibilité intestinale, ces aliments pouvant générer des ballonnements. Que ces aliments vous « travaillent » un peu est bénéfique, une telle situation traduit en effet une activité accrue de votre microbiote117,118. Elle doit toutefois rester supportable. Si vous êtes gêné(e), commencez par en consommer de petites quantités, mastiquez bien, puis augmentez progressivement les quantités en fonction de votre tolérance. De même, privilégiez le pain au levain (bio et 100% levain, sans levure) au détriment du pain à la levure, surtout industriel. Attention également à certains aliments dont la production est industrialisée comme la choucroute ou les cornichons peuvent contenir des sulfites. L’idéal est de préparer vous-même les légumes lactofermentés.
- Privilégiez les graisses de qualité
Les acides gras saturés, surtout quand ils sont consommés en excès, ne favorisent pas un microbiote bénéfique pour la santé sauf en cas de régime cétogène prolongé (au moins 6 mois). A l’inverse, l’huile d’olive, les oléagineux comme les noisettes et les noix, les petits poissons riches en oméga 3 (sardines, maquereaux, anchois) ont montré un intérêt dans la diversité du microbiote. Au-delà de leur effet sur le microbiote intestinal, les oméga 3 jouent un rôle positif dans le maintien de l’intégrité de la muqueuse intestinale, autant sous forme végétale (acide alpha-linolénique) que marine (DHA et EPA)119–121. Attention, lorsque ces acides gras sont oxydés, ils peuvent au contraire favoriser la perméabilité intestinale122. Cette étude a toutefois été réalisée à un niveau d’oxydation in vitro non représentatif de l’alimentation actuelle.
- Optez pour une alimentation la plus pauvre en contaminants et molécules chimiques : origine biologique voire issue de biodynamie, supprimer tous les édulcorants de votre alimentation et de manière générale les additifs au maximum (notamment le carboxymethylcellulose E466 et le polysorbate 80 E433). Évitez les produits cosmétiques contenant du dioxyde de titane E171, les composés plastiques contenant des bisphénols ou des phtalates (voir chapitre sur les contaminants). Limitez, lorsque c’est possible, le recours aux antibiotiques ainsi que les anti-inflammatoires.
- Limitez votre consommation de viande, surtout d’élevage intensif.
Privilégiez la volaille et le poisson. Si vous consommez de la viande, la choisir issue d’élevage responsable afin d’améliorer la qualité des graisses, réduire la présence de résidus d’antibiotiques et bien la mastiquer. La consommation d’œuf, contrairement à ce qui est régulièrement évoqué, n’a pas d’impact négatif sur les risques cardiovasculaires en lien avec la production de TMAO par le microbiote intestinal123–125. Bien mastiquer les produits animaux.
- La pratique du jeûne intermittent ou de la restriction calorique semble bénéfique pour le microbiote, notamment si vous souffrez d’obésité.
- Attention aux facteurs antinutritionnels
Les lectines sont des glycoprotéines présentes dans le règne végétal, non attaquables par les enzymes humaines, mais capables d’adhérer à la muqueuse intestinale et ainsi d’augmenter les risques d’hyperperméabilité. Les aliments les plus riches sont les légumineuses (lentilles, pois, fèves, haricots), le soja, les céréales, le quinoa, le sarrasin, la pomme de terre, certains légumes (tomates, aubergines, poivrons)126,127, certaines viandes bovines (races frisonnes (ou Holstein) et British Shorthorn), les arachides et les noix de cajou. La solanine, présente dans les solanacées (contenus notamment dans la pomme de terre, l’aubergine, le poivron et la tomate) est particulièrement agressive pour la muqueuse intestinale128,129. En cas d’hyperperméabilité intestinale, la pomme de terre est donc à éviter. En pratique, faire tremper vos légumineuses (sauf les lentilles corail), voire les oléagineux, les amandes notamment et l’avoine sous forme de porridge, au moins 12 heures avant leur consommation et bien les cuire. Préférez le pain au levain à fermentation longue et si vous les aimez, consommez des graines germées régulièrement.
- Que penser des probiotiques ? Pour bien comprendre leur intérêt, je vous invite à découvrir mon article complet sur le sujet : Comment bien choisir ses probiotiques ? L’action des probiotiques est intéressante avant tout sur le long terme. Je vous recommande en cette période de prendre des probiotiques à hauteur de 10 à 20 milliards, 15min avant le petit déjeuner (à conserver au réfrigérateur), 5 jours par semaine.
Régime méditerranéen, antioxydants et immunité
Je l’ai évoqué en introduction, les antioxydants représentent une des pierres angulaires de la régulation immunitaire. Le modèle méditerranéen est particulièrement bénéfique pour renforcer votre statut130. Au-delà de ses bénéfices multiples sur le microbiote intestinal, notamment grâce aux fibres prébiotiques et aux polyphénols, le régime méditerranéen contribue également à mieux contrôler les paramètres inflammatoires et donc à réduire l’état de fragilité, en particulier chez les personnes agées131,132. Une alimentation riche en végétaux permet par ailleurs de moduler positivement un mécanisme épigénétique et l’inflammation de bas-grade (en réduisant notamment les cytokines IL-6, TNF et IL-1b)133,134. Une des conséquences d’une alimentation inadaptée est de favoriser les taux de LDL-cholestérol, mais surtout son oxydation. Or les LDL oxydés induisent, selon un effet épigénétique, une reprogrammation des monocytes et une production accrue de cytokines pro-inflammatoires135. A l’inverse, une alimentation riche en acides gras mono-insaturés, notamment grâce à l’huile d’olive (un des principes fondamentaux du modèle méditerranéen) impacte positivement les marqueurs de l’inflammation au-delà d’agir favorablement sur le taux de LDL-cholestérol136,137.
Privilégiez les aliments à faible charge glycémique
La charge glycémique permet de quantifier les variations du taux de sucre (la glycémie) dans le sang. Une alimentation à faible charge glycémique fait partie des piliers de l’alimentation-santé, notamment car elle limite la sécrétion d’insuline de manière chronique favorisant l’inflammation de bas-grade138,139. Plusieurs revues systématiques mettent en effet en évidence l’effet d’un régime riche en aliments à charge glycémique élevée sur certains marqueurs de l’inflammation140, en favorisant notamment la sécrétion de médiateurs particulièrement pro-inflammatoires, l’IL-6 et le TNF-alpha141–143, la consommation de produits sucrés et de céréales raffinés en particulier144. Les hyperglycémies chroniques favorisent par ailleurs un mécanisme dont je parle régulièrement, la glycation. Il s’agit d’une réaction entre un sucre (le glucose ou le galactose) et un acide aminé (la lysine) bien connue des cuisiniers dans la mesure où elle génère par exemple le goût caractéristique de la viande grillée ou de la croûte du pain. Toutefois, cette glycation augmente le niveau de stress oxydatif145. Par ailleurs, une inflammation chronique réduit les capacités de l’organisme à éliminer efficacement les produits de la glycation avancée (AGE), diminuant ainsi l’efficience métabolique146. A l’inverse, une alimentation à faible charge glycémique pendant 8 semaines permet de réduire les taux de CRP chez des personnes obèses147.
Indépendamment du contrôle de l’inflammation et du soutien immunitaire, une alimentation à charge glycémique élevée favorise la prise de poids dans un contexte de sédentarité, ce qui est davantage le cas dans une période de confinement.
je vous invite à favoriser une alimentation à faible charge glycémique, notamment en privilégiant les légumineuses, les produits céréaliers complets et les fruits au détriment des produits céréaliers raffinés (pain, pâtes et riz blancs) et des produits ultra-transformés. Par ailleurs, certains aliments, bien que possédant une charge glycémique modérée, sont malheureusement responsables d’une sécrétion d’insuline importante, notamment du fait des protéines qu’ils contiennent. Ces dernières favorisent en effet la sécrétion d’hormones spécifiques (les incrétines, GLP-1 et GIP. Les produits laitiers sont particulièrement concernés)148–150. Vous retrouverez tous mes conseils dans mon article « Pourquoi privilégier une alimentation à faible charge glycémique ? ».
Faites la part belle aux graisses de qualité, notamment aux oméga 3
Selon une étude publiée dans Cell Métabolism en 2018 par l’équipe du Pr Febbraio de l’université de médecine de Sydney, l’excès d’acides gras saturés pourrait être à l’origine d’une inflammation de bas-grade, non pas uniquement par l’induction des récepteurs présents sur les macrophages (TLR4) comme de nombreux auteurs le considèrent toujours, mais par modification du métabolisme de ces cellules immunitaires151. Un seul repas riche en acides gras saturés suffit à faire augmenter les marqueurs de l’inflammation au cours des heures suivantes152.
Vous le savez certainement déjà, les oméga 3 à longue chaîne (EPA et DHA) sont d’importants médiateurs de l’inflammation, en particulier l’EPA. Ils représentent en effet les précurseurs de molécules aux propriétés anti-inflammatoires, notamment les résolvines et les prostaglandines153,154. Les oméga 3 exercent également leur activité positive sur l’inflammation en modulant un récepteur, le GPR120, inhibant plusieurs mécanismes pro-inflammatoires (TLR2 et 4, récepteur au TNF)155.
Point moins connu, les oméga 3 modulent également la réponse immunitaire adaptative, notamment antivirale156,157. Les patients souffrant d’immunodéficience, comme dans le cas du VIH, présentent un déficit dans l’ensemble des oméga 3 à longue chaîne158. Un déséquilibre du ration oméga 3/oméga 6 a également été constaté chez des personnes souffrant de détresse respiratoire159. Selon les auteurs de cette étude, le ratio optimal pour contrôler l’inflammation consécutive à l’infection serait de 1/2, or il était de 1/7 dans cette étude. Il est toutefois délicat d’affirmer un lien de causalité direct à travers ces résultats dans la mesure où ce ratio est perturbé dans la très grande majorité de la population occidentale actuelle. Par ailleurs, la protectine D1, un autre médiateur positif de l’inflammation dérivant du DHA, semblerait réduire la réplication du virus de la grippe160. Les oméga 3 à longue chaîne présentent également une activité antivirale contre l’hépatite C161. Une méta-analyse de 10 études issue de la base Cochrane n’a toutefois pas mis en évidence d’intérêt spécifique d’une supplémentation en oméga 3 et en antioxydants pendant 4 jours sur la mortalité en cas de détresse respiratoire, à l’inverse d’une autre revue systématique162,163. Il s’agit certes ici d’une période trop courte pour en espérer un effet significatif, 3 mois étant en moyenne nécessaires pour que les acides gras soient fonctionnels au niveau membranaire164. Plusieurs études réalisées pendant cette durée ne sont pas pour autant parvenues à influencer de manière significative sur les marqueurs inflammatoires chez des personnes en bonne santé, même après 3 mois et via des quantités significatives (entre 1,4 et 3g par jour)165,166. Même si les études ne sont pas unanimes, cela ne remet nullement en question les bénéfices d’une alimentation riche en oméga 3 de qualité. Pour autant, il n’existe pas d’éléments validés justifiant une supplémentation dans le but spécifique d’optimiser le fonctionnement immunitaire.
Par ailleurs, nous l’avons évoqué précédemment, une alimentation riche en acides gras mono-insaturés (oméga 9) via l’huile d’olive est bénéfique pour le contrôle de l’inflammation136,137. Au-delà de l’huile d’olive, les noisettes sont des aliments particulièrement intéressants pour leur teneur en oméga 9.
Je vous invite à consommer au moins 2 cuillères à soupe d’huile de colza vierge première pression à froid conservée au réfrigérateur (maximum 3 mois) crue en assaisonnement, 1 à 2 cuillères à soupe d’huile d’olive vierge extra, des petits poissons gras y compris en boite 2 fois par semaines (sardines, maquereaux, anchois), des noix, des amandes et des noisettes chaque jour (au moins 60g dont 30g de noix), des œufs issus de la filière bleu blanc cœur si vous n’avez pas de poulailler (idéalement 1 à 2 œufs coque au mollet au petit déjeuner). Si vous souhaitez davantage de conseils sur les graisses à privilégier, voici le lien vers l’un de mes articles. Attention toutefois, il est important que les aliments riches en oméga 3, et surtout les compléments alimentaires, soient le moins soumis possible à l’oxydation, au risque d’augmenter fortement le stress oxydatif. Voir mes conseils et précautions d’achat.
Que penser des contaminants, notamment des pesticides ?
Les effets des pesticides sur les troubles immunitaires sont bien établis167,168. Leur immunotoxicité dépend de nombreux facteurs : la nature des pesticides167, la période de vie d’exposition (notamment la vie fœtale et la jeune enfance)167, la dose et la durée d’exposition169, de la prédisposition génétique et notamment de la capacité d’élimination des xénobiotiques par le foie170, du sexe, du mode de vie (association à l’alcool, tabac et autres polluants, sédentarité, etc.) et bien sûr l’état nutritionnel171. Les risques des pesticides sur le système immunitaire sont par ailleurs multiples. Ils peuvent affecter la résistance aux agents pathogènes, augmenter les risques d’hypersensibilités, de pathologie auto-immune et les cancers, d’immunodépression à l’origine de risques accrues d’infections respiratoires et d’une baisse de production d’anticorps, notamment chez les enfants172,173. Ils peuvent de plus réduire l’efficacité de la vaccination174. L’exposition chronique aux pesticides peut également générer un stress oxydatif majeur175, un dysfonctionnement des mitochondries176 ou encore l’inhibition de certaines enzymes dites esterases169. Pendant la grossesse, ils peuvent agir sur les tissus lymphoïdes au cours du développement embryonnaire, notamment sur la capacité du bébé à assurer la différenciation et le la mise en mémoire des cellules immunitaires.
- Prenons quelques exemples. En 2013, l’ANSES a confirmé les effets immunotoxiques du Bisphénol A177, en augmentant notamment les risques de maladies auto-immunes178. Malheureusement, le Bisphénol S venu remplacer le bisphénol A à partir de 2015, semble tout aussi toxique pour l’immunité…179.
- Si vous êtes passionné(e) de cuisine, peut-être avez-vous découvert la simplicité d’utiliser une poêle antiadhésive en toutes occasions, pour faire cuire votre œuf sur le plat ou votre volaille sans aucune goutte de matière grasse ? Certes. Mais… Ces ustensiles antiadhésifs, bien connus sous leur nom commercial Téflon, ne sont pas si lisses que l’on pourrait l’espérer. Cette matière est produite à partir de polytétrafluoroéthylène (PTFE) et d’acide perfluoroctanoïque (PFOA ou APFO en Français), un composé de la famille des perfluorés classé parmi les POP (polluants organiques persistants), et utilisé comme colle pour faire tenir le Teflon. En 2004, la société Dupont de Nemours s’est vue condamnée à verser 16 millions de dollars US aux résidents proches de l’usine pour avoir dissimulé les effets potentiellement nocifs du PFOA, notamment en tant que perturbateur immunitaire (mais également endocrinien et cancérogène).
- Parmi les colorants, les caramels de sulfite (E150b et E150d) sont particulier visés comme des perturbateurs immunitaires.
- Les huiles minérales (MOH) sont des mélanges d’hydrocarbures saturés d’huile minérale (MOSH) et d’hydrocarbures aromatiques d’huile minérale (MOAH) issus du pétrole. Elles sont abondamment utilisées dans les encres de type offset mais aussi dans les adhésifs des emballages en papier ou en carton, notamment quand ils sont recyclés. Or il s’avère qu’ils peuvent migrer dans les aliments. Malheureusement, les acides gras des huiles minérales, notamment les MOSH, sont très longs à être métabolisés par le foie. Ils peuvent alors s’accumuler dans les graisses corporelles, mais aussi dans les ganglions lymphatiques, la rate et le foie. Chez le rat, une immunotoxicité a été mise en évidence à la suite de fortes expositions aux MOSH.
- Comme les PCB, les dioxines font partie des polluants organiques persistants (POP) dont la durée de vie est très longue du fait de leur faible biodégradabilité. Ce terme regroupe plus de 75 molécules différentes, dont la plus connue est la TCDD ou dioxine de Seveso. Au-delà de leur responsabilité dans l’émergence de cancer, les dioxines sont également impliquées dans les troubles immunitaires.
Limitez votre consommation de viande
Au regard de sa teneur en acide arachidonique de la famille des oméga 6, le précurseur de prostaglandines aux effets pro-inflammatoires, de sa teneur en fer (voir partie dédiée), de la présence élevée de corps de Maillard si elle est grillée, des endotoxines potentiellement présentes dans la chair et des effets d’une forte ingestion sur le microbiote intestinal, je ne peux que vous inciter à limiter votre consommation de viande. Idéalement une portion tous les 9 à 10 jours, voire à éviter au profit du poisson et de la volaille, notamment dans un souci environnemental. Ainsi, si vous en consommez, privilégier une viande issue d’animaux élevés de manière extensive, nourries au foin ou grâce aux pâturages.
En pratique : Voir mon article Comment choisir ses apports en protéines ?
Que penser du jeûne intermittent ?
Les bénéfices du jeune intermittent et de la restriction calorique sont de plus en plus documentés, notamment pour mieux contrôler l’inflammation, donc le stress oxydatif, mais aussi pour accompagner les maladies métaboliques ou neurodégénératives180–193. L’intérêt de cette pratique alimentaire a également été étudié dans le cadre des maladies auto-immunes, pour lesquelles elle apparait plutôt positive194,195. La restriction calorique et le jeûne favorisent notamment la résistance au stress cellulaire, probablement en transférant l’énergie de la croissance et de la reproduction à la maintenance, au recyclage et à la réparation. Une telle situation permet d’accroître la protection et la survie à travers de multiples processus systémiques, dont l’autophagie190,196. Il s’agit d’un mécanisme de dégradation permettant d’éliminer les composés cellulaires endommagés, les protéines non fonctionnelles et les agents pathogènes.
Concernant le soutien des fonctions immunitaires en cas d’infection virale, peu de données sont encore disponibles. Le jeûne intermittent semblerait bénéfique à la suite d’infections bactériennes libérant de fortes quantités de LPS197. Chez des souris ayant jeûné 1 jour sur 2 durant 9 jours, les quantités de cytokines ont augmenté (TNF-α, MCP-1, IL-6, IL-10, IFN-α, IFN-γ), de même que la sécrétion de cortisol198. Des études complémentaires sont donc nécessaires pour en connaitre précisément les effets. Attention toutefois, je me permets de vous sensibiliser à l’importance de veiller à vos apports en protéines, notamment si vous avez plus de 60 ans ou si vous souffrez de dénutrition protéique. Il est essentiel d’assurer un apport suffisant en protéines (animales ou végétales). En effet, le statut protéique est déterminant pour garantir un bon fonctionnement immunitaire, qu’il s’agisse du renouvellement cellulaire ou de la production d’anticorps.
Si vous pratiquez déjà le jeûne intermittent et que vous n’avez pas perdu de poids depuis plusieurs mois, c’est une habitude tout à fait adaptée pour mieux contrôler l’inflammation. Le cas échéant, je ne vous conseille pas d’initier seul (sans accompagnement par un professionnel formé) un tel changement dans cette période particulière. Trop de facteurs modifient actuellement le mode de vie et il serait difficile d’être certain que vous équilibrez suffisamment votre alimentation sans altérer votre statut protéique.
Et le régime cétogène ?
Selon une étude publiée en 2019 dans Science Immunology, une équipe de chercheurs de l’université de Yale a mis en évidence une augmentation de lymphocytes T spécifiques (γδ dits gamma delta), à l’origine de la production de mucus pulmonaire199. Une telle conclusion serait donc plutôt en faveur du régime cétogène pour lutter contre des infections virales comme la grippe, voire les coronavirus. Plus récemment, en 2020, une nouvelle étude abonde dans ce sens et précise que la modulation de la production de lymphocytes T serait un mécanisme protecteur visant à réduire l’inflammation200.
Le régime cétogène pourrait par ailleurs activer l’inflammation immédiate suite à une infection en inhibant ce que l’on nomme les inflammasomes, des structures protéiques impliquées dans la réponse immunitaire innée201. A l’inverse, un régime cétogène réalisé à long terme et mal équilibré, notamment en cas d’apport calorique insuffisant, peut favoriser la modification du microbiote intestinal, altérer le métabolisme du cortisol mais aussi et surtout pérenniser une inflammation de bas-grade, ce qui rendrait l’organisme plus susceptible aux infections.
Si vous suivez un régime cétogène depuis plusieurs mois, que vous n’avez pas remarqué d’altération de votre santé, de perte de poids, de fonte musculaire ou de baisse de vitalité, il n’y a aucune raison de l’arrêter si vous souhaitez le poursuivre. Si ce n’est pas le cas ou si vous n’avez pas encore initié ce régime, je vous déconseille de le débuter ou de le poursuivre dans de telles conditions.
Alcool et immunité
La consommation excessive d’alcool, surtout de manière chronique, altère le fonctionnement du système immunitaire202. Les études menées autant chez l’homme que chez les animaux ont mis en évidence qu’une consommation excessive altère la réponse immunitaire innée mais aussi adaptative en réduisant le nombre de lymphocytes (B et T)203,204, leur différenciation et en augmentant la production d’anticorps auto-réactifs contre le foie, favorisant ainsi la cirrhose202,205. Les risques d’infections virales et de complications (notamment de pneumonie) augmentent, de même que les hypersensibilités voire les allergies. La réponse aux vaccinations est altérée. Les personnes âgées semblent particulièrement sensibles aux effets délétères de l’alcool sur l’immunité206. Les épisodes d’alcoolisation importante (les fameux binge drinking) engendrent des effets comparables à ceux constatés en cas d’alcoolisation chronique pendant 6 mois, mais s’avèrent réversibles après 1 mois d’abstinence207. En cas d’exposition chronique à l’alcool in utero, le développement des lymphocytes se trouve altéré, engendrant une augmentation du risque infectieux pendant l’enfance et l’âge adulte. Une faible consommation chronique pourrait toutefois exercer un effet bénéfique sur l’immunité inné à hauteur d’une bière de 330ml par jour pour les femmes ou de deux pour les hommes pendant 1 mois 208. Plusieurs études ont par exemple mis en avant une diminution de l’incidence du rhume chez les buveurs modérés de vin (1 à 2 verre par jour) 209,210. Bien que le mécanismes précis ne soient pas encore connus, une faible consommation d’alcool (30g) exerce des effets épigénétiques à l’origine d’une réduction des cytokines pro-inflammatoires et d’une augmentation du taux d’adiponectine à l’action anti-inflammatoire au bout de 4 semaines211,212.
Si vous êtes en bonne santé et que vous buvez l’équivalent d’un verre de vin rouge par jour (issu de biodynamie et si possible sans soufre ajouté), il ne semble pas que cela induise un risque d’affaiblissement immunitaire. Toutefois, si vous êtes fragilisé, âgée de plus de 60 ans et surtout, en phase infectieuse, la consommation d’alcool est à éviter. Et bien sûr, je ne vous conseille pas de vous mettre à boire de l’alcool sous prétexte de renforcer votre immunité…
Les aliments, micronutriments et extraits végétaux spécifiques
La quercétine et l’oignon
Il existe un antioxydant particulièrement intéressant – certainement le plus important dans le cadre de la lutte contre le coronavirus – la quercétine. Elle est naturellement présente dans les oignons (surtout rouges), les câpres (l’aliment qui en contient le plus pour 100g, 234mg), les pommes non épluchées, les petites baies, le thé, les brocolis ou encore les agrumes. A titre d’anecdote, la concentration la plus élevée en quercétine dans l’oignon se trouve dans les anneaux les plus extérieurs et dans la partie la plus proche de la racine213. Une étude fait par ailleurs état d’une teneur 79% plus élevée dans des tomates d’origine biologique comparativement à des tomates issues de culture conventionnelle214. La quercétine est également présente dans la plupart des miels215. Vous pourrez retrouver l’ensemble des valeurs sur la base de données américaine USDA. Les principales sources alimentaires dans l’alimentation occidentale sont les oignons, les pommes et le thé216. Toutefois, en fonction du pays, les apports moyens peuvent apparaitre très différents, ils sont par exemple deux fois plus importants en Espagne qu’aux Etats-Unis (18,48 mg par jour versus 9,75 mg)217. Le Gingko biloba, utilisé pour ses propriétés adaptogènes et antimicrobiennes, est aussi riche en quercetine de même que le jus de sureau (Sambucus canadensis)218–220. De manière générale, l’ensemble des polyphénols exercent des effets bénéfiques sur la régulation de l’immunité et sur le contrôle de l’inflammation221.
La quercétine est l’un des antioxydants les plus étudiés pour ses propriétés anti-inflammatoires et antivirales222–224. Elle a déjà fait l’objet de plusieurs publications visant à lutter contre le coronavirus225,226 et plus globalement contre la grippe et le virus H5N1227,228. Elle a également démontré une capacité à ralentir la progression du rhinovirus229. L’ensemble des flavonoïdes, famille à laquelle elle appartient, semblent en mesure d’inhiber une enzyme clé du développement du coronavirus, la 3CL protéase226,230. Toutefois, la plupart des études ayant mis en évidence un effet bénéfique significatif ont été réalisées in vitro ou chez la souris. Chez l’homme, un essai clinique randomisé en double aveugle contre placebo, réalisé auprès de 1002 participants ayant consommé entre 500mg et 1g de quercétine pendant 12 semaines, n’a pas démontré d’effets sur l’incidence d’infections respiratoires. Dans le groupe des personnes âgées de 40 ans ou plus, la prise de 1000mg a permis de réduire le nombre de jours de maladie et la gravité des symptômes231. Une autre étude, menée chez des femmes uniquement et aux mêmes dosages, n’a pas démontré d’effets significatifs232. Chez des sportifs, 100 mg/j a permis de réduire la prévalence des infections après des périodes d’entraînement intense233. Toutefois une autre réalisée chez des coureurs après une course d’ultra-trail (160 km) n’a elle pas montré d’effets sur la réduction des infections post-effort234. En cas de supplémentation à hauteur d’1g/j pendant 2 semaines avant un effort quotidien de 3h de vélo en hiver pendant 3 jours, poursuivie pendant 1 semaine, l’incidence des infections respiratoires a diminué, sans pour autant modifier l’adaptation au stress ni la réponse inflammatoire235.
Malheureusement, la quercétine, comme la plupart des flavonoïdes, est particulièrement mal assimilée par l’intestin, de l’ordre de 3 à 17%224. La prise conjointe de plusieurs flavonoïdes permet d’améliorer sa biodisponibilité et de soutenir l’immunité en cas d’infections aux rhinovirus, aux adénovirus et aux coronavirus. La consommation d’aliments entiers représente donc une solution optimale. En effet, la matrice alimentaire non altérée permet de bénéficier de la synergie d’action entre les différents antioxydants, par exemple entre la quercétine et la vitamine C même si ces deux molécules entrent en compétition d’assimilation au niveau intestinal236 (les flavonoïdes font d’ailleurs partie des molécules qui, par leur présence, réduisent l’impact sur la glycémie des sucres présents dans les fruits ou le miel)237. Par ailleurs, les flavonoïdes semblent en mesure d’améliorer la réponse inflammatoire via des structures spécifiques, les inflammasomes, impliqués dans la réponse immunitaire innée238–240.
Contrairement à ce que véhiculent certains sites internet, la quercétine, aussi intéressante soit-elle, n’est pas LA molécule miracle. Néanmoins, au regard du contexte et surtout si vous consommez peu de fruits et légumes, une supplémentation à hauteur d’1 g par jour (500 mg midi et soir, au cours du repas) en prévention se justifie. Il s’agit en effet de l’antioxydant de choix dans un contexte de coronavirus. En cas d’infection, doubler la dose. Je vous recommande en priorité d’y associer systématiquement des végétaux riches en flavonoïdes et de boire du thé au cours de la journée.
Le thé vert
Nous venons de le voir, le thé fait partie des principales sources alimentaires de flavonoïdes, qu’il soit noir ou vert, notamment d’épicatéchines241. Le thé vert présente toutefois la spécificité d’être riche en EGCG (épigallocatéchines) qui semblent exercer des effets spécifiques pour lutter contre le virus de la grippe, mais aussi de manière générale contre les infections virales respiratoires. Toutefois, la plupart des études ont là aussi été réalisées in vitro242–246. L’ensemble des épicatéchines présentent un intérêt dans le soutien de l’immunité. Les petites baies comme les myrtilles ou les raisins, mais aussi les pommes en sont riches.
Boire entre 2 et 5 tasses de thé vert bio par jour, infusé à maximum 85°c le plus longtemps possible. Si vous souhaitez découvrir tous mes conseils sur le thé, voici mon article : Comment bénéficier des bienfaits du thé ?
L’ail
Depuis des siècles, l’ail est utilisé par la médecine naturelle. Dès 1858, Pasteur aurait d’ailleurs publié sur ses propriétés. L’allicine et l’ajoene sont les principes actifs ayant démontré le plus d’intérêts, notamment en favorisant les bactéries bénéfiques du microbiote intestinal via une activité inhibitrice de certaines enzymes dites sulfhydryles247. Consommer chaque jour de l’ail pourrait favoriser l’augmentation des cellules NK et globalement la capacité de la moelle osseuse à produire davantage de cellules immunitaires248,249. L’ail semble également réduire l’activité virale en cas d’infection250–252. Toutefois, la plupart de ces études ont été réalisées in vitro ou à partir d’extraits concentrés d’ail. Deux revues systématiques de la base Cochrane, publiées en 2012 et 2014 indiquaient que les données permettant d’affirmer l’intérêt de consommer l’ail en tant qu’aliment en prévention du rhume demeuraient insuffisantes253,254. Il n’en demeure pas moins que manger de l’ail est intéressant, notamment grâce aux composés soufrés présents et contribuant à mieux contrôler le stress oxydatif, un point essentiel dans la régulation de l’immunité255,256.
Si vous souhaitez bénéficier au maximum des propriétés de l’ail, celui-ci doit toutefois être consommé quotidiennement, de préférence cru en prenant la peine de bien le mastiquer pour rendre l’allicine active. Le consommer sous forme confite ou mariné dans l’huile peut être un bon compromis entre les bénéfices nutritionnels, la tolérance digestive et de celle de votre voisin (surtout en période de confinement !).
La propolis
La propolis est produite par les abeilles pour garantir une ruche saine257,258. Les Égyptiens ont d’ailleurs volé cette idée aux abeilles en recouvrant les momies de ce fameux composé. La propolis contient en effet plus de 180 composés, dont certaines molécules actives comme les résines, les flavonoïdes et les huiles essentielles259. Elle possède des propriétés antibactériennes particulièrement puissantes260, antifongiques y compris contre Candida Albicans261, mais aussi antivirales, notamment contre le virus de l’Herpès, du HIV, de la grippe et les rhinovirus262–267. Elle contribue notamment à une meilleure activité des lymphocytes CD4+. Une des raisons pouvant expliquer ses propriétés est sa richesse en flavonoïdes et acide cinnamique262,268.
Utiliser de la teinture mère de propolis bio à hauteur de 20 gouttes 3 fois par jour (1 goutte par kg de poids corporel par jour). De manière générale, elle peut également être utilisée contre les infections buccodentaires ou oropharyngées262, plutôt sous forme de spray ou de gomme à mâcher. 20 à 25 gouttes dans de l’eau 3 fois par jour.
La vitamine C
La vitamine C est depuis longtemps reconnue comme une vitamine renforçant l’immunité269,270. Qui n’a jamais eu le droit à ce conseil de boire un verre de jus d’orange le matin en hiver pour ne pas tomber malade ? Moi, si. Je me rappelle encore mon professeur de mathématiques au collège, nous demandant si nous avions bu notre verre de jus d’orange au petit déjeuner… Si elle avait su ce que j’écrirais sur le sujet 20 ans plus tard (voir article), mais c’est une autre histoire !
La vitamine C (et non le verre de jus d’orange) présente en effet cette spécificité d’être extrêmement concentrée dans les leucocytes, les lymphocytes et les macrophages270. Elle favorise ce que l’on nomme la chimiotaxie (la propriété des cellules à se déformer pour se déplacer), améliore la capacité des neutrophiles à tuer les virus par effet pro-oxydatif, stimule la production d’interféron-gamma et accélère la prolifération des lymphocytes271–273. Elle possède par ailleurs une autre spécificité, lui valant d’être au cœur de débat scientifique. La vitamine C exerce en effet une activité virucide quand elle est associée à des ions métalliques libres, le fer et le cuivre, en produisant des radicaux libres comme le peroxyde d’hydrogène via une réaction bien connue des biologistes, la réaction de Fenton274,275. Dès 1949, le Dr Fred Klenner utilisa des injections intraveineuses de vitamine C pour traiter la poliomyélite et d’autres infections virales grâce à ce mécanisme276. Quelques décennies plus tard, le Pr Pauling (double prix Nobel de chimie et de la paix), a beaucoup étudier les propriétés thérapeutiques de la vitamine C. Devenu célèbre, ce scientifique proposait jusqu’à 18g de vitamine par jour dans certains protocoles. Pour bien comprendre une des propriétés de la vitamine C, il faut savoir que dans des conditions standards, le fer dans l’organisme est lié aux protéines et n’existe pas sous sa forme libre. La vitamine C n’interagit alors pas avec le fer dans ces conditions. Toutefois, en cas d’hypoxie ou de septicémie, le fer peut être libéré de la ferritine. Il devient alors hautement cytotoxique, surtout en présence de cytokines pro-inflammatoires278. Le Pr Seo a par exemple mis en évidence, dans un modèle d’ischémie hépatique chez la souris, une diminution des lésions oxydatives de la vitamine C à la suite de perfusions de 30 mg/kg et 100 mg/kg et, à l’inverse, un effet délétère pro-oxydatif majeur à des doses de 300 mg/kg et 1000 mg/kg279. Le Dr Kuck et ses collègues ont démontré que les complications de l’ischémie seraient en partie dues à l’épuisement de la vitamine C intracellulaire du fait de la libération de l’hémoglobine libre280. Dans la même étude, l’ajout d’ascorbate à une concentration physiologique (60 μmol/L) a atténué l’augmentation de la perméabilité endothéliale médiée par l’hémoglobine libre. Toutefois, en l’absence d’hème ou de fer libre, cet effet est très fortement atténué. De fortes quantités de vitamine C (750 mg/kg poids corporel) n’induisent pas de variations des marqueurs de stress oxydatif281. Il faut atteindre des quantités supérieures à 100g par jour pour constater un effet, recherché par exemple en cas de traitement contre le cancer282. Pour autant, une revue systématique incluant 8 essais randomisés contrôlés a confirmé qu’une injection intraveineuse d’un à deux grammes de vitamine C peut réduire les risques de fibrillation chez des patients opérés du cœur283. Une telle propriété explique donc une situation, de prime abord paradoxale, dans laquelle la vitamine C joue un rôle antioxydant à faible dose mais exerce un effet pro-oxydatif majeur quand elle est administrée en intraveineuse284,285.
Une revue systématique a compilé les données de 60 études ayant examiné les effets d’une supplémentation de vitamine C (1g minimum) sur les risques de survenue de rhume286. Dans les six principales études, aucun effet n’a été constaté, si ce n’est une diminution de la durée des symptômes de 5%. Trois études plus modestes ont constaté une diminution de l’incidence de 50% lorsque les patients étaient soumis à un stress, mais avant tout car les participants étaient déficitaires en vitamine C. Elle semblerait réduire les symptômes de la grippe (éternuements, congestion nasale) selon des mécanismes similaires aux traitements antihistaminiques287. Une revue systématique parue dans Cochrane en 2013 a analysé les résultats de 72 études, menées en double aveugle et randomisées, d’une supplémentation d’au minimum 200mg de vitamine C sur la prévention de survenue de rhume. Il s’est avéré qu’un tel apport n’a permis de réduire les risques que de 5%, sauf chez les sportifs réguliers (-52%), notamment car ils sont soumis à un stress oxydatif plus important 288. Une autre méta-analyse a quant à elle mis en évidence que la supplémentation permet de réduire l’intensité des symptômes et la durée infectieuse d’environ 10h en moyenne289.
Selon une autre revue systématique parue dans Cochrane reprenant les résultats de 29 essais contrôlés, la durée de la grippe diminue de 8% en moyenne chez les adultes et de 14% chez les enfants après une supplémentation quotidienne de 1 à 2 g de vitamine C290. En cas de pneumonie, trois études contrôlées ont noté une réduction d’au moins 80 % de son incidence grâce à une supplémentation en vitamine C. Un essai randomisé a également mis en évidence un bénéfice significatif chez des patients britanniques âgés et hospitalisés pour une pneumonie ou une bronchite. Trois autres essais contrôlés menés ont rapporté une incidence significativement plus faible de pneumonie dans les groupes supplémentés en vitamine C291.
Une étude menée dès 1978 in vitro sur le coronavirus aviaire a mis en évidence qu’une supplémentation en vitamine C augmentait la résistance des cellules pulmonaires292. Elle a également démontré soutenir les fonctions immunitaires en cas d’infection causée par le SRAS-coronavirus293. Une revue systématique de 12 études menées dans le milieu militaire ou sportif, dont 8 contrôlées randomisées en double aveugle, a analysé les effets d’une supplémentation sur l’augmentation des risques d’infections respiratoires. Cinq d’entre elles ont mis en évidence une diminution de 45 à 91% de l’incidence des infections et trois autres ont trouvé une baisse de 80 à 100% des risques de pneumonie. Une autre étude a mis en évidence, chez la souris, une diminution de la mortalité dose-dépendante de la vitamine C à la suite d’une pneumonie induite par la virus H1N1, en protégeant davantage les mitochondries et en réduisant la production de cytokines pro-inflammatoires294. Cet effet protecteur a été confirmé dans le cas de nombreuses autres infections virales, en particulier en cas d’herpès contre lequel un apport oral ou par intraveineuse semble efficace295–297. À noter que les patients souffrant d’infections virales majeures présentent des taux plasmatiques de vitamine C bas du fait d’une consommation métabolique accrue284,298.
En résumé, les effets préventifs de la supplémentation semblent principalement limités aux personnes déficitaires en vitamine C ou « à risques ». Trois méta-analyses publiées dans la revue Cochrane ont cherché à étudier l’effet d’une administration quotidienne de 200mg de de vitamine C sur l’incidence, la sévérité et la durée des infections299. L’analyse conclut que seules les personnes exposées au froid extrême ou au stress physique intense semblent bénéficier d’un traitement prophylactique efficace. En revanche, il apparait un effet bénéfique de la vitamine C sur la sévérité et la durée des symptômes. D’autres populations, comme les fumeurs ont également tout intérêt à veiller à leur apport, non seulement pour renforcer leur défense mais aussi leur capacité pulmonaire300. Mais, surtout, des effets thérapeutiques d’une supplémentation semblent exister chez des personnes âgées à risque respiratoire à la suite d’une infection virale, notamment en cas de pneumonie. Un apport de vitamine C à hauteur d’un à deux grammes suffit et apparait fortement conseillé chez les personnes âgées ou fumeuses. La mise en place d’un protocole à forte dose et par injection intraveineuse relève d’une autre démarche, méritant d’être explorée dans le cadre de recherche de solution contre le Covid-19.
Privilégier une alimentation la plus riche possible en fruits et légumes crus (notamment les choux, selon votre tolérance digestive), frais et de saison (dans la mesure du possible selon le confinement) ou surgelés. Arroser vos aliments de jus de citron le plus souvent possible.
Je vous recommande une forme simple de vitamine C, idéalement de l’ascorbate de sodium ou de calcium ou de l’acide ascorbique. Les formes dites retard et liposomales sont très couteuses au regard du peu de bénéfice supérieur attendu. De même, les compléments alimentaires associant de la vitamine C avec des flavonoïdes ne sont pas nécessaires, la synergie d’action ne valant que lorsque ces composés sont intégrés dans une matrice alimentaire, donc dans l’aliment, nullement dans un complément alimentaire. Les comprimés d’acérola peuvent être une solution mais attention à bien vérifier la teneur en vitamine C. Par ailleurs, de nombreuses marques rajoutent de l’acide ascorbique à des extraits d’acérola titrés en vitamine C. Un exemple de marketing abusif… Il est important de répartir au maximum la prise, par exemple en 4 fois par jour. En cas d’infection, cette prise peut être plus fréquente (idéalement toutes les heures).
La vitamine D
La vitamine D est un régulateur clé de la défense immunitaire contre les infections, autant concernant l’immunité innée qu’adaptative301,302. Elle exerce des effets multiples telles que la stimulation des macrophages, la différenciation des lymphocytes B et T, la maturation des cellules dendritiques, la modulation de l’expression de TNF-alpha et du CMH, la production de composés biocides (comme les défensines) ou pro-oxydants. Elle régule également les cytokines produites par les cellules Natural Killer (Interféron-γ). En clair, la vitamine D3 est considérée comme un immuno-modulateur puissant et un régulateur de l’inflammation304. Elle possède par ailleurs une spécificité dans le monde des vitamines, celle de se lier aux récepteurs de plus de 400 types cellulaires différents (VDR) pour autoréguler sa synthèse (activité dite autocrine)305. Il s’agit d’ailleurs d’une des raisons pour laquelle elle est davantage considérée comme une hormone qu’une vitamine. Le récepteur VDR des cellules intestinales intervient par exemple dans le maintien de l’intégrité de la muqueuse, dans le contrôle de l’inflammation et la régulation immunitaire306. Cette capacité d’autorégulation semble particulièrement importante pour le système immunitaire.
Il n’existe pas à ce jour d’études spécifiques sur les effets de la vitamine D dans le cas du Covid-19. A noter toutefois que ce virus survient à une période hivernale, donc de risque accru de déficit, en particulier chez les personnes âgées qui ont tendance à rester davantage chez elle alors qu’elles ont perdu une grande partie de leur capacité de synthèse de vitamine D3 307–309. Il n’existe bien sûr pas de lien de causalité directe pour autant. Une seule étude fait mention, dans le cas d’une infection au coronavirus chez le veau, d’une baisse des taux de vitamines D et E (de respectivement 51 et 82%) à la suite de l’infection310. Elle ne permet toutefois pas d’extrapoler ce constat chez l’homme et à d’autres types d’infections à coronavirus, ni de savoir si une supplémentation pourrait apparaitre bénéfique. Les liens entre déficit en vitamine D3 et infections virales sont toutefois bien établis pour de nombreuses pathologies comme le VIH ou l’hépatite B303. Les personnes souffrant de VIH présentent en effet souvent un déficit chronique. Des niveaux élevés d’expression du récepteur à la vitamine D chez ces personnes (VDR) sont également associés à une meilleure résistance naturelle à l’infection. À l’inverse, la carence en vitamine D est liée à une inflammation et une activation immunitaire plus importantes, à un faible taux de lymphocytes (CD4+), à une progression plus rapide de la maladie et à une durée de survie plus courte chez les patients infectés. La supplémentation en vitamine D en cas de carence et le retour à des valeurs normales peuvent améliorer la récupération immunologique pendant la thérapie, voire réduire la mortalité chez les patients infectés par le VIH.
Une revue systématique a analysé les résultats de 25 essais contrôlés randomisés (11 312 participants de 0 à 95 ans)311. La supplémentation en vitamine D a réduit le risque d’infection aiguë des voies respiratoires chez tous les participants de 12%. Les personnes ayant recours à un apport quotidien ou hebdomadaire ont vu leur risque diminuer de 19% contre uniquement 3% en cas d’apport de fortes doses isolées. Si les taux initiaux étaient faibles (<25 nmol/L), le bénéfice était de 30% de réduction des risques. Toutefois, la supplémentation n’a aucun effet sur les risques de complications graves. Une autre revue systématique confirme l’intérêt d’une supplémentation quotidienne312. Une étude de cohorte américaine (Health and Nutrition Examination Survey) regroupant 18,883 participants) et publiée dans JAMA a mis en évidence que les personnes possédant un taux plasmatique de vitamine D inférieur à 10 ng/L présentaient un risque d’infection respiratoire aiguë 1,4 fois plus important que celles dont le taux était supérieur à 30 ng/L313. Les risques de complication pulmonaire, d’augmentation de l’inflammation et de réduction de l’immunité présente au niveau du mucus étaient par ailleurs fortement augmentés. En cas d’hospitalisation, les patients souffrant de la grippe et présentant un taux bas de vitamine D3 sont considérés davantage à risques de complications respiratoires et de mortalité314–316. Une étude clinique publiée dans JAMA en 2014 auprès de 475 patients n’a toutefois pas constaté d’effets positifs sur les risques de mortalité ni sur la durée du séjour d’une supplémentation massive en vitamine D3 chez les personnes déficitaires317. Néanmoins, les personnes étant atteintes du moins de complications et restant peu de temps à l’hôpital furent celles qui présentaient un meilleur taux plasmatique. Par ailleurs, les personnes présentant un taux optimal de vitamine D font partie des individus les moins sujets aux infections à la suite de vaccinations, en particulier contre le virus de la grippe318,305.
Quel dosage ? Je vous recommande un apport quotidien de 1000 UI pour optimiser la réponse immunitaire, il sera plus efficace qu’une prise occasionnelle plus élevée319,320. Selon une méta-analyse publiée dans PLOs one, les études ayant démontré une réduction des risques d’infections des voies respiratoires proposaient des doses quotidiennes entre 300 et 2000 UI321. Toutefois, la réponse de l’organisme à la suite d’une supplémentation apparait très variable selon les individus. On considère en moyenne que, pour chaque 100 UI consommées, le taux plasmatique monte d’1 ng/mL (ou 2,5 nmol/L). Ainsi, pour atteindre une valeur de 475 nmol/L, 3000 UI par jour seraient en moyenne nécessaires. Toutefois, il semble que le corps soit capable de faire remonter le taux plus rapidement en cas de valeur initiale très basse, notamment pour passer de 15 à 20 ng/mL301. Il existe par ailleurs un polymorphisme individuel important. Les cellules immunitaires disposent en effet de plus de 23 000 sites récepteurs VDR différents et plus de 9000 régions de chromatine réagissent à une supplémentation322,323. Or il semblerait que la réaction du système immunitaire à la supplémentation en vitamine D varie d’un individu à l’autre en fonction du polymorphisme du récepteur VDR.
La supplémentation en vitamine D, surtout à cette époque de l’année (sortie d’hiver) est une des priorités dans le contexte de Covid-19. Si vous savez que vous êtes déficitaire voire carencé(e), si vous êtes positif au test, vous pouvez utiliser la posologie usuelle de 75 UI par kg de poids corporel par jour. Si vous ne connaissez pas votre valeur et que vous avez plus de 60 ans, je vous recommande également d’avoir recours à cette quantité. Si vous avez moins de 60 ans, que vous n’êtes pas sujet(te) au déficit ou que vous ne connaissez pas votre taux, un apport de 1000 voire idéalement 3000 UI demeure fortement conseillé au cours des semaines à venir. L’idéal serait de connaitre votre taux actuel pour adapter la posologie. Chez l’enfant (entre 1 et 5 ans), il n’a pas été démontré d’effets bénéfiques supérieurs d’une forte dose (2000 UI vs 400 UI), pour diminuer les risques d’infections respiratoires324.
La vitamine E
La vitamine est elle aussi connue pour ses propriétés antioxydantes, notamment en prévention cardiovasculaire et du vieillissement cérébral. Elle exerce de plus toutefois des effets particulièrement importants au bon fonctionnement immunitaire, en particulier chez la personne âgée de plus de 65 ans ou pour améliorer la réponse au vaccin contre la grippe325,326. Elle protège notamment les cellules de l’immunité des dommages liés au stress oxydatif, la concentration étant plus élevée dans ces dernières. Elle permet également une meilleure réponse des macrophages en réaction à l’inflammation, notamment en modulant les PGE2 et les COX, mais aussi une induction plus efficace des cellules dendritiques, des Natural Killer chez les personnes de plus de 90 ans et une production plus importante d’anticorps327,328. Plusieurs études d’intervention menées chez l’homme ont rapporté une prolifération des lymphocytes, une production plus importante de cytokines (IL-2 et IL-6) à la suite d’une supplémentation à très forte dose. Toutefois, d’autres n’ont pas mis en évidence de bénéfices, voire ont constaté une diminution de la prolifération de lymphocytes. Ces différences s’expliquent avant tout par les dosages utilisés, l’âge des participants et les méthodologies utilisées différentes326. Quelques études ont obtenu une diminution de l’incidence des infections respiratoires ou du rhume, mais majoritairement lorsque les participants sont fumeurs et en cas d’association à d’autres antioxydants comme le béta-carotène329,330. Un déficit en cette vitamine semble augmenter l’intensité des affections au virus coxsackie B3 (une forme de virus à ARN) chez la souris331, notamment en cas de déficit associé en sélénium332. Je l’ai par ailleurs évoqué dans la partie liée à la vitamine D, un manque conjoint de ces deux vitamines accroit l’infection au coronavirus chez le veau310. Certains scientifiques conseillent d’augmenter les apports chez la personne âgée au moins de 100 mg/j333. Les études se basent sur des quantités pouvant atteindre plus de 200mg/j d’alpha-tocophérol, à savoir la forme standard de vitamine E proposée en complément alimentaire. Les recommandations officielles pour l’adulte sont largement inférieures, de l’ordre de 12 à 30 mg. Une telle quantité (100mg/j) induit obligatoirement d’avoir recours à une supplémentation, un apport alimentaire supérieur à 15 ou 20mg étant difficilement atteignable sauf si vous consommez de très grandes quantités d’oléagineux.
Consommer au moins 60g d’oléagineux par jour (notamment des amandes), des petits poissons gras et des huiles végétales selon les recommandations précédentes est le meilleur moyen de renforcer vos apports. En cas de supplémentation, privilégier une forme naturelle contenant tous les isomères de vitamine E (pas uniquement de l’alpha-tocophérol) à hauteur de 15 à 30 mg par jour.
La vitamine A
La vitamine A est une vitamine antioxydante particulièrement étudiée dans le cadre du système immunitaire. Les caroténoïdes, correspondant à la famille à laquelle elle appartient, sont tout aussi essentiels mais pour des raisons de simplification, je ne parlerai ici que de vitamine A. Cette dernière participe à la constitution du système lymphoïde, à la régulation des cytokines, au bon fonctionnement des macrophages, des lymphocytes (T et B) ou encore à la production d’IgA334. Dans le cas de la rougeole, la vitamine A renforce la réponse immunitaire innée des cellules non infectées, les rendant ainsi plus résistantes. Toutefois, l’intérêt thérapeutique d’une supplémentation pour renforcer l’immunité varie énormément en fonction des infections concernées. Les maladies pour lesquelles elle a démontré un intérêt sont essentiellement la rougeole et sa complication principale (la pneumonie), les gastro-entérites, la malaria, les maladies respiratoires ou encore le VIH335. Les effets d’une carence (et non d’un déficit) ont par ailleurs été surtout constatés chez les enfants, notamment dénutris dans les pays en développement. La carence en vitamine A provoque une augmentation des infections des voies respiratoires du fait d’une altération pathologique de l’épithélium des voies respiratoires, d’une moindre production de mucus et de cellules immunitaires locales336,334. Une telle carence est d’ailleurs associée à une augmentation des infections des voies respiratoires inférieures. Chez l’animal, une carence en vitamine A engendre une moindre efficacité du vaccin contre le coronavirus et une susceptibilité accrue aux infections respiratoires337. Les effets d’une infection respiratoire d’origine virale proche du coronavirus chez le poulet ont été exacerbés en cas d’alimentation déficitaire en vitamine A338.
Les principales sources alimentaires de vitamine A, de bêta-carotène et de caroténoïdes sont à distinguer. La vitamine A est présente essentiellement dans les abats, le beurre et les œufs dans une moindre mesure. Il est également possible de consommer son précurseur végétal, le bêta-carotène, ou des antioxydants de la famille des caroténoïdes abondants dans les produits végétaux colorés en jaune-orangé (patate douce, carotte crue, potiron) mais aussi dans les épinards, les brocolis, la pastèque, les abricots ou encore le melon (en saison).
Avant toute supplémentation, réaliser un dosage plasmatique au préalable (idéalement dans l’ensemble des caroténoïdes), surtout si vous êtes fumeur. En effet, l’excès de vitamine A est délétère, il augmente notamment les risques de cancer du poumon chez des patients à risque (fumeurs ou exposés à l’amiante), mais à très fort dosage (au moins 10 fois celle recommandée ici)339–342.
Posologie : 600 à 800 ug par jour.
Le Sélénium
Le sélénium est un micronutriment essentiel. Il s’agit du cofacteur indispensable à une enzyme au cœur du contrôle du stress oxydatif en cas d’infection, la GPX (glutathion peroxydase)343,344. Un déficit a été associé à une augmentation des risques d’infection virale, notamment la grippe et des entérovirus de type coxsackie (surtout en cas de déficit associé en vitamine E)345–347. Un manque de sélénium semble non seulement réduire la capacité de défense oxydative à la suite d’une infection grippale, mais augmenter également la résistance du virus, voire sa capacité de mutation348,349.
Consommer des aliments riches en sélénium (poissons, œufs, noix du Brésil). Contrairement à ce qui est régulièrement évoqué, vous pouvez consommer 3 à 5 noix du Brésil par jour (peu idéal au niveau environnemental) sans crainte de surdosage en sélénium.
Avant toute supplémentation, déterminez votre taux plasmatique de sélénium via une prise de sang. Attention, un excès de sélénium étant délétère. Considérer un apport de 50 à 75 µg sous forme de L-Sélénométhionine.
Le Zinc
Le zinc est un des minéraux essentiels au bon fonctionnement du système immunitaire, autant concernant l’immunité innée qu’adaptative350. Une carence (et non simplement un déficit) en zinc provoque en effet une atrophie du thymus, une chute des taux plasmatiques de lymphocytes, une altération des réponses immunitaires à médiation cellulaire et humorale, voire la mort351. A l’inverse, un statut optimal permet une sécrétion adaptée de radicaux libres et de cytokines, donc une action optimale des leucocytes et des macrophages et une bonne différenciation des lymphocytes T CD4350,352. Le Zinc est notamment nécessaire à la bonne différenciation des systèmes TH1 et TH2, mais également des Treg impliqués353,354. De faibles doses suffisent à réduire l’activité de la réponse TH17, donc l’inflammation et les risques auto-immuns associés355,356. Le zinc régule la production de cytokines pro-inflammatoires à la suite de la liaison entre les LPS et les récepteurs TLR des macrophages357. En bref, il est indispensable.
Une supplémentation en zinc peut rapidement restaurer les fonctions immunitaires en cas de déficit, y compris pour lutter contre les effets des infections virales358–361. L’effet bénéfique d’une supplémentation en zinc a été conforté par une revue systématique compilant les résultats de 17 essais cliniques pour un total de 2121 participants363. Les auteurs ont mis en évidence une réduction de la durée des symptômes de plus de 2,6 jours en cas de rhume chez les adultes. Certains essais contrôlés randomisés n’obtiennent toutefois pas ces résultats, y compris avec les mêmes sels de zinc utilisés (gluconate)364. Une revue systématique publiée dans la base Cochrane en 2013 et mise à jour en 2015 après avoir analysé 18 essais contrôlés confirme qu’un apport de zinc au cours des 24h suivant l’apparition des premiers symptômes permet de réduire la durée du rhume, mais à des doses d’au moins 75 mg/j. Selon les auteurs, les données permettant de conseiller du zinc à dose moindre dans un but préventif n’étaient pas encore suffisantes365.
Le zinc est par ailleurs reconnu pour contribuer à la limitation de la réplication des virus (VIH, herpès, rhinovirus, papillomavirus, etc.), y compris de la grippe. Une équipe d’experts Chinois considère la supplémentation en zinc comme une solution à envisager366. Le pyrithione de zinc, utilisé dans l’étude, est toutefois utilisé comme antifongique dans les produits cosmétiques et non en complément alimentaire. Les bisglycinate et gluconate de zinc sont les deux formes les plus utilisées actuellement disponibles sur le marché. Attention, des doses élevées de zinc apparaissent tout aussi délétères qu’un déficit. In vitro, un excès de zinc augmente les quantités de cytokines pro-inflammatoires par les monocytes et réduit le développement de lymphocytes367,368. In vivo, un apport de 80 mg par jour pendant 1 semaine a démontré des effets de type imuno-suppresseur369. Les auteurs d’une autre étude, proposant cette fois-ci 220 mg de zinc chaque jour pendant un mois chez des personnes de plus de 70 ans, a conclu à des effets similaires, même si les effets sont apparus variables selon les individus370. Le zinc en excès peut également induire une baisse d’assimilation intestinale du cuivre, pourtant essentiel à la protection antioxydante en tant que cofacteur de la SOD371. Ce déficit peut lui-même augmenter les risques d’anémie372 et de fragilité immunitaire373. En dehors de l’aspect immunitaire, l’excès de zinc est également considéré comme un facteur de risque de cancer de la prostate374.
Les meilleures sources demeurent animales. Les huîtres en sont particulièrement riches mais en cette période de confinement, ne sont pas des plus simples à consommer… La volaille, le poisson ou dans une moindre mesure les œufs en contiennent également. Le zinc présent dans les sources végétales est mal assimilé car souvent associé à des facteurs antinutritionnels comme dans les légumineuses. Ainsi, penser à les faire tremper au moins 12h avant et bien les cuire. Les noix de cajou en contiennent mais je les déconseille pour des raisons écologiques et sociales. Les graines de courge, de sésame, de lin ou le chanvre en sont riches mais l’apport rapporté à la portion demeure faible et sous une forme mal assimilée.
Concernant la supplémentation, idéalement réaliser un dosage de zinc érythrocytaire. Toutefois, au regard de son importance dans la réponse immunitaire, si vous êtes à risque immunitaire, végan ou végétalien, si vous avez plus de 60 ans, voire à titre préventif, je vous conseille de prendre 10 à 15 mg de bisglycinate de zinc.
En savoir plus sur le zinc : Comment optimiser son statut en Zinc.
Le Fer
L’anémie ferriprive, liée à un déficit en fer, est un facteur important de fragilité immunitaire, notamment vis-à-vis des risques d’infections virales respiratoires375. A l’inverse, un excès de fer à l’état libre est fortement générateur de stress oxydatif comme nous l’avons vu, et favorise les risques infectieux376. En effet, les concentrations de fer dans les macrophages et dans les hépatocytes augmentent en cas d’infection, notamment d’origine virale377,378. Une énigme scientifique persiste à ce jour concernant le rôle du fer en phase infectieuse. En effet, de nombreux virus utilisent le « gardien » du métabolisme du fer – le TfR1, un récepteur très exprimé à la surface des cellules – comme sa porte d’entrée dans les cellules. Ce mécanisme permettrait d’expliquer la raison pour laquelle le récepteur de la transferrine est ciblé pendant l’infection virale, sans savoir pour autant comment379.
Il est essentiel de vérifier votre ferritine en dehors de toute période d’inflammation (si tel est le cas, demandez plutôt à votre médecin le dosage du récepteur soluble à la transferrine). Je vous déconseille vivement de consommer des compléments alimentaires contenant du fer sans avoir vérifié que vous en manquez, type multi-minéraux « tout en un ».
Pour optimiser votre statut en fer sans en consommer davantage à l’état libre, voici quelques conseils pour favoriser sa bonne assimilation : consommer des crudités les plus fraîches possibles à chaque repas (fruit et légumes) et y rajouter du jus de citron, ne pas consommer de thé ou de café au cours d’un repas, faire tremper et bien cuire les légumineuses. De manière générale, tous les produits animaux contiennent du fer sous la forme mieux assimilée (fer dit héminique ou Fe2+) sauf le jaune d’œuf. Si vous aimez le boudin noir, en consommer régulièrement est un excellent moyen de renforcer vos apports. Mais attention aux excès de fer libre (limitez votre consommation de viande une fois par semaine maximum).
Les vitamines du groupe B
La vitamine B6 joue un rôle essentiel aux fonctions immunitaires. Au regard du risque de baisse de vitalité et d’affaiblissement de la réponse immunitaire en cas d’infection, il est recommandé aux patients atteints du COVID-19 d’envisager une supplémentation selon une revue systématique Chinoise parue le 3 mars s 2020383.
Les aliments riches en vitamine B6 sont les légumineuses, la banane, le poireau, les poissons gras, le sarrasin et le poulet. En cas de supplémentation, préférer une forme de Pyridoxal-5-phosphate (P5P) à hauteur de 1,4 à 2 mg / jour, voire 20mg en cas de déficit identifié ou d’infection.
Concernant les autres vitamines, privilégier les produits céréaliers complets et les légumineuses. En cas d’alimentation déséquilibrée, envisager éventuellement un complexe multivitamines.
La N-Acetyl-Cystéine (NAC), la glycine et le glutathion
Le glutathion est un acteur majeur du soutien immunitaire à plusieurs niveaux. Il s’agit avant tout d’un antioxydant de choix pour le contrôle du stress oxydatif dont on a vu toute l’importance dans la réponse immunitaire384. Le glutathion permet par ailleurs de protéger le foie du stress oxydatif et ainsi de soutenir les fonctions d’élimination des molécules étrangères par le foie, notamment des médicaments ou de certains traitements alternatifs pouvant être utilisés en cas d’infection. J’ai également évoqué en introduction l’atteinte hépatique des personnes souffrant de complications du Cov-19.
Le rôle du glutathion ne s’arrête pas là. En 2017, des chercheurs Luxembourgeois ont publié une étude particulièrement intéressante dans Cell385. Ils ont en effet mis en évidence qu’un gène, Gclc, code pour la synthèse de glutathion. Or ce gène doit être activé pour que les lymphocytes T agissent efficacement contre l’infection. Le glutathion exerce donc un effet de stimulateur du métabolisme de certaines cellules immunitaires. Sans ce précieux antioxydant, les lymphocytes T de souris demeurent inactifs. Plus récemment, une autre étude a constaté que l’inhibition de la synthèse de glutathion augmentait le stress oxydatif et altérait la différenciation des lymphocytes386. Or l’utilisation de la glutamine, un acide aminé nécessaire aux cellules immunitaires, alimente la synthèse de glutathion, donc la capacité des lymphocytes T à se différencier.
Le glutathion réduit (la forme active du glutathion) proposé sous forme de complément alimentaire est non seulement particulièrement onéreux mais surtout fortement dégradé dans l’intestin387. Rien ne vaut le glutathion naturellement produit par l’organisme à partir de trois composés : la glycine, le glutamate et la cystéine. La N-acétyl-cystéine ou NAC est un donneur de soufre particulièrement utile pour la synthèse de glutathion. Elle est d’ailleurs prescrite à forte dose en cas d’intoxication au paracétamol388. Des apports de NAC à hauteur de 500 milligrammes à 1g par jour (les études menées proposant des doses entre 0,2 et 2 g/kg poids corporel/j), en complément d’un apport de 5 à 10g de glycine389,390 représentent donc une solution optimale. La glycine semble en effet le substrat limitant de la synthèse de glutathion391. Cette stratégie sera plus constructive qu’un recours à un complément alimentaire.
La glutamine
Il s’agit d’un acide aminé de choix pour se prévenir des infections et ayant suscité beaucoup d’intérêts à la fin des années 90. En effet, le nombre de publications est passé d’environ 2 par an à la fin des années 1960 à plus de 50 chaque année depuis les vingt dernières années. En lien avec ce qui a été évoqué concernant le glutathion et le contrôle du stress oxydatif, la glutamine est un des précurseurs de ce puissant antioxydant (via le glutamate). Une supplémentation chez la souris (1g par kg de poids corporel, en association avec de l’alanine) a d’ailleurs mis en évidence une diminution du stress oxydatif et de l’inflammation associée392.
La glutamine est intéressante dans le cadre de l’immunité à double titre393. D’une part, il s’agit d’un modulateur important de la fonction des cellules immunitaires, notamment des lymphocytes et des macrophages394,395. Ces derniers sont en effet de grands utilisateurs de glutamine396. En cas d’infection, le taux de consommation par toutes les cellules immunitaires est similaire ou supérieur à celui du glucose396,397. La demande accrue de glutamine par ces cellules, associée à une majoration de son utilisation par d’autres tissus et notamment le foie, peuvent entraîner un déficit. Une telle situation peut contribuer de manière significative à l’aggravation des infections et/ou augmenter le risque d’infection ultérieure. D’autre part, les cellules intestinales garantes de l’intégrité de la muqueuse en ont également besoin pour leur métabolisme. Leur consommation est quantitativement plus importante que celle du glucose398,399, notamment pour prévenir l’hyperperméabilité intestinale et le passage de peptides bactériens dans le sang (endotoxinose)400.
La glutamine est essentiellement présente dans les aliments riches en protéines, végétales autant qu’animales. L’alimentation en apporte en moyenne 7g par jour401. . Les doses expérimentales utilisées sous forme de supplémentation sont généralement de 15 à 30g, notamment de le cadre d’études relatives à la nutrition sportive, parentérale ou en accompagnement du cancer402–405. Une telle dose est possible sur une période de quelques jours. Toutefois, la glutamine intervient également dans le métabolisme des cellules cancéreuses, ces dernières l’utilisant en effet comme une source énergétique au même titre que le glucose. Une supplémentation d’environ 5g sur une période plus longue est prudente.
Les champignons japonais (maïtaké, reishi, shiitake, cordyceps)
Ces champignons japonais sont riches en certains composants de la famille des polysaccharides particulièrement intéressants pour soutenir l’immunité, autant innée qu’acquise : les bêta – (1,3/1,6) – glucanes406–411. Des extraits de shiitake riche en lentinanes ont par exemple permis de réduire la perméabilité intestinale chez l’animal, notamment en stimulant la production d’acides gras à chaine courte412,413. Le cordyceps est également utilisé traditionnellement en médecine chinoise pour lutter contre les infections virales de type hépatite, mais semble également renforcer l’immunité présente au niveau du mucus intestinal, notamment grâce à son activité prébiotique414,415.Le reishi est un champignon utilisé depuis plus de 2000 ans en Chine416,417. Plus de 300 composés bioactifs ont été identifiés, notamment les triterpènes en plus des polysaccharides évoqués418. Ils sont impliqués dans la prévention contre certains cancers, la neurodégénérescence et pour renforcer l’immunité, notamment contre les virus (dont le VIH) 419,420 et pour stimuler l’activité des macrophages 30-32.
Vous pouvez consommer des champignons dans votre alimentation mais au regard des quantités de béta-glucanes consommés, je vous recommande plutôt une supplémentation en privilégiant des extraits standardisés en polysaccharides et bêta-glucanes : 3 gélules de 500 mg par jour au milieu d’un repas. En cas d’infection, vous pouvez doubler les doses.
L’Artémisia (Artemisia annua)
Artemisia annua est une plante traditionnellement utilisée en médecine chinoise et reconnue pour son action antiparasitaire, notamment en cas de paludisme (malaria) ou de babesiose, une des co-infections de la maladie de Lyme. Le principe actif isolé est l’artémisinine présente dans la variété Artemisia Annua (et non Artemisia Afra qui demeure néanmoins efficace grâce à ses autres composants dans une moindre mesure)421. Artemisia contient en effet plus de 400 composés actifs. Une étude de qualité a mis en évidence que les deux variétés d’Artemisia avaient une efficacité supérieure au traitement allopathique contre le paludisme (Malarone, Riamet) et moins de 5% d’effets indésirables, contre 43% avec les médicaments422. Artemisia Annua pourrait guérir jusqu’à 95% des cas de paludisme423. Elle agit notamment en s’associant au fer pour générer un puissant stress oxydatif détruisant le plasmodium. L’Artemisia semble également dotée de propriétés antivirales intéressantes, notamment contre l’herpès, les hépatites B et C, le HIV ou encore l’EBV424,425,421,426. Elle module en effet l’activité des lymphocytes T CD4+ 427 et d’un puissant médiateur, NF-κB, régulant l’activité de plusieurs cytokines (TNF-α, IL-1β, IL-8, et IL-10). Selon les variétés d’Artemisia (Annua, Afra ou Caruifolia) plusieurs principes actifs ont été identifiés au-delà de l’artémisinine, notamment l’arténusate et certains flavonoïdes comme l’arcapilline, l’isorhamnétine et la coumarine428. Après recherche, il n’existe pas d’étude significative des effets d’Artemisia Annua sur les coronavirus. Toutefois, au regard des résultats particulièrement intéressants contre le HIV, c’est une piste à ne vraiment pas négliger à mon sens. Par ailleurs, vous avez certainement connaissance de l’espoir porté envers la chloroquine (médicament Plaquenil), un autre antipaludéen. Cette molécule n’est pas comparable à l’Artemisia. Mais, dans l’incertitude et au regard de l’absence d’effets indésirables de cette plante, la question de sa place dans le cadre d’un traitement complémentaire en cas d’infection, voire de prévention, se pose légitimement.
L’Artémisia peut être utilisée en infusion (de préférence dans du lait entier que de l’eau, à adapter selon votre tolérance laitière), en teinture mère, en poudre (gélule), en jus de plante fraîche (1 cuillère à soupe par jour en utilisant un extracteur) ou en macération à froid. En cas d’infection, l’important est de consommer l’ensemble des principes actifs à hauteur d’environ 5g par litre. Vous pouvez par exemple boire cette quantité chaque jour ou consommer 3 fois 500 mg en gélules matin, midi et soir pendant 7 à 10 jours, puis réduire la prise à 1,5g par jour (dose à prendre en prévention) en intermittence avec d’autres traitements, par exemple 2 semaines par mois (pas de prise continue). Cette plante n’est actuellement pas autorisée en France en complément alimentaire. Si vous souhaitez la cultiver vous-même, je vous recommande les conseils de l’herbaliste Christophe Bernard.
La Renouée du Japon
Plante herbacée cultivée en Chine, Corée, Japon et Sibérie, la Renouée du Japon est une plante de référence dans le cadre de la maladie de Lyme. Elle permet notamment de réduire la cascade inflammatoire induite par Borrelia. Elle semble également dotée d’effets antiviraux ayant fait l’objet de plusieurs études in vitro relatives à la grippe, à l’herpès, à coxsackie, à l’hépatite B et à l’EBV429–433. Elle contient notamment deux antioxydants puissants, le resvératrol et l’émodine. Elle est par ailleurs capable de stimuler in vitro l’expression d’une cytokine importante dans le contrôle de l’immunité, l’interféron bêta (IFN-β).
L’échinacée
Reconnue traditionnellement comme une plante de choix pour traiter les infections virales, notamment respiratoires, l’échinacée a fait l’objet de nombreuses publications, y compris des revues systématiques de revues prestigieuses comme JAMA ou Cochrane434,434–436. Son efficacité semble plus marquée en prévention. En pratique, je recommande régulièrement les produits du laboratoire Phytoprevent (EPS) sous forme unitaire ou associée à du Cyprès par exemple (disponibles en pharmacie), l’équivalent d’une cuillère à café dans un peu d’eau 2 fois par jour.
Les conseils complémentaires pour renforcer son immunité
Sommeil et immunité
Le sommeil et l’immunité sont intimement liés et ce de manière bidirectionnelle31. En effet, l’activation du système immunitaire altère le sommeil et le sommeil affecte à son tour les capacités de défense du corps. Un véritable cercle vicieux. Une dette de sommeil favorise par exemple la sécrétion de cytokines pro-inflammatoires impliquées dans les maladies inflammatoires chroniques intestinales (TNF-alpha, IL-1 et IL-6), qui favorisent elles même l’altération de la qualité du sommeil437,438. La stimulation du système immunitaire déclenche une réponse inflammatoire pouvant, en fonction de son importance et de sa durée, augmenter la durée du sommeil. Il pourrait alors s’agir d’une adaptation hormonale à l’état infectieux de créer un contexte favorable de lutte de l’immunité. En effet, un sommeil de qualité induit une meilleure homéostasie de l’inflammation en modifiant la production de cytokines439. Par exemple, les lymphocytes T naïfs favorisent la production de cytokines pro-inflammatoires comme l’IL-12 pendant la nuit, alors que les leucocytes cytotoxiques stimulent la sécrétion de cytokines anti-inflammatoires (IL-10) pendant la journée439. Une privation ou une perturbation du sommeil augmente l’inflammation de bas-grade et des pathologies associées comme le diabète, les risques cardiovasculaires ou les maladies neurodégénératives. Une dette de sommeil accroit également les risques d’infections autant virales, que bactériennes et parasitaires. Il semblerait que les cellules immunitaires ne puissent en effet plus disposer de l’énergie nécessaire, normalement utilisée pendant le sommeil440. Plus la durée de sommeil est courte, plus le risque de contracter un rhume augmente441. De manière générale, un sommeil altéré réduit le nombre de lymphocytes, diminue l’expression du système HLA-DR, augmente les taux de cytokines pro-inflammatoires et perturbe la différenciation des lymphocytes CD4+ et CD8+. La privation de sommeil altère également la sécrétion des hormones stéroïdes influençant elles même la qualité du sommeil, entretenant ainsi le cercle vicieux. En conclusion et de manière très simple, meilleur sera votre sommeil, plus forte sera votre immunité ! Il s’agit d’un des piliers de votre santé.
Activité physique et immunité
Il s’agit ici d’un sujet particulier. En effet, il est parfaitement bien établi que l’activité physique exerce des effets bénéfiques sur l’immunité et sur la santé de manière générale, y compris pour les personnes malades en capacité de maintenir une activité442–444. Les personnes âgées ont également tout intérêt à maintenir une activité pour optimiser leur système immunitaire, notamment du fait de l’effet de l’âge sur la perte de masse musculaire et sur les altérations métaboliques445. Elle permet également de ralentir l’atrophie thymique (associée à une élévation d’IL-6), d’augmenter la production de lymphocytes T, de cytokines anti-inflammatoires (IL-7) et de limiter la polarisation TH17 (permettant de réduire les risques de pathologies inflammatoires chroniques ou auto-immunes) d’après une étude ayant analysé l’état immunitaire de 125 adultes âgés de 55 à 79 ans et ayant pratiquer du vélo pendant la plupart de leur vie446. Selon une revue systématique issue de Cochrane ayant analysé 11 essais cliniques incluant 904 participants, la pratique d’une activité physique dans les 30 jours qui précèdent la grippe semble réduire la durée de la maladie. Pour autant, les auteurs ne parviennent pas à certifier l’intérêt de cette pratique pré-infection dans la mesure où les différences apparaissent trop faibles447. A l’inverse, la sédentarité est un facteur de risque bien établi d’altération de la santé et d’augmentation de nombreuses pathologies métaboliques. De même, des activités intenses répétées ou de longue durée fragilisent l’immunité et augmentent les risques d’infections des voies respiratoires au cours des 24 à 48h suivant la pratique449.
Au regard de la nécessité de confinement, il n’est pas si simple de maintenir un niveau de pratique suffisant. De nombreux coach et sites internet proposent des vidéos et des conseils en ce sens, qui ne peuvent être que bénéfiques s’ils sont pratiqués dans de bonnes conditions450. Il est notamment important de bien ventiler la pièce, les risques d’infections augmentant dans les lieux confinés451. Des recommandations ont été établies en ce sens dans le cadre de la lutte contre le Covid-19452,453.
Pour les cyclistes, le home-trainer est également une alternative mais, au regard de l’épuisement des stocks, tout le monde l’a très vite compris ! Selon votre niveau physique, la réalisation de séances avec des variations d’intensité sur des périodes de 20 à 30 min sont déjà particulièrement bénéfiques. Des recommandations ont également été publiées récemment dans le cadre de l’infection au Covid-19454.
Le cas échéant, des activités comme le Yoga ou le Tai chi Quan peuvent s’avérer une très bonne solution pour entretenir votre santé si vous êtes déjà adepte et en particulier pour les personnes âgées455.
Gestion des émotions et immunité
Il est désormais bien établi (depuis plusieurs décennies) que le stress psychologique est un facteur pouvant altérer fortement le système immunitaire, notamment les risques d’infections respiratoires, mais aussi d’asthme ou de rhinite allergique456–458. Selon une étude récente d’Aout 2019, la mesure du niveau de stress évalué selon la variabilité cardiaque pourrait représenter un indicateur de la vulnérabilité immunitaire459. Une revue systématique analysant les résultats de 27 études prospectives a identifié une augmentation du risque de développer une infection respiratoire de 21% en cas de stress psychologique24. Sur la base d’un questionnaire rempli par 394 personnes en bonne santé ayant reçu des virus à l’origine du rhume, le niveau des symptômes et la fréquence de personnes exprimant l’infection se sont avérés corrélés au niveau de stress psychologique de manière dose-dépendante460. L’atteinte de l’immunité présente au niveau du mucus semble une des victimes du stress chronique461. Les enfants sont également concernés462. Récemment, l’équipe de recherche de l’INSERM dirigée par le Sophie Ugolini a mis en évidence que l’affaiblissement immunitaire serait lié à une stimulation récurrente de certains récepteurs par les hormones du stress (récepteurs β2-adrénergiques)463. A l’inverse, des personnes soumises à un état d’esprit positif ont vu leur résistance aux infections au rhume et à la grippe augmenter464. Une autre étude randomisée contrôlée auprès de 413 participants réalisant de la méditation également mis en évidence une plus grande résistance aux infections respiratoires465. L’association avec de l’activité physique accroît encore cette résistance466.
Dernier point, le tabagisme. Il est également reconnu comme un facteur de risques d’infections virales pulmonaires. Selon une revue systématique de 9 études incluant plus de 40 000 participants, les fumeurs réguliers présentent un risque de syndrome grippal plus élevé de 34% et de grippe presque 6 fois plus important30. Toutefois, au regard des données relatives aux cas chinois et publiées récemment, le fait de fumer ne semblerait pas aggraver les risques de complications467.
Anthony Berthou
Sources :
(1) Richter T, Munch G, Luth HJ, Arendt T, R Kientsch-Engel, Stahl P, Fengler D, Kuhla B. Réactivité Immunochimique d’anticorps Spécifiques de “Produits de Glycation Avancée” Avec Des “Produits de Lipoxydation Avancés.” 2005, Neurobiol vieillissement, 26 (4): 465-74.
(2) D., Y.-M. Danger Des Pesticides, Glyphosate, Perturbateurs Endocriniens. Option/Bio 2017, 28 (565), 10. https://doi.org/10.1016/S0992-5945(17)30163-0.
(3) Thevarajan, I.; Nguyen, T. H. O.; Koutsakos, M.; Druce, J.; Caly, L.; van de Sandt, C. E.; Jia, X.; Nicholson, S.; Catton, M.; Cowie, B.; Tong, S. Y. C.; Lewin, S. R.; Kedzierska, K. Breadth of Concomitant Immune Responses Prior to Patient Recovery: A Case Report of Non-Severe COVID-19. Nature Medicine 2020, 1–3. https://doi.org/10.1038/s41591-020-0819-2.
(4) Rada, B.; Leto, T. L. Oxidative Innate Immune Defenses by Nox/Duox Family NADPH Oxidases. Contrib Microbiol 2008, 15, 164–187. https://doi.org/10.1159/000136357.
(5) Hurst, J. K. What Really Happens in the Neutrophil Phagosome? Free Radic Biol Med 2012, 53 (3), 508–520. https://doi.org/10.1016/j.freeradbiomed.2012.05.008.
(6) Tse, H. M.; Thayer, T. C.; Steele, C.; Cuda, C. M.; Morel, L.; Piganelli, J. D.; Mathews, C. E. NADPH Oxidase Deficiency Regulates Th Lineage Commitment and Modulates Autoimmunity. J. Immunol. 2010, 185 (9), 5247–5258. https://doi.org/10.4049/jimmunol.1001472.
(7) Sena, L. A.; Li, S.; Jairaman, A.; Prakriya, M.; Ezponda, T.; Hildeman, D. A.; Wang, C.-R.; Schumacker, P. T.; Licht, J. D.; Perlman, H.; Bryce, P. J.; Chandel, N. S. Mitochondria Are Required for Antigen-Specific T Cell Activation through Reactive Oxygen Species Signaling. Immunity 2013, 38 (2), 225–236. https://doi.org/10.1016/j.immuni.2012.10.020.
(8) Tisoncik, J. R.; Korth, M. J.; Simmons, C. P.; Farrar, J.; Martin, T. R.; Katze, M. G. Into the Eye of the Cytokine Storm. Microbiol Mol Biol Rev 2012, 76 (1), 16–32. https://doi.org/10.1128/MMBR.05015-11.
(9) Mehta, P.; McAuley, D. F.; Brown, M.; Sanchez, E.; Tattersall, R. S.; Manson, J. J. COVID-19: Consider Cytokine Storm Syndromes and Immunosuppression. The Lancet 2020, 0 (0). https://doi.org/10.1016/S0140-6736(20)30628-0.
(10) Centre d’enregistrement des essais cliniques de la Chine-Organisation mondiale de la santé Plateforme internationale d’enregistrement des essais cliniques http://www.chictr.org.cn/index.aspx (accessed Mar 23, 2020).
(11) Fang, L.; Karakiulakis, G.; Roth, M. Are Patients with Hypertension and Diabetes Mellitus at Increased Risk for COVID-19 Infection? The Lancet Respiratory Medicine 2020, 0 (0). https://doi.org/10.1016/S2213-2600(20)30116-8.
(12) Russell, C. D.; Millar, J. E.; Baillie, J. K. Clinical Evidence Does Not Support Corticosteroid Treatment for 2019-NCoV Lung Injury. The Lancet 2020, 395 (10223), 473–475. https://doi.org/10.1016/S0140-6736(20)30317-2.
(13) Specific ACE2 Expression in Cholangiocytes May Cause Liver Damage After 2019-nCoV Infection | bioRxiv https://www.biorxiv.org/content/10.1101/2020.02.03.931766v1 (accessed Mar 23, 2020).
(14) Zhang, C.; Shi, L.; Wang, F.-S. Liver Injury in COVID-19: Management and Challenges. The Lancet Gastroenterology & Hepatology 2020, 0 (0). https://doi.org/10.1016/S2468-1253(20)30057-1.
(15) Hashimoto, T.; Perlot, T.; Rehman, A.; Trichereau, J.; Ishiguro, H.; Paolino, M.; Sigl, V.; Hanada, T.; Hanada, R.; Lipinski, S.; Wild, B.; Camargo, S. M. R.; Singer, D.; Richter, A.; Kuba, K.; Fukamizu, A.; Schreiber, S.; Clevers, H.; Verrey, F.; Rosenstiel, P.; Penninger, J. M. ACE2 Links Amino Acid Malnutrition to Microbial Ecology and Intestinal Inflammation. Nature 2012, 487 (7408), 477–481. https://doi.org/10.1038/nature11228.
(16) Gao, Q. Y.; Chen, Y. X.; Fang, J. Y. 2019 Novel Coronavirus Infection and Gastrointestinal Tract. Journal of Digestive Diseases n/a (n/a). https://doi.org/10.1111/1751-2980.12851.
(17) Bradley, K. C.; Finsterbusch, K.; Schnepf, D.; Crotta, S.; Llorian, M.; Davidson, S.; Fuchs, S. Y.; Staeheli, P.; Wack, A. Microbiota-Driven Tonic Interferon Signals in Lung Stromal Cells Protect from Influenza Virus Infection. Cell Rep 2019, 28 (1), 245-256.e4. https://doi.org/10.1016/j.celrep.2019.05.105.
(18) Diagnosis and Treatment Protocol for Novel Coronavirus Pneumonia(Trial Version 7). 17.
(19) Jamaluddin, M.; Tian, B.; Boldogh, I.; Garofalo, R. P.; Brasier, A. R. Respiratory Syncytial Virus Infection Induces a Reactive Oxygen Species-MSK1-Phospho-Ser-276 RelA Pathway Required for Cytokine Expression. J. Virol. 2009, 83 (20), 10605–10615. https://doi.org/10.1128/JVI.01090-09.
(20) Reshi, M. L.; Su, Y.-C.; Hong, J.-R. RNA Viruses: ROS-Mediated Cell Death. Int J Cell Biol 2014, 2014, 467452. https://doi.org/10.1155/2014/467452.
(21) Molteni, C. G.; Principi, N.; Esposito, S. Reactive Oxygen and Nitrogen Species during Viral Infections. Free Radic. Res. 2014, 48 (10), 1163–1169. https://doi.org/10.3109/10715762.2014.945443.
(22) Ivanov, A. V.; Valuev-Elliston, V. T.; Ivanova, O. N.; Kochetkov, S. N.; Starodubova, E. S.; Bartosch, B.; Isaguliants, M. G. Oxidative Stress during HIV Infection: Mechanisms and Consequences. Oxid Med Cell Longev 2016, 2016, 8910396. https://doi.org/10.1155/2016/8910396.
(23) Khomich, O. A.; Kochetkov, S. N.; Bartosch, B.; Ivanov, A. V. Redox Biology of Respiratory Viral Infections. Viruses 2018, 10 (8). https://doi.org/10.3390/v10080392.
(24) Pedersen, A.; Zachariae, R.; Bovbjerg, D. H. Influence of Psychological Stress on Upper Respiratory Infection–a Meta-Analysis of Prospective Studies. Psychosom Med 2010, 72 (8), 823–832. https://doi.org/10.1097/PSY.0b013e3181f1d003.
(25) Szabo, G.; Saha, B. Alcohol’s Effect on Host Defense. Alcohol Res 2015, 37 (2), 159–170.
(26) Hosseini, Z.; Whiting, S. J.; Vatanparast, H. Current Evidence on the Association of the Metabolic Syndrome and Dietary Patterns in a Global Perspective. Nutr Res Rev 2016, 29 (2), 152–162. https://doi.org/10.1017/S095442241600007X.
(27) Orru, H.; Ebi, K. L.; Forsberg, B. The Interplay of Climate Change and Air Pollution on Health. Curr Environ Health Rep 2017, 4 (4), 504–513. https://doi.org/10.1007/s40572-017-0168-6.
(28) Kerr, J.; Anderson, C.; Lippman, S. M. Physical Activity, Sedentary Behaviour, Diet, and Cancer: An Update and Emerging New Evidence. Lancet Oncol. 2017, 18 (8), e457–e471. https://doi.org/10.1016/S1470-2045(17)30411-4.
(29) Maggini, S.; Pierre, A.; Calder, P. C. Immune Function and Micronutrient Requirements Change over the Life Course. Nutrients 2018, 10 (10). https://doi.org/10.3390/nu10101531.
(30) Lawrence, H.; Hunter, A.; Murray, R.; Lim, W. S.; McKeever, T. Cigarette Smoking and the Occurrence of Influenza – Systematic Review. J. Infect. 2019, 79 (5), 401–406. https://doi.org/10.1016/j.jinf.2019.08.014.
(31) Besedovsky, L.; Lange, T.; Haack, M. The Sleep-Immune Crosstalk in Health and Disease. Physiol. Rev. 2019, 99 (3), 1325–1380. https://doi.org/10.1152/physrev.00010.2018.
(32) Bhaskaran, K.; Dos-Santos-Silva, I.; Leon, D. A.; Douglas, I. J.; Smeeth, L. Association of BMI with Overall and Cause-Specific Mortality: A Population-Based Cohort Study of 3·6 Million Adults in the UK. Lancet Diabetes Endocrinol 2018, 6 (12), 944–953. https://doi.org/10.1016/S2213-8587(18)30288-2.
(33) Christ, A.; Lauterbach, M.; Latz, E. Western Diet and the Immune System: An Inflammatory Connection. Immunity 2019, 51 (5), 794–811. https://doi.org/10.1016/j.immuni.2019.09.020.
(34) Belkaid, Y.; Harrison, O. J. Homeostatic Immunity and the Microbiota. Immunity 2017, 46 (4), 562–576. https://doi.org/10.1016/j.immuni.2017.04.008.
(35) Qin, J.; Li, R.; Raes, J.; Arumugam, M.; Burgdorf, K. S.; Manichanh, C.; Nielsen, T.; Pons, N.; Levenez, F.; Yamada, T.; Mende, D. R.; Li, J.; Xu, J.; Li, S.; Li, D.; Cao, J.; Wang, B.; Liang, H.; Zheng, H.; Xie, Y.; Tap, J.; Lepage, P.; Bertalan, M.; Batto, J.-M.; Hansen, T.; Le Paslier, D.; Linneberg, A.; Nielsen, H. B.; Pelletier, E.; Renault, P.; Sicheritz-Ponten, T.; Turner, K.; Zhu, H.; Yu, C.; Li, S.; Jian, M.; Zhou, Y.; Li, Y.; Zhang, X.; Li, S.; Qin, N.; Yang, H.; Wang, J.; Brunak, S.; Doré, J.; Guarner, F.; Kristiansen, K.; Pedersen, O.; Parkhill, J.; Weissenbach, J.; MetaHIT Consortium; Bork, P.; Ehrlich, S. D.; Wang, J. A Human Gut Microbial Gene Catalogue Established by Metagenomic Sequencing. Nature 2010, 464 (7285), 59–65. https://doi.org/10.1038/nature08821.
(36) Laterza, L.; Rizzatti, G.; Gaetani, E.; Chiusolo, P.; Gasbarrini, A. The Gut Microbiota and Immune System Relationship in Human Graft-versus-Host Disease. Mediterr J Hematol Infect Dis 2016, 8 (1), e2016025. https://doi.org/10.4084/MJHID.2016.025.
(37) Walker, A. W.; Ince, J.; Duncan, S. H.; Webster, L. M.; Holtrop, G.; Ze, X.; Brown, D.; Stares, M. D.; Scott, P.; Bergerat, A.; Louis, P.; McIntosh, F.; Johnstone, A. M.; Lobley, G. E.; Parkhill, J.; Flint, H. J. Dominant and Diet-Responsive Groups of Bacteria within the Human Colonic Microbiota. ISME J 2011, 5 (2), 220–230. https://doi.org/10.1038/ismej.2010.118.
(38) Helander, H. F.; Fändriks, L. Surface Area of the Digestive Tract – Revisited. Scand. J. Gastroenterol. 2014, 49 (6), 681–689. https://doi.org/10.3109/00365521.2014.898326.
(39) Mowat, A. M.; Agace, W. W. Regional Specialization within the Intestinal Immune System. Nat. Rev. Immunol. 2014, 14 (10), 667–685. https://doi.org/10.1038/nri3738.
(40) Lundin, A.; Bok, C. M.; Aronsson, L.; Björkholm, B.; Gustafsson, J.-A.; Pott, S.; Arulampalam, V.; Hibberd, M.; Rafter, J.; Pettersson, S. Gut Flora, Toll-like Receptors and Nuclear Receptors: A Tripartite Communication That Tunes Innate Immunity in Large Intestine. Cell. Microbiol. 2008, 10 (5), 1093–1103. https://doi.org/10.1111/j.1462-5822.2007.01108.x.
(41) Artis, D. Epithelial-Cell Recognition of Commensal Bacteria and Maintenance of Immune Homeostasis in the Gut. Nat. Rev. Immunol. 2008, 8 (6), 411–420. https://doi.org/10.1038/nri2316.
(42) Chassaing, B.; Ley, R. E.; Gewirtz, A. T. Intestinal Epithelial Cell Toll-like Receptor 5 Regulates the Intestinal Microbiota to Prevent Low-Grade Inflammation and Metabolic Syndrome in Mice. Gastroenterology 2014, 147 (6), 1363-1377.e17. https://doi.org/10.1053/j.gastro.2014.08.033.
(43) Denou, E.; Lolmède, K.; Garidou, L.; Pomie, C.; Chabo, C.; Lau, T. C.; Fullerton, M. D.; Nigro, G.; Zakaroff-Girard, A.; Luche, E.; Garret, C.; Serino, M.; Amar, J.; Courtney, M.; Cavallari, J. F.; Henriksbo, B. D.; Barra, N. G.; Foley, K. P.; McPhee, J. B.; Duggan, B. M.; O’Neill, H. M.; Lee, A. J.; Sansonetti, P.; Ashkar, A. A.; Khan, W. I.; Surette, M. G.; Bouloumié, A.; Steinberg, G. R.; Burcelin, R.; Schertzer, J. D. Defective NOD2 Peptidoglycan Sensing Promotes Diet-Induced Inflammation, Dysbiosis, and Insulin Resistance. EMBO Mol Med 2015, 7 (3), 259–274. https://doi.org/10.15252/emmm.201404169.
(44) Madara, J. L.; Stafford, J. Interferon-Gamma Directly Affects Barrier Function of Cultured Intestinal Epithelial Monolayers. J Clin Invest 1989, 83 (2), 724–727.
(45) Berkes, J.; Viswanathan, V. K.; Savkovic, S. D.; Hecht, G. Intestinal Epithelial Responses to Enteric Pathogens: Effects on the Tight Junction Barrier, Ion Transport, and Inflammation. Gut 2003, 52 (3), 439–451.
(46) Hietbrink, F.; Besselink, M. G. H.; Renooij, W.; de Smet, M. B. M.; Draisma, A.; van der Hoeven, H.; Pickkers, P. Systemic Inflammation Increases Intestinal Permeability during Experimental Human Endotoxemia. Shock 2009, 32 (4), 374–378. https://doi.org/10.1097/SHK.0b013e3181a2bcd6.
(47) Turner, J. R. Intestinal Mucosal Barrier Function in Health and Disease. Nat. Rev. Immunol. 2009, 9 (11), 799–809. https://doi.org/10.1038/nri2653.
(48) Natividad, J. M. M.; Verdu, E. F. Modulation of Intestinal Barrier by Intestinal Microbiota: Pathological and Therapeutic Implications. Pharmacol. Res. 2013, 69 (1), 42–51. https://doi.org/10.1016/j.phrs.2012.10.007.
(49) Turner, J. R.; Buschmann, M. M.; Romero-Calvo, I.; Sailer, A.; Shen, L. The Role of Molecular Remodeling in Differential Regulation of Tight Junction Permeability. Semin. Cell Dev. Biol. 2014, 36, 204–212. https://doi.org/10.1016/j.semcdb.2014.09.022.
(50) van Lier, D.; Geven, C.; Leijte, G. P.; Pickkers, P. Experimental Human Endotoxemia as a Model of Systemic Inflammation. Biochimie 2019, 159, 99–106. https://doi.org/10.1016/j.biochi.2018.06.014.
(51) König, J.; Wells, J.; Cani, P. D.; García-Ródenas, C. L.; MacDonald, T.; Mercenier, A.; Whyte, J.; Troost, F.; Brummer, R.-J. Human Intestinal Barrier Function in Health and Disease. Clin Transl Gastroenterol 2016, 7 (10), e196. https://doi.org/10.1038/ctg.2016.54.
(52) Wells, J. M.; Brummer, R. J.; Derrien, M.; MacDonald, T. T.; Troost, F.; Cani, P. D.; Theodorou, V.; Dekker, J.; Méheust, A.; de Vos, W. M.; Mercenier, A.; Nauta, A.; Garcia-Rodenas, C. L. Homeostasis of the Gut Barrier and Potential Biomarkers. Am. J. Physiol. Gastrointest. Liver Physiol. 2017, 312 (3), G171–G193. https://doi.org/10.1152/ajpgi.00048.2015.
(53) Bhattarai, Y.; Muniz Pedrogo, D. A.; Kashyap, P. C. Irritable Bowel Syndrome: A Gut Microbiota-Related Disorder? Am. J. Physiol. Gastrointest. Liver Physiol. 2017, 312 (1), G52–G62. https://doi.org/10.1152/ajpgi.00338.2016.
(54) Salem, A. E.; Singh, R.; Ayoub, Y. K.; Khairy, A. M.; Mullin, G. E. The Gut Microbiome and Irritable Bowel Syndrome: State of Art Review. Arab J Gastroenterol 2018, 19 (3), 136–141. https://doi.org/10.1016/j.ajg.2018.02.008.
(55) Cani, P. D.; Amar, J.; Iglesias, M. A.; Poggi, M.; Knauf, C.; Bastelica, D.; Neyrinck, A. M.; Fava, F.; Tuohy, K. M.; Chabo, C.; Waget, A.; Delmée, E.; Cousin, B.; Sulpice, T.; Chamontin, B.; Ferrières, J.; Tanti, J.-F.; Gibson, G. R.; Casteilla, L.; Delzenne, N. M.; Alessi, M. C.; Burcelin, R. Metabolic Endotoxemia Initiates Obesity and Insulin Resistance. Diabetes 2007, 56 (7), 1761–1772. https://doi.org/10.2337/db06-1491.
(56) Hooper, L. V.; Macpherson, A. J. Immune Adaptations That Maintain Homeostasis with the Intestinal Microbiota. Nat. Rev. Immunol. 2010, 10 (3), 159–169. https://doi.org/10.1038/nri2710.
(57) Laugerette, F.; Vors, C.; Géloën, A.; Chauvin, M.-A.; Soulage, C.; Lambert-Porcheron, S.; Peretti, N.; Alligier, M.; Burcelin, R.; Laville, M.; Vidal, H.; Michalski, M.-C. Emulsified Lipids Increase Endotoxemia: Possible Role in Early Postprandial Low-Grade Inflammation. J. Nutr. Biochem. 2011, 22 (1), 53–59. https://doi.org/10.1016/j.jnutbio.2009.11.011.
(58) Lassenius, M. I.; Pietiläinen, K. H.; Kaartinen, K.; Pussinen, P. J.; Syrjänen, J.; Forsblom, C.; Pörsti, I.; Rissanen, A.; Kaprio, J.; Mustonen, J.; Groop, P.-H.; Lehto, M.; FinnDiane Study Group. Bacterial Endotoxin Activity in Human Serum Is Associated with Dyslipidemia, Insulin Resistance, Obesity, and Chronic Inflammation. Diabetes Care 2011, 34 (8), 1809–1815. https://doi.org/10.2337/dc10-2197.
(59) Everard, A.; Geurts, L.; Caesar, R.; Van Hul, M.; Matamoros, S.; Duparc, T.; Denis, R. G. P.; Cochez, P.; Pierard, F.; Castel, J.; Bindels, L. B.; Plovier, H.; Robine, S.; Muccioli, G. G.; Renauld, J.-C.; Dumoutier, L.; Delzenne, N. M.; Luquet, S.; Bäckhed, F.; Cani, P. D. Intestinal Epithelial MyD88 Is a Sensor Switching Host Metabolism towards Obesity According to Nutritional Status. Nat Commun 2014, 5, 5648. https://doi.org/10.1038/ncomms6648.
(60) Jayashree, B.; Bibin, Y. S.; Prabhu, D.; Shanthirani, C. S.; Gokulakrishnan, K.; Lakshmi, B. S.; Mohan, V.; Balasubramanyam, M. Increased Circulatory Levels of Lipopolysaccharide (LPS) and Zonulin Signify Novel Biomarkers of Proinflammation in Patients with Type 2 Diabetes. Mol Cell Biochem 2014, 388 (1), 203–210. https://doi.org/10.1007/s11010-013-1911-4.
(61) Magalhaes, I.; Pingris, K.; Poitou, C.; Bessoles, S.; Venteclef, N.; Kiaf, B.; Beaudoin, L.; Da Silva, J.; Allatif, O.; Rossjohn, J.; Kjer-Nielsen, L.; McCluskey, J.; Ledoux, S.; Genser, L.; Torcivia, A.; Soudais, C.; Lantz, O.; Boitard, C.; Aron-Wisnewsky, J.; Larger, E.; Clément, K.; Lehuen, A. Mucosal-Associated Invariant T Cell Alterations in Obese and Type 2 Diabetic Patients. J. Clin. Invest. 2015, 125 (4), 1752–1762. https://doi.org/10.1172/JCI78941.
(62) Radilla-Vázquez, R. B.; Parra-Rojas, I.; Martínez-Hernández, N. E.; Márquez-Sandoval, Y. F.; Illades-Aguiar, B.; Castro-Alarcón, N. Gut Microbiota and Metabolic Endotoxemia in Young Obese Mexican Subjects. Obes Facts 2016, 9 (1), 1–11. https://doi.org/10.1159/000442479.
(63) Duparc, T.; Plovier, H.; Marrachelli, V. G.; Van Hul, M.; Essaghir, A.; Ståhlman, M.; Matamoros, S.; Geurts, L.; Pardo-Tendero, M. M.; Druart, C.; Delzenne, N. M.; Demoulin, J.-B.; van der Merwe, S. W.; van Pelt, J.; Bäckhed, F.; Monleon, D.; Everard, A.; Cani, P. D. Hepatocyte MyD88 Affects Bile Acids, Gut Microbiota and Metabolome Contributing to Regulate Glucose and Lipid Metabolism. Gut 2017, 66 (4), 620–632. https://doi.org/10.1136/gutjnl-2015-310904.
(64) Gomes, J. M. G.; Costa, J. de A.; Alfenas, R. de C. G. Metabolic Endotoxemia and Diabetes Mellitus: A Systematic Review. Metab. Clin. Exp. 2017, 68, 133–144. https://doi.org/10.1016/j.metabol.2016.12.009.
(65) Fasano, A. Zonulin and Its Regulation of Intestinal Barrier Function: The Biological Door to Inflammation, Autoimmunity, and Cancer. Physiol. Rev. 2011, 91 (1), 151–175. https://doi.org/10.1152/physrev.00003.2008.
(66) Clemente, M. G.; De Virgiliis, S.; Kang, J. S.; Macatagney, R.; Musu, M. P.; Di Pierro, M. R.; Drago, S.; Congia, M.; Fasano, A. Early Effects of Gliadin on Enterocyte Intracellular Signalling Involved in Intestinal Barrier Function. Gut 2003, 52 (2), 218–223. https://doi.org/10.1136/gut.52.2.218.
(67) Lammers, K. M.; Lu, R.; Brownley, J.; Lu, B.; Gerard, C.; Thomas, K.; Rallabhandi, P.; Shea-Donohue, T.; Tamiz, A.; Alkan, S.; Netzel-Arnett, S.; Antalis, T.; Vogel, S. N.; Fasano, A. Gliadin Induces an Increase in Intestinal Permeability and Zonulin Release by Binding to the Chemokine Receptor CXCR3. Gastroenterology 2008, 135 (1), 194-204.e3. https://doi.org/10.1053/j.gastro.2008.03.023.
(68) Drago, S.; El Asmar, R.; Di Pierro, M.; Grazia Clemente, M.; Tripathi, A.; Sapone, A.; Thakar, M.; Iacono, G.; Carroccio, A.; D’Agate, C.; Not, T.; Zampini, L.; Catassi, C.; Fasano, A. Gliadin, Zonulin and Gut Permeability: Effects on Celiac and Non-Celiac Intestinal Mucosa and Intestinal Cell Lines. Scand. J. Gastroenterol. 2006, 41 (4), 408–419. https://doi.org/10.1080/00365520500235334.
(69) Valitutti, F.; Fasano, A. Breaking Down Barriers: How Understanding Celiac Disease Pathogenesis Informed the Development of Novel Treatments. Dig. Dis. Sci. 2019, 64 (7), 1748–1758. https://doi.org/10.1007/s10620-019-05646-y.
(70) Blander, J. M.; Longman, R. S.; Iliev, I. D.; Sonnenberg, G. F.; Artis, D. Regulation of Inflammation by Microbiota Interactions with the Host. Nat. Immunol. 2017, 18 (8), 851–860. https://doi.org/10.1038/ni.3780.
(71) Kubinak, J. L.; Round, J. L. Do Antibodies Select a Healthy Microbiota? Nat. Rev. Immunol. 2016, 16 (12), 767–774. https://doi.org/10.1038/nri.2016.114.
(72) Bunker, J. J.; Erickson, S. A.; Flynn, T. M.; Henry, C.; Koval, J. C.; Meisel, M.; Jabri, B.; Antonopoulos, D. A.; Wilson, P. C.; Bendelac, A. Natural Polyreactive IgA Antibodies Coat the Intestinal Microbiota. Science 2017, 358 (6361). https://doi.org/10.1126/science.aan6619.
(73) Bunker, J. J.; Bendelac, A. IgA Responses to Microbiota. Immunity 2018, 49 (2), 211–224. https://doi.org/10.1016/j.immuni.2018.08.011.
(74) Macpherson, A. J.; Yilmaz, B.; Limenitakis, J. P.; Ganal-Vonarburg, S. C. IgA Function in Relation to the Intestinal Microbiota. Annu. Rev. Immunol. 2018, 36, 359–381. https://doi.org/10.1146/annurev-immunol-042617-053238.
(75) Olivares, M.; Walker, A. W.; Capilla, A.; Benítez-Páez, A.; Palau, F.; Parkhill, J.; Castillejo, G.; Sanz, Y. Gut Microbiota Trajectory in Early Life May Predict Development of Celiac Disease. Microbiome 2018, 6 (1), 36. https://doi.org/10.1186/s40168-018-0415-6.
(76) Lee, Y. K.; Mazmanian, S. K. Has the Microbiota Played a Critical Role in the Evolution of the Adaptive Immune System? Science 2010, 330 (6012), 1768–1773. https://doi.org/10.1126/science.1195568.
(77) Belkaid, Y.; Hand, T. Role of the Microbiota in Immunity and Inflammation. Cell 2014, 157 (1), 121–141. https://doi.org/10.1016/j.cell.2014.03.011.
(78) Hirschberg, S.; Gisevius, B.; Duscha, A.; Haghikia, A. Implications of Diet and The Gut Microbiome in Neuroinflammatory and Neurodegenerative Diseases. Int J Mol Sci 2019, 20 (12). https://doi.org/10.3390/ijms20123109.
(79) Sencio, V.; Barthelemy, A.; Tavares, L. P.; Machado, M. G.; Soulard, D.; Cuinat, C.; Queiroz-Junior, C. M.; Noordine, M.-L.; Salomé-Desnoulez, S.; Deryuter, L.; Foligné, B.; Wahl, C.; Frisch, B.; Vieira, A. T.; Paget, C.; Milligan, G.; Ulven, T.; Wolowczuk, I.; Faveeuw, C.; Le Goffic, R.; Thomas, M.; Ferreira, S.; Teixeira, M. M.; Trottein, F. Gut Dysbiosis during Influenza Contributes to Pulmonary Pneumococcal Superinfection through Altered Short-Chain Fatty Acid Production. Cell Rep 2020, 30 (9), 2934-2947.e6. https://doi.org/10.1016/j.celrep.2020.02.013.
(80) Mastromarino, P.; Capobianco, D.; Miccheli, A.; Praticò, G.; Campagna, G.; Laforgia, N.; Capursi, T.; Baldassarre, M. E. Administration of a Multistrain Probiotic Product (VSL#3) to Women in the Perinatal Period Differentially Affects Breast Milk Beneficial Microbiota in Relation to Mode of Delivery. Pharmacol. Res. 2015, 95–96, 63–70. https://doi.org/10.1016/j.phrs.2015.03.013.
(81) Cenit, M. C.; Olivares, M.; Codoñer-Franch, P.; Sanz, Y. Intestinal Microbiota and Celiac Disease: Cause, Consequence or Co-Evolution? Nutrients 2015, 7 (8), 6900–6923. https://doi.org/10.3390/nu7085314.
(82) Rogier, R.; Evans-Marin, H.; Manasson, J.; van der Kraan, P. M.; Walgreen, B.; Helsen, M. M.; van den Bersselaar, L. A.; van de Loo, F. A.; van Lent, P. L.; Abramson, S. B.; van den Berg, W. B.; Koenders, M. I.; Scher, J. U.; Abdollahi-Roodsaz, S. Alteration of the Intestinal Microbiome Characterizes Preclinical Inflammatory Arthritis in Mice and Its Modulation Attenuates Established Arthritis. Sci Rep 2017, 7 (1), 15613. https://doi.org/10.1038/s41598-017-15802-x.
(83) Horta-Baas, G.; Romero-Figueroa, M. D. S.; Montiel-Jarquín, A. J.; Pizano-Zárate, M. L.; García-Mena, J.; Ramírez-Durán, N. Intestinal Dysbiosis and Rheumatoid Arthritis: A Link between Gut Microbiota and the Pathogenesis of Rheumatoid Arthritis. J Immunol Res 2017, 2017, 4835189. https://doi.org/10.1155/2017/4835189.
(84) Buscarinu, M. C.; Cerasoli, B.; Annibali, V.; Policano, C.; Lionetto, L.; Capi, M.; Mechelli, R.; Romano, S.; Fornasiero, A.; Mattei, G.; Piras, E.; Angelini, D. F.; Battistini, L.; Simmaco, M.; Umeton, R.; Salvetti, M.; Ristori, G. Altered Intestinal Permeability in Patients with Relapsing-Remitting Multiple Sclerosis: A Pilot Study. Mult. Scler. 2017, 23 (3), 442–446. https://doi.org/10.1177/1352458516652498.
(85) Colpitts, S. L.; Kasper, E. J.; Keever, A.; Liljenberg, C.; Kirby, T.; Magori, K.; Kasper, L. H.; Ochoa-Repáraz, J. A Bidirectional Association between the Gut Microbiota and CNS Disease in a Biphasic Murine Model of Multiple Sclerosis. Gut Microbes 2017, 8 (6), 561–573. https://doi.org/10.1080/19490976.2017.1353843.
(86) Chander, A. M.; Yadav, H.; Jain, S.; Bhadada, S. K.; Dhawan, D. K. Cross-Talk Between Gluten, Intestinal Microbiota and Intestinal Mucosa in Celiac Disease: Recent Advances and Basis of Autoimmunity. Front Microbiol 2018, 9, 2597. https://doi.org/10.3389/fmicb.2018.02597.
(87) Azimi, T.; Nasiri, M. J.; Chirani, A. S.; Pouriran, R.; Dabiri, H. The Role of Bacteria in the Inflammatory Bowel Disease Development: A Narrative Review. APMIS 2018, 126 (4), 275–283. https://doi.org/10.1111/apm.12814.
(88) Chibbar, R.; Dieleman, L. A. The Gut Microbiota in Celiac Disease and Probiotics. Nutrients 2019, 11 (10). https://doi.org/10.3390/nu11102375.
(89) Gianchecchi, E.; Fierabracci, A. Recent Advances on Microbiota Involvement in the Pathogenesis of Autoimmunity. Int J Mol Sci 2019, 20 (2). https://doi.org/10.3390/ijms20020283.
(90) Buscarinu, M. C.; Fornasiero, A.; Romano, S.; Ferraldeschi, M.; Mechelli, R.; Reniè, R.; Morena, E.; Romano, C.; Pellicciari, G.; Landi, A. C.; Salvetti, M.; Ristori, G. The Contribution of Gut Barrier Changes to Multiple Sclerosis Pathophysiology. Front Immunol 2019, 10, 1916. https://doi.org/10.3389/fimmu.2019.01916.
(91) Perdigoto, A. L.; Chatenoud, L.; Bluestone, J. A.; Herold, K. C. Inducing and Administering Tregs to Treat Human Disease. Front Immunol 2016, 6. https://doi.org/10.3389/fimmu.2015.00654.
(92) Komiyama, Y.; Nakae, S.; Matsuki, T.; Nambu, A.; Ishigame, H.; Kakuta, S.; Sudo, K.; Iwakura, Y. IL-17 Plays an Important Role in the Development of Experimental Autoimmune Encephalomyelitis. J. Immunol. 2006, 177 (1), 566–573. https://doi.org/10.4049/jimmunol.177.1.566.
(93) Hofstetter, H. H.; Ibrahim, S. M.; Koczan, D.; Kruse, N.; Weishaupt, A.; Toyka, K. V.; Gold, R. Therapeutic Efficacy of IL-17 Neutralization in Murine Experimental Autoimmune Encephalomyelitis. Cell. Immunol. 2005, 237 (2), 123–130. https://doi.org/10.1016/j.cellimm.2005.11.002.
(94) Schmitz, K.; Geisslinger, G.; Tegeder, I. Monoclonal Antibodies in Preclinical EAE Models of Multiple Sclerosis: A Systematic Review. Int J Mol Sci 2017, 18 (9). https://doi.org/10.3390/ijms18091992.
(95) Atarashi, K.; Nishimura, J.; Shima, T.; Umesaki, Y.; Yamamoto, M.; Onoue, M.; Yagita, H.; Ishii, N.; Evans, R.; Honda, K.; Takeda, K. ATP Drives Lamina Propria T(H)17 Cell Differentiation. Nature 2008, 455 (7214), 808–812. https://doi.org/10.1038/nature07240.
(96) Wu, H.-J.; Ivanov, I. I.; Darce, J.; Hattori, K.; Shima, T.; Umesaki, Y.; Littman, D. R.; Benoist, C.; Mathis, D. Gut-Residing Segmented Filamentous Bacteria Drive Autoimmune Arthritis via T Helper 17 Cells. Immunity 2010, 32 (6), 815–827. https://doi.org/10.1016/j.immuni.2010.06.001.
(97) Lee, Y. K.; Menezes, J. S.; Umesaki, Y.; Mazmanian, S. K. Proinflammatory T-Cell Responses to Gut Microbiota Promote Experimental Autoimmune Encephalomyelitis. Proc. Natl. Acad. Sci. U.S.A. 2011, 108 Suppl 1, 4615–4622. https://doi.org/10.1073/pnas.1000082107.
(98) Chappert, P. Role of SFB in Autoimmune Arthritis: An Example of Regulation of Autoreactive T Cell Sensitivity in the Gut. Gut Microbes 2014, 5 (2), 259–264. https://doi.org/10.4161/gmic.28134.
(99) Teng, F.; Klinger, C. N.; Felix, K. M.; Bradley, C. P.; Wu, E.; Tran, N. L.; Umesaki, Y.; Wu, H.-J. J. Gut Microbiota Drive Autoimmune Arthritis by Promoting Differentiation and Migration of Peyer’s Patch T Follicular Helper Cells. Immunity 2016, 44 (4), 875–888. https://doi.org/10.1016/j.immuni.2016.03.013.
(100) Schnupf, P.; Gaboriau-Routhiau, V.; Sansonetti, P. J.; Cerf-Bensussan, N. Segmented Filamentous Bacteria, Th17 Inducers and Helpers in a Hostile World. Curr. Opin. Microbiol. 2017, 35, 100–109. https://doi.org/10.1016/j.mib.2017.03.004.
(101) Bradley, C. P.; Teng, F.; Felix, K. M.; Sano, T.; Naskar, D.; Block, K. E.; Huang, H.; Knox, K. S.; Littman, D. R.; Wu, H.-J. J. Segmented Filamentous Bacteria Provoke Lung Autoimmunity by Inducing Gut-Lung Axis Th17 Cells Expressing Dual TCRs. Cell Host Microbe 2017, 22 (5), 697-704.e4. https://doi.org/10.1016/j.chom.2017.10.007.
(102) Berer, K.; Mues, M.; Koutrolos, M.; Rasbi, Z. A.; Boziki, M.; Johner, C.; Wekerle, H.; Krishnamoorthy, G. Commensal Microbiota and Myelin Autoantigen Cooperate to Trigger Autoimmune Demyelination. Nature 2011, 479 (7374), 538–541. https://doi.org/10.1038/nature10554.
(103) Fernández-Bañares, F.; Hinojosa, J.; Sánchez-Lombraña, J. L.; Navarro, E.; Martínez-Salmerón, J. F.; García-Pugés, A.; González-Huix, F.; Riera, J.; González-Lara, V.; Domínguez-Abascal, F.; Giné, J. J.; Moles, J.; Gomollón, F.; Gassull, M. A. Randomized Clinical Trial of Plantago Ovata Seeds (Dietary Fiber) as Compared with Mesalamine in Maintaining Remission in Ulcerative Colitis. Spanish Group for the Study of Crohn’s Disease and Ulcerative Colitis (GETECCU). Am. J. Gastroenterol. 1999, 94 (2), 427–433. https://doi.org/10.1111/j.1572-0241.1999.872_a.x.
(104) Topping, D. L.; Clifton, P. M. Short-Chain Fatty Acids and Human Colonic Function: Roles of Resistant Starch and Nonstarch Polysaccharides. Physiol. Rev. 2001, 81 (3), 1031–1064. https://doi.org/10.1152/physrev.2001.81.3.1031.
(105) Maier, T. V.; Lucio, M.; Lee, L. H.; VerBerkmoes, N. C.; Brislawn, C. J.; Bernhardt, J.; Lamendella, R.; McDermott, J. E.; Bergeron, N.; Heinzmann, S. S.; Morton, J. T.; González, A.; Ackermann, G.; Knight, R.; Riedel, K.; Krauss, R. M.; Schmitt-Kopplin, P.; Jansson, J. K. Impact of Dietary Resistant Starch on the Human Gut Microbiome, Metaproteome, and Metabolome. mBio 2017, 8 (5). https://doi.org/10.1128/mBio.01343-17.
(106) Hamer, H. M.; Jonkers, D.; Venema, K.; Vanhoutvin, S.; Troost, F. J.; Brummer, R.-J. Review Article: The Role of Butyrate on Colonic Function. Aliment. Pharmacol. Ther. 2008, 27 (2), 104–119. https://doi.org/10.1111/j.1365-2036.2007.03562.x.
(107) Heiman, M. L.; Greenway, F. L. A Healthy Gastrointestinal Microbiome Is Dependent on Dietary Diversity. Mol Metab 2016, 5 (5), 317–320. https://doi.org/10.1016/j.molmet.2016.02.005.
(108) Gentile, C. L.; Weir, T. L. The Gut Microbiota at the Intersection of Diet and Human Health. Science 2018, 362 (6416), 776–780. https://doi.org/10.1126/science.aau5812.
(109) Zinöcker, M. K.; Lindseth, I. A. The Western Diet-Microbiome-Host Interaction and Its Role in Metabolic Disease. Nutrients 2018, 10 (3). https://doi.org/10.3390/nu10030365.
(110) McDonald, D.; Hyde, E.; Debelius, J. W.; Morton, J. T.; Gonzalez, A.; Ackermann, G.; Aksenov, A. A.; Behsaz, B.; Brennan, C.; Chen, Y.; DeRight Goldasich, L.; Dorrestein, P. C.; Dunn, R. R.; Fahimipour, A. K.; Gaffney, J.; Gilbert, J. A.; Gogul, G.; Green, J. L.; Hugenholtz, P.; Humphrey, G.; Huttenhower, C.; Jackson, M. A.; Janssen, S.; Jeste, D. V.; Jiang, L.; Kelley, S. T.; Knights, D.; Kosciolek, T.; Ladau, J.; Leach, J.; Marotz, C.; Meleshko, D.; Melnik, A. V.; Metcalf, J. L.; Mohimani, H.; Montassier, E.; Navas-Molina, J.; Nguyen, T. T.; Peddada, S.; Pevzner, P.; Pollard, K. S.; Rahnavard, G.; Robbins-Pianka, A.; Sangwan, N.; Shorenstein, J.; Smarr, L.; Song, S. J.; Spector, T.; Swafford, A. D.; Thackray, V. G.; Thompson, L. R.; Tripathi, A.; Vázquez-Baeza, Y.; Vrbanac, A.; Wischmeyer, P.; Wolfe, E.; Zhu, Q.; Knight, R. American Gut: An Open Platform for Citizen Science Microbiome Research. mSystems 2018, 3 (3). https://doi.org/10.1128/mSystems.00031-18.
(111) Johnson, A. J.; Vangay, P.; Al-Ghalith, G. A.; Hillmann, B. M.; Ward, T. L.; Shields-Cutler, R. R.; Kim, A. D.; Shmagel, A. K.; Syed, A. N.; Personalized Microbiome Class Students; Walter, J.; Menon, R.; Koecher, K.; Knights, D. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans. Cell Host Microbe 2019, 25 (6), 789-802.e5. https://doi.org/10.1016/j.chom.2019.05.005.
(112) Zhang, C.; Björkman, A.; Cai, K.; Liu, G.; Wang, C.; Li, Y.; Xia, H.; Sun, L.; Kristiansen, K.; Wang, J.; Han, J.; Hammarström, L.; Pan-Hammarström, Q. Impact of a 3-Months Vegetarian Diet on the Gut Microbiota and Immune Repertoire. Front Immunol 2018, 9, 908. https://doi.org/10.3389/fimmu.2018.00908.
(113) Losasso, C.; Eckert, E. M.; Mastrorilli, E.; Villiger, J.; Mancin, M.; Patuzzi, I.; Di Cesare, A.; Cibin, V.; Barrucci, F.; Pernthaler, J.; Corno, G.; Ricci, A. Assessing the Influence of Vegan, Vegetarian and Omnivore Oriented Westernized Dietary Styles on Human Gut Microbiota: A Cross Sectional Study. Front Microbiol 2018, 9, 317. https://doi.org/10.3389/fmicb.2018.00317.
(114) Wu, G. D.; Compher, C.; Chen, E. Z.; Smith, S. A.; Shah, R. D.; Bittinger, K.; Chehoud, C.; Albenberg, L. G.; Nessel, L.; Gilroy, E.; Star, J.; Weljie, A. M.; Flint, H. J.; Metz, D. C.; Bennett, M. J.; Li, H.; Bushman, F. D.; Lewis, J. D. Comparative Metabolomics in Vegans and Omnivores Reveal Constraints on Diet-Dependent Gut Microbiota Metabolite Production. Gut 2016, 65 (1), 63–72. https://doi.org/10.1136/gutjnl-2014-308209.
(115) David, L. A.; Maurice, C. F.; Carmody, R. N.; Gootenberg, D. B.; Button, J. E.; Wolfe, B. E.; Ling, A. V.; Devlin, A. S.; Varma, Y.; Fischbach, M. A.; Biddinger, S. B.; Dutton, R. J.; Turnbaugh, P. J. Diet Rapidly and Reproducibly Alters the Human Gut Microbiome. Nature 2014, 505 (7484), 559–563. https://doi.org/10.1038/nature12820.
(116) Maldonado Galdeano, C.; Cazorla, S. I.; Lemme Dumit, J. M.; Vélez, E.; Perdigón, G. Beneficial Effects of Probiotic Consumption on the Immune System. Ann. Nutr. Metab. 2019, 74 (2), 115–124. https://doi.org/10.1159/000496426.
(117) Ouwehand, A. C.; Salminen, S.; Isolauri, E. Probiotics: An Overview of Beneficial Effects. Antonie Van Leeuwenhoek 2002, 82 (1–4), 279–289.
(118) Marco, M. L.; Heeney, D.; Binda, S.; Cifelli, C. J.; Cotter, P. D.; Foligné, B.; Gänzle, M.; Kort, R.; Pasin, G.; Pihlanto, A.; Smid, E. J.; Hutkins, R. Health Benefits of Fermented Foods: Microbiota and Beyond. Curr. Opin. Biotechnol. 2017, 44, 94–102. https://doi.org/10.1016/j.copbio.2016.11.010.
(119) Usami, M.; Muraki, K.; Iwamoto, M.; Ohata, A.; Matsushita, E.; Miki, A. Effect of Eicosapentaenoic Acid (EPA) on Tight Junction Permeability in Intestinal Monolayer Cells. Clin Nutr 2001, 20 (4), 351–359. https://doi.org/10.1054/clnu.2001.0430.
(120) Usami, M.; Komurasaki, T.; Hanada, A.; Kinoshita, K.; Ohata, A. Effect of Gamma-Linolenic Acid or Docosahexaenoic Acid on Tight Junction Permeability in Intestinal Monolayer Cells and Their Mechanism by Protein Kinase C Activation and/or Eicosanoid Formation. Nutrition 2003, 19 (2), 150–156. https://doi.org/10.1016/s0899-9007(02)00927-9.
(121) Roig-Pérez, S.; Cortadellas, N.; Moretó, M.; Ferrer, R. Intracellular Mechanisms Involved in Docosahexaenoic Acid-Induced Increases in Tight Junction Permeability in Caco-2 Cell Monolayers. J. Nutr. 2010, 140 (9), 1557–1563. https://doi.org/10.3945/jn.109.120469.
(122) Roig-Pérez, S.; Guardiola, F.; Moretó, M.; Ferrer, R. Lipid Peroxidation Induced by DHA Enrichment Modifies Paracellular Permeability in Caco-2 Cells: Protective Role of Taurine. J. Lipid Res. 2004, 45 (8), 1418–1428. https://doi.org/10.1194/jlr.M300513-JLR200.
(123) Blesso, C. Egg Phospholipids and Cardiovascular Health. Nutrients 2015, 7 (4), 2731–2747. https://doi.org/10.3390/nu7042731.
(124) DiMarco, D. M.; Missimer, A.; Murillo, A. G.; Lemos, B. S.; Malysheva, O. V.; Caudill, M. A.; Blesso, C. N.; Fernandez, M. L. Intake of up to 3 Eggs/Day Increases HDL Cholesterol and Plasma Choline While Plasma Trimethylamine-N-Oxide Is Unchanged in a Healthy Population. Lipids 2017, 52 (3), 255–263. https://doi.org/10.1007/s11745-017-4230-9.
(125) Geiker, N. R. W.; Larsen, M. L.; Dyerberg, J.; Stender, S.; Astrup, A. Egg Consumption, Cardiovascular Diseases and Type 2 Diabetes. European Journal Of Clinical Nutrition 2017, 72, 44.
(126) Han, J.; Isoda, H.; Maekawa, T. Analysis of the Mechanism of the Tight-Junctional Permeability Increase by Capsaicin Treatment on the Intestinal Caco-2 Cells. Cytotechnology 2002, 40 (1–3), 93–98. https://doi.org/10.1023/A:1023922306968.
(127) Kozukue, N.; Han, J.-S.; Lee, K.-R.; Friedman, M. Dehydrotomatine and Alpha-Tomatine Content in Tomato Fruits and Vegetative Plant Tissues. J. Agric. Food Chem. 2004, 52 (7), 2079–2083. https://doi.org/10.1021/jf0306845.
(128) Gemede, H. F.; Ratta, N. Antinutritional Factors in Plant Foods: Potential Health Benefits and Adverse Effects. International Journal of Nutrition and Food Sciences 2014, 3 (4), 284. https://doi.org/10.11648/j.ijnfs.20140304.18.
(129) Gee, J. M.; Wortley, G. M.; Johnson, I. T.; Price, K. R.; Rutten, A. A.; Houben, G. F.; Penninks, A. H. Effects of Saponins and Glycoalkaloids on the Permeability and Viability of Mammalian Intestinal Cells and on the Integrity of Tissue Preparations in Vitro. Toxicol In Vitro 1996, 10 (2), 117–128. https://doi.org/10.1016/0887-2333(95)00113-1.
(130) Casas, R.; Sacanella, E.; Estruch, R. The Immune Protective Effect of the Mediterranean Diet against Chronic Low-Grade Inflammatory Diseases. Endocr Metab Immune Disord Drug Targets 2014, 14 (4), 245–254.
(131) Haro, C.; Montes-Borrego, M.; Rangel-Zúñiga, O. A.; Alcalá-Díaz, J. F.; Gómez-Delgado, F.; Pérez-Martínez, P.; Delgado-Lista, J.; Quintana-Navarro, G. M.; Tinahones, F. J.; Landa, B. B.; López-Miranda, J.; Camargo, A.; Pérez-Jiménez, F. Two Healthy Diets Modulate Gut Microbial Community Improving Insulin Sensitivity in a Human Obese Population. J. Clin. Endocrinol. Metab. 2016, 101 (1), 233–242. https://doi.org/10.1210/jc.2015-3351.
(132) Wang, Y.; Hao, Q.; Su, L.; Liu, Y.; Liu, S.; Dong, B. Adherence to the Mediterranean Diet and the Risk of Frailty in Old People: A Systematic Review and Meta-Analysis. J Nutr Health Aging 2018, 22 (5), 613–618. https://doi.org/10.1007/s12603-018-1020-x.
(133) Szarc vel Szic, K.; Declerck, K.; Vidaković, M.; Vanden Berghe, W. From Inflammaging to Healthy Aging by Dietary Lifestyle Choices: Is Epigenetics the Key to Personalized Nutrition? Clin Epigenetics 2015, 7, 33. https://doi.org/10.1186/s13148-015-0068-2.
(134) Martel, J.; Ojcius, D. M.; Chang, C.-J.; Lin, C.-S.; Lu, C.-C.; Ko, Y.-F.; Tseng, S.-F.; Lai, H.-C.; Young, J. D. Anti-Obesogenic and Antidiabetic Effects of Plants and Mushrooms. Nat Rev Endocrinol 2017, 13 (3), 149–160. https://doi.org/10.1038/nrendo.2016.142.
(135) Bekkering, S.; Quintin, J.; Joosten, L. A. B.; van der Meer, J. W. M.; Netea, M. G.; Riksen, N. P. Oxidized Low-Density Lipoprotein Induces Long-Term Proinflammatory Cytokine Production and Foam Cell Formation via Epigenetic Reprogramming of Monocytes. Arterioscler. Thromb. Vasc. Biol. 2014, 34 (8), 1731–1738. https://doi.org/10.1161/ATVBAHA.114.303887.
(136) Schwingshackl, L.; Strasser, B.; Hoffmann, G. Effects of Monounsaturated Fatty Acids on Cardiovascular Risk Factors: A Systematic Review and Meta-Analysis. Ann. Nutr. Metab. 2011, 59 (2–4), 176–186. https://doi.org/10.1159/000334071.
(137) Schwingshackl, L.; Hoffmann, G. Monounsaturated Fatty Acids, Olive Oil and Health Status: A Systematic Review and Meta-Analysis of Cohort Studies. Lipids Health Dis 2014, 13, 154. https://doi.org/10.1186/1476-511X-13-154.
(138) Human Postprandial Nutrient Metabolism and Low-Grade Inflammation: A Narrative Review. – PubMed – NCBI https://www.ncbi.nlm.nih.gov/pubmed/31817857 (accessed Feb 11, 2020).
(139) Levitan, E. B.; Cook, N. R.; Stampfer, M. J.; Ridker, P. M.; Rexrode, K. M.; Buring, J. E.; Manson, J. E.; Liu, S. Dietary Glycemic Index, Dietary Glycemic Load, Blood Lipids, and C-Reactive Protein. Metabolism: clinical and experimental 2008, 57 (3), 437. https://doi.org/10.1016/j.metabol.2007.11.002.
(140) Kern, P. A.; Ranganathan, S.; Li, C.; Wood, L.; Ranganathan, G. Adipose Tissue Tumor Necrosis Factor and Interleukin-6 Expression in Human Obesity and Insulin Resistance. Am. J. Physiol. Endocrinol. Metab. 2001, 280 (5), E745-751. https://doi.org/10.1152/ajpendo.2001.280.5.E745.
(141) Hotamisligil, G. S.; Arner, P.; Caro, J. F.; Atkinson, R. L.; Spiegelman, B. M. Increased Adipose Tissue Expression of Tumor Necrosis Factor-Alpha in Human Obesity and Insulin Resistance. J. Clin. Invest. 1995, 95 (5), 2409–2415. https://doi.org/10.1172/JCI117936.
(142) Buyken, A. E.; Goletzke, J.; Joslowski, G.; Felbick, A.; Cheng, G.; Herder, C.; Brand-Miller, J. C. Association between Carbohydrate Quality and Inflammatory Markers: Systematic Review of Observational and Interventional Studies. American Journal of Clinical Nutrition 99 (4), 813–833.
(143) Schwingshackl, L.; Hoffmann, G. Long-Term Effects of Low Glycemic Index/Load vs. High Glycemic Index/Load Diets on Parameters of Obesity and Obesity-Associated Risks: A Systematic Review and Meta-Analysis. Nutr Metab Cardiovasc Dis 2013, 23 (8), 699–706. https://doi.org/10.1016/j.numecd.2013.04.008.
(144) Sen, T.; Cawthon, C. R.; Ihde, B. T.; Hajnal, A.; DiLorenzo, P. M.; de La Serre, C. B.; Czaja, K. Diet-Driven Microbiota Dysbiosis Is Associated with Vagal Remodeling and Obesity. Physiol. Behav. 2017, 173, 305–317. https://doi.org/10.1016/j.physbeh.2017.02.027.
(145) Brownlee, M. Biochemistry and Molecular Cell Biology of Diabetic Complications. Nature 2001, 414 (6865), 813–820. https://doi.org/10.1038/414813a.
(146) Poulsen, M. W.; Hedegaard, R. V.; Andersen, J. M.; de Courten, B.; Bügel, S.; Nielsen, J.; Skibsted, L. H.; Dragsted, L. O. Advanced Glycation Endproducts in Food and Their Effects on Health. Food Chem. Toxicol. 2013, 60, 10–37. https://doi.org/10.1016/j.fct.2013.06.052.
(147) Gögebakan, O.; Kohl, A.; Osterhoff, M. A.; van Baak, M. A.; Jebb, S. A.; Papadaki, A.; Martinez, J. A.; Handjieva-Darlenska, T.; Hlavaty, P.; Weickert, M. O.; Holst, C.; Saris, W. H. M.; Astrup, A.; Pfeiffer, A. F. H.; DiOGenes. Effects of Weight Loss and Long-Term Weight Maintenance with Diets Varying in Protein and Glycemic Index on Cardiovascular Risk Factors: The Diet, Obesity, and Genes (DiOGenes) Study: A Randomized, Controlled Trial. Circulation 2011, 124 (25), 2829–2838. https://doi.org/10.1161/CIRCULATIONAHA.111.033274.
(148) Holt, S. H.; Miller, J. C.; Petocz, P. An Insulin Index of Foods: The Insulin Demand Generated by 1000-KJ Portions of Common Foods. Am. J. Clin. Nutr. 1997, 66 (5), 1264–1276. https://doi.org/10.1093/ajcn/66.5.1264.
(149) Ostman, E. M.; Liljeberg Elmståhl, H. G.; Björck, I. M. Inconsistency between Glycemic and Insulinemic Responses to Regular and Fermented Milk Products. Am. J. Clin. Nutr. 2001, 74 (1), 96–100. https://doi.org/10.1093/ajcn/74.1.96.
(150) Nilsson, M.; Stenberg, M.; Frid, A. H.; Holst, J. J.; Björck, I. M. E. Glycemia and Insulinemia in Healthy Subjects after Lactose-Equivalent Meals of Milk and Other Food Proteins: The Role of Plasma Amino Acids and Incretins. Am. J. Clin. Nutr. 2004, 80 (5), 1246–1253. https://doi.org/10.1093/ajcn/80.5.1246.
(151) Lancaster, G. I.; Langley, K. G.; Berglund, N. A.; Kammoun, H. L.; Reibe, S.; Estevez, E.; Weir, J.; Mellett, N. A.; Pernes, G.; Conway, J. R. W.; Lee, M. K. S.; Timpson, P.; Murphy, A. J.; Masters, S. L.; Gerondakis, S.; Bartonicek, N.; Kaczorowski, D. C.; Dinger, M. E.; Meikle, P. J.; Bond, P. J.; Febbraio, M. A. Evidence That TLR4 Is Not a Receptor for Saturated Fatty Acids but Mediates Lipid-Induced Inflammation by Reprogramming Macrophage Metabolism. Cell Metab. 2018, 27 (5), 1096-1110.e5. https://doi.org/10.1016/j.cmet.2018.03.014.
(152) Poppitt, S. D.; Keogh, G. F.; Lithander, F. E.; Wang, Y.; Mulvey, T. B.; Chan, Y.-K.; McArdle, B. H.; Cooper, G. J. S. Postprandial Response of Adiponectin, Interleukin-6, Tumor Necrosis Factor-Alpha, and C-Reactive Protein to a High-Fat Dietary Load. Nutrition 2008, 24 (4), 322–329. https://doi.org/10.1016/j.nut.2007.12.012.
(153) Weylandt, K. H.; Chiu, C.-Y.; Gomolka, B.; Waechter, S. F.; Wiedenmann, B. Omega-3 Fatty Acids and Their Lipid Mediators: Towards an Understanding of Resolvin and Protectin Formation. Prostaglandins Other Lipid Mediat. 2012, 97 (3–4), 73–82. https://doi.org/10.1016/j.prostaglandins.2012.01.005.
(154) Serhan, C. N.; Levy, B. D. Resolvins in Inflammation: Emergence of the pro-Resolving Superfamily of Mediators. J. Clin. Invest. 2018, 128 (7), 2657–2669. https://doi.org/10.1172/JCI97943.
(155) Oh, D. Y.; Talukdar, S.; Bae, E. J.; Imamura, T.; Morinaga, H.; Fan, W.; Li, P.; Lu, W. J.; Watkins, S. M.; Olefsky, J. M. GPR120 Is an Omega-3 Fatty Acid Receptor Mediating Potent Anti-Inflammatory and Insulin-Sensitizing Effects. Cell 2010, 142 (5), 687–698. https://doi.org/10.1016/j.cell.2010.07.041.
(156) Cai, C.; Koch, B.; Morikawa, K.; Suda, G.; Sakamoto, N.; Rueschenbaum, S.; Akhras, S.; Dietz, J.; Hildt, E.; Zeuzem, S.; Welsch, C.; Lange, C. M. Macrophage-Derived Extracellular Vesicles Induce Long-Lasting Immunity Against Hepatitis C Virus Which Is Blunted by Polyunsaturated Fatty Acids. Front Immunol 2018, 9, 723. https://doi.org/10.3389/fimmu.2018.00723.
(157) Gutiérrez, S.; Svahn, S. L.; Johansson, M. E. Effects of Omega-3 Fatty Acids on Immune Cells. Int J Mol Sci 2019, 20 (20). https://doi.org/10.3390/ijms20205028.
(158) Bégin, M. E.; Manku, M. S.; Horrobin, D. F. Plasma Fatty Acid Levels in Patients with Acquired Immune Deficiency Syndrome and in Controls. Prostaglandins Leukot. Essent. Fatty Acids 1989, 37 (2), 135–137. https://doi.org/10.1016/0952-3278(89)90110-5.
(159) Cotogni, P.; Trombetta, A.; Muzio, G.; Maggiora, M.; Canuto, R. A. The Omega-3 Fatty Acid Docosahexaenoic Acid Modulates Inflammatory Mediator Release in Human Alveolar Cells Exposed to Bronchoalveolar Lavage Fluid of ARDS Patients. Biomed Res Int 2015, 2015. https://doi.org/10.1155/2015/642520.
(160) Morita, M.; Kuba, K.; Ichikawa, A.; Nakayama, M.; Katahira, J.; Iwamoto, R.; Watanebe, T.; Sakabe, S.; Daidoji, T.; Nakamura, S.; Kadowaki, A.; Ohto, T.; Nakanishi, H.; Taguchi, R.; Nakaya, T.; Murakami, M.; Yoneda, Y.; Arai, H.; Kawaoka, Y.; Penninger, J. M.; Arita, M.; Imai, Y. The Lipid Mediator Protectin D1 Inhibits Influenza Virus Replication and Improves Severe Influenza. Cell 2013, 153 (1), 112–125. https://doi.org/10.1016/j.cell.2013.02.027.
(161) Gz, L.; Ty, L.; Jt, H. Anti-HCV Activities of Selective Polyunsaturated Fatty Acids. Biochem Biophys Res Commun 2004, 318 (1), 275–280. https://doi.org/10.1016/j.bbrc.2004.04.019.
(162) Dushianthan, A.; Cusack, R.; Burgess, V. A.; Grocott, M. P.; Calder, P. C. Immunonutrition for Acute Respiratory Distress Syndrome (ARDS) in Adults. Cochrane Database Syst Rev 2019, 1, CD012041. https://doi.org/10.1002/14651858.CD012041.pub2.
(163) Langlois, P. L.; D’Aragon, F.; Hardy, G.; Manzanares, W. Omega-3 Polyunsaturated Fatty Acids in Critically Ill Patients with Acute Respiratory Distress Syndrome: A Systematic Review and Meta-Analysis. Nutrition 2019, 61, 84–92. https://doi.org/10.1016/j.nut.2018.10.026.
(164) Gerling, C. J.; Mukai, K.; Chabowski, A.; Heigenhauser, G. J. F.; Holloway, G. P.; Spriet, L. L.; Jannas-Vela, S. Incorporation of Omega-3 Fatty Acids Into Human Skeletal Muscle Sarcolemmal and Mitochondrial Membranes Following 12 Weeks of Fish Oil Supplementation. Front Physiol 2019, 10, 348. https://doi.org/10.3389/fphys.2019.00348.
(165) Pot, G. K.; Brouwer, I. A.; Enneman, A.; Rijkers, G. T.; Kampman, E.; Geelen, A. No Effect of Fish Oil Supplementation on Serum Inflammatory Markers and Their Interrelationships: A Randomized Controlled Trial in Healthy, Middle-Aged Individuals. Eur J Clin Nutr 2009, 63 (11), 1353–1359. https://doi.org/10.1038/ejcn.2009.63.
(166) Muldoon, M. F.; Laderian, B.; Kuan, D. C. H.; Sereika, S. M.; Marsland, A. L.; Manuck, S. B. Fish Oil Supplementation Does Not Lower C-Reactive Protein or Interleukin-6 Levels in Healthy Adults. J. Intern. Med. 2016, 279 (1), 98–109. https://doi.org/10.1111/joim.12442.
(167) Corsini, E.; Sokooti, M.; Galli, C. L.; Moretto, A.; Colosio, C. Pesticide Induced Immunotoxicity in Humans: A Comprehensive Review of the Existing Evidence. Toxicology 2013, 307, 123–135. https://doi.org/10.1016/j.tox.2012.10.009.
(168) Mokarizadeh, A.; Faryabi, M. R.; Rezvanfar, M. A.; Abdollahi, M. A Comprehensive Review of Pesticides and the Immune Dysregulation: Mechanisms, Evidence and Consequences. Toxicol. Mech. Methods 2015, 25 (4), 258–278. https://doi.org/10.3109/15376516.2015.1020182.
(169) Banks, C. N.; Lein, P. J. A Review of Experimental Evidence Linking Neurotoxic Organophosphorus Compounds and Inflammation. Neurotoxicology 2012, 33 (3), 575–584. https://doi.org/10.1016/j.neuro.2012.02.002.
(170) Aguilar-Garduño, C.; Lacasaña, M.; Blanco-Muñoz, J.; Rodríguez-Barranco, M.; Hernández, A. F.; Bassol, S.; González-Alzaga, B.; Cebrián, M. E. Changes in Male Hormone Profile after Occupational Organophosphate Exposure. A Longitudinal Study. Toxicology 2013, 307, 55–65. https://doi.org/10.1016/j.tox.2012.11.001.
(171) Furst, A. Can Nutrition Affect Chemical Toxicity? Int. J. Toxicol. 2002, 21 (5), 419–424. https://doi.org/10.1080/10915810290096649.
(172) Sunyer, J.; Garcia-Esteban, R.; Alvarez, M.; Guxens, M.; Goñi, F.; Basterrechea, M.; Vrijheid, M.; Guerra, S.; Antó, J. M. DDE in Mothers’ Blood during Pregnancy and Lower Respiratory Tract Infections in Their Infants. Epidemiology 2010, 21 (5), 729–735. https://doi.org/10.1097/EDE.0b013e3181e5ea96.
(173) Cao, J.; Xu, X.; Hylkema, M. N.; Zeng, E. Y.; Sly, P. D.; Suk, W. A.; Bergman, Å.; Huo, X. Early-Life Exposure to Widespread Environmental Toxicants and Health Risk: A Focus on the Immune and Respiratory Systems. Ann Glob Health 2016, 82 (1), 119–131. https://doi.org/10.1016/j.aogh.2016.01.023.
(174) Baranska, M.; Van Amelsvoort, L.; Birindelli, S.; Fustinoni, S.; Corsini, E.; Liesivuori, J.; Van Loveren, H. Association of Pesticide Exposure, Vaccination Response, and Interleukin-1 Gene Polymorphisms. Hum Exp Toxicol 2008, 27 (9), 709–713. https://doi.org/10.1177/0960327108100002.
(175) Shadnia, S.; Azizi, E.; Hosseini, R.; Khoei, S.; Fouladdel, S.; Pajoumand, A.; Jalali, N.; Abdollahi, M. Evaluation of Oxidative Stress and Genotoxicity in Organophosphorus Insecticide Formulators. Hum Exp Toxicol 2005, 24 (9), 439–445. https://doi.org/10.1191/0960327105ht549oa.
(176) Abdollahi, M.; Mostafalou, S.; Pournourmohammadi, S.; Shadnia, S. Oxidative Stress and Cholinesterase Inhibition in Saliva and Plasma of Rats Following Subchronic Exposure to Malathion. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 2004, 137 (1), 29–34. https://doi.org/10.1016/j.cca.2003.11.002.
(177) Rochester, J. R. Bisphenol A and Human Health: A Review of the Literature. Reprod. Toxicol. 2013, 42, 132–155. https://doi.org/10.1016/j.reprotox.2013.08.008.
(178) Kharrazian, D. The Potential Roles of Bisphenol A (BPA) Pathogenesis in Autoimmunity. Autoimmune Dis 2014, 2014, 743616. https://doi.org/10.1155/2014/743616.
(179) Qiu, W.; Zhan, H.; Hu, J.; Zhang, T.; Xu, H.; Wong, M.; Zheng, C. The Occurrence, Potential Toxicity, and Toxicity Mechanism of Bisphenol S, a Substitute of Bisphenol A: A Critical Review of Recent Progress. Ecotoxicology and Environmental Safety 2019, 173, 192–202. https://doi.org/10.1016/j.ecoenv.2019.01.114.
(180) Cheng, A.; Wan, R.; Yang, J.-L.; Kamimura, N.; Son, T. G.; Ouyang, X.; Luo, Y.; Okun, E.; Mattson, M. P. Involvement of PGC-1α in the Formation and Maintenance of Neuronal Dendritic Spines. Nat Commun 2012, 3, 1250. https://doi.org/10.1038/ncomms2238.
(181) Li, L.; Wang, Z.; Zuo, Z. Chronic Intermittent Fasting Improves Cognitive Functions and Brain Structures in Mice. PLoS One 2013, 8 (6). https://doi.org/10.1371/journal.pone.0066069.
(182) Lv, M.; Zhu, X.; Wang, H.; Wang, F.; Guan, W. Roles of Caloric Restriction, Ketogenic Diet and Intermittent Fasting during Initiation, Progression and Metastasis of Cancer in Animal Models: A Systematic Review and Meta-Analysis. PLoS ONE 2014, 9 (12), e115147. https://doi.org/10.1371/journal.pone.0115147.
(183) Longo, V. D.; Mattson, M. P. Fasting: Molecular Mechanisms and Clinical Applications. Cell Metab. 2014, 19 (2), 181–192. https://doi.org/10.1016/j.cmet.2013.12.008.
(184) Varady, K. A.; Dam, V. T.; Klempel, M. C.; Horne, M.; Cruz, R.; Kroeger, C. M.; Santosa, S. Effects of Weight Loss via High Fat vs. Low Fat Alternate Day Fasting Diets on Free Fatty Acid Profiles. Sci Rep 2015, 5, 7561. https://doi.org/10.1038/srep07561.
(185) Gotthardt, J. D.; Verpeut, J. L.; Yeomans, B. L.; Yang, J. A.; Yasrebi, A.; Roepke, T. A.; Bello, N. T. Intermittent Fasting Promotes Fat Loss With Lean Mass Retention, Increased Hypothalamic Norepinephrine Content, and Increased Neuropeptide Y Gene Expression in Diet-Induced Obese Male Mice. Endocrinology 2016, 157 (2), 679–691. https://doi.org/10.1210/en.2015-1622.
(186) Steven, S.; Hollingsworth, K. G.; Al-Mrabeh, A.; Avery, L.; Aribisala, B.; Caslake, M.; Taylor, R. Very Low-Calorie Diet and 6 Months of Weight Stability in Type 2 Diabetes: Pathophysiological Changes in Responders and Nonresponders. Diabetes Care 2016, 39 (5), 808–815. https://doi.org/10.2337/dc15-1942.
(187) Fann, D. Y.-W.; Ng, G. Y. Q.; Poh, L.; Arumugam, T. V. Positive Effects of Intermittent Fasting in Ischemic Stroke. Experimental Gerontology 2017, 89, 93–102. https://doi.org/10.1016/j.exger.2017.01.014.
(188) Mattson, M. P.; Longo, V. D.; Harvie, M. Impact of Intermittent Fasting on Health and Disease Processes. Ageing Res. Rev. 2017, 39, 46–58. https://doi.org/10.1016/j.arr.2016.10.005.
(189) Trepanowski, J. F.; Kroeger, C. M.; Barnosky, A.; Klempel, M. C.; Bhutani, S.; Hoddy, K. K.; Gabel, K.; Freels, S.; Rigdon, J.; Rood, J.; Ravussin, E.; Varady, K. A. Effect of Alternate-Day Fasting on Weight Loss, Weight Maintenance, and Cardioprotection Among Metabolically Healthy Obese Adults: A Randomized Clinical Trial. JAMA Internal Medicine 2017, 177 (7), 930. https://doi.org/10.1001/jamainternmed.2017.0936.
(190) Francesco, A. D.; Germanio, C. D.; Bernier, M.; Cabo, R. de. A Time to Fast. Science 2018, 362 (6416), 770–775. https://doi.org/10.1126/science.aau2095.
(191) Taylor, R. Calorie Restriction for Long-Term Remission of Type 2 Diabetes. Clin Med (Lond) 2019, 19 (1), 37–42. https://doi.org/10.7861/clinmedicine.19-1-37.
(192) Peterson, C. M. Intermittent Fasting Induces Weight Loss, but the Effects on Cardiometabolic Health Are Modulated by Energy Balance. Obesity 2019, 27 (1), 11–11. https://doi.org/10.1002/oby.22384.
(193) Malinowski, B.; Zalewska, K.; Węsierska, A.; Sokołowska, M. M.; Socha, M.; Liczner, G.; Pawlak-Osińska, K.; Wiciński, M. Intermittent Fasting in Cardiovascular Disorders-An Overview. Nutrients 2019, 11 (3). https://doi.org/10.3390/nu11030673.
(194) Choi, I. Y.; Piccio, L.; Childress, P.; Bollman, B.; Ghosh, A.; Brandhorst, S.; Suarez, J.; Michalsen, A.; Cross, A. H.; Morgan, T. E.; Wei, M.; Paul, F.; Bock, M.; Longo, V. D. Diet Mimicking Fasting Promotes Regeneration and Reduces Autoimmunity and Multiple Sclerosis Symptoms. Cell Rep 2016, 15 (10), 2136–2146. https://doi.org/10.1016/j.celrep.2016.05.009.
(195) Cignarella, F.; Cantoni, C.; Ghezzi, L.; Salter, A.; Dorsett, Y.; Chen, L.; Fontana, L.; Weinstock, G. M.; Cross, A. H.; Zhou, Y.; Piccio, L. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metab 2018, 27 (6), 1222-1235.e6. https://doi.org/10.1016/j.cmet.2018.05.006.
(196) Bagherniya, M.; Butler, A. E.; Barreto, G. E.; Sahebkar, A. The Effect of Fasting or Calorie Restriction on Autophagy Induction: A Review of the Literature. Ageing Research Reviews 2018, 47, 183–197. https://doi.org/10.1016/j.arr.2018.08.004.
(197) MacDonald, L.; Radler, M.; Paolini, A. G.; Kent, S. Calorie Restriction Attenuates LPS-Induced Sickness Behavior and Shifts Hypothalamic Signaling Pathways to an Anti-Inflammatory Bias. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2011, 301 (1), R172-184. https://doi.org/10.1152/ajpregu.00057.2011.
(198) Zenz, G.; Jačan, A.; Reichmann, F.; Farzi, A.; Holzer, P. Intermittent Fasting Exacerbates the Acute Immune and Behavioral Sickness Response to the Viral Mimic Poly(I:C) in Mice. Front Neurosci 2019, 13. https://doi.org/10.3389/fnins.2019.00359.
(199) Goldberg, E. L.; Molony, R. D.; Kudo, E.; Sidorov, S.; Kong, Y.; Dixit, V. D.; Iwasaki, A. Ketogenic Diet Activates Protective Γδ T Cell Responses against Influenza Virus Infection. Sci Immunol 2019, 4 (41). https://doi.org/10.1126/sciimmunol.aav2026.
(200) Goldberg, E. L.; Shchukina, I.; Asher, J. L.; Sidorov, S.; Artyomov, M. N.; Dixit, V. D. Ketogenesis Activates Metabolically Protective Γδ T Cells in Visceral Adipose Tissue. Nature Metabolism 2020, 2 (1), 50–61. https://doi.org/10.1038/s42255-019-0160-6.
(201) Youm, Y.-H.; Nguyen, K. Y.; Grant, R. W.; Goldberg, E. L.; Bodogai, M.; Kim, D.; D’Agostino, D.; Planavsky, N.; Lupfer, C.; Kanneganti, T. D.; Kang, S.; Horvath, T. L.; Fahmy, T. M.; Crawford, P. A.; Biragyn, A.; Alnemri, E.; Dixit, V. D. Ketone Body β-Hydroxybutyrate Blocks the NLRP3 Inflammasome-Mediated Inflammatory Disease. Nat Med 2015, 21 (3), 263–269. https://doi.org/10.1038/nm.3804.
(202) Pasala, S.; Barr, T.; Messaoudi, I. Impact of Alcohol Abuse on the Adaptive Immune System. Alcohol Res 2015, 37 (2), 185–197.
(203) Liu, Y. K. Leukopenia in Alcoholics. Am. J. Med. 1973, 54 (5), 605–610. https://doi.org/10.1016/0002-9343(73)90118-6.
(204) Cook, R. T.; Ballas, Z. K.; Waldschmidt, T. J.; Vandersteen, D.; LaBrecque, D. R.; Cook, B. L. Modulation of T-Cell Adhesion Markers, and the CD45R and CD57 Antigens in Human Alcoholics. Alcohol. Clin. Exp. Res. 1995, 19 (3), 555–563. https://doi.org/10.1111/j.1530-0277.1995.tb01548.x.
(205) Song, K.; Coleman, R. A.; Alber, C.; Ballas, Z. K.; Waldschmidt, T. J.; Mortari, F.; LaBrecque, D. R.; Cook, R. T. TH1 Cytokine Response of CD57+ T-Cell Subsets in Healthy Controls and Patients with Alcoholic Liver Disease. Alcohol 2001, 24 (3), 155–167. https://doi.org/10.1016/s0741-8329(01)00146-x.
(206) Boule, L. A.; Kovacs, E. J. Alcohol, Aging, and Innate Immunity. J Leukoc Biol 2017, 102 (1), 41–55. https://doi.org/10.1189/jlb.4RU1016-450R.
(207) Tønnesen, H.; Andersen, J. R.; Pedersen, A. E.; Kaiser, A. H. Lymphopenia in Heavy Drinkers–Reversibility and Relation to the Duration of Drinking Episodes. Ann. Med. 1990, 22 (4), 229–231. https://doi.org/10.3109/07853899009148931.
(208) Romeo, J.; Wärnberg, J.; Díaz, L. E.; González-Gross, M.; Marcos, A. Effects of Moderate Beer Consumption on First-Line Immunity of Healthy Adults. J. Physiol. Biochem. 2007, 63 (2), 153–159. https://doi.org/10.1007/bf03168226.
(209) Cohen, S.; Tyrrell, D. A.; Russell, M. A.; Jarvis, M. J.; Smith, A. P. Smoking, Alcohol Consumption, and Susceptibility to the Common Cold. Am J Public Health 1993, 83 (9), 1277–1283. https://doi.org/10.2105/ajph.83.9.1277.
(210) Takkouche, B.; Regueira-Méndez, C.; García-Closas, R.; Figueiras, A.; Gestal-Otero, J. J.; Hernán, M. A. Intake of Wine, Beer, and Spirits and the Risk of Clinical Common Cold. Am. J. Epidemiol. 2002, 155 (9), 853–858. https://doi.org/10.1093/aje/155.9.853.
(211) Joosten, M. M.; van Erk, M. J.; Pellis, L.; Witkamp, R. F.; Hendriks, H. F. J. Moderate Alcohol Consumption Alters Both Leucocyte Gene Expression Profiles and Circulating Proteins Related to Immune Response and Lipid Metabolism in Men. Br. J. Nutr. 2012, 108 (4), 620–627. https://doi.org/10.1017/S0007114511005988.
(212) Curtis, B. J.; Zahs, A.; Kovacs, E. J. Epigenetic Targets for Reversing Immune Defects Caused by Alcohol Exposure. Alcohol Res 2013, 35 (1), 97–113.
(213) Smith, C.; Lombard, K. A.; Peffley, E. B.; Liu, W. Genetic Analysis of Quercetin in Onion (Allium cepa L.) “Lady Raider” /paper/Genetic-Analysis-of-Quercetin-in-Onion-(Allium-cepa-Smith-Lombard/03daea262de35332b5cb70b1114ce490e5b7e905 (accessed Mar 21, 2020).
(214) Verlinden, S.; McDonald, L.; Kotcon, J.; Childs, S. Long-Term Effect of Manure Application in a Certified Organic Production System on Soil Physical and Chemical Parameters and Vegetable Yields. HortTechnology 2017, 27 (2), 171–176. https://doi.org/10.21273/HORTTECH03348-16.
(215) Petrus, K.; Schwartz, H.; Sontag, G. Analysis of Flavonoids in Honey by HPLC Coupled with Coulometric Electrode Array Detection and Electrospray Ionization Mass Spectrometry. Anal Bioanal Chem 2011, 400 (8), 2555–2563. https://doi.org/10.1007/s00216-010-4614-7.
(216) Sampson, L.; Rimm, E.; Hollman, P. C. H.; de Vries, J. H. M.; Katan, M. B. Flavonol and Flavone Intakes in US Health Professionals. J Am Diet Assoc 2002, 102 (10), 1414–1420. https://doi.org/10.1016/s0002-8223(02)90314-7.
(217) Zamora-Ros, R.; Andres-Lacueva, C.; Lamuela-Raventós, R. M.; Berenguer, T.; Jakszyn, P.; Barricarte, A.; Ardanaz, E.; Amiano, P.; Dorronsoro, M.; Larrañaga, N.; Martínez, C.; Sánchez, M. J.; Navarro, C.; Chirlaque, M. D.; Tormo, M. J.; Quirós, J. R.; González, C. A. Estimation of Dietary Sources and Flavonoid Intake in a Spanish Adult Population (EPIC-Spain). J Am Diet Assoc 2010, 110 (3), 390–398. https://doi.org/10.1016/j.jada.2009.11.024.
(218) Häkkinen, S. H.; Kärenlampi, S. O.; Heinonen, I. M.; Mykkänen, H. M.; Törrönen, A. R. Content of the Flavonols Quercetin, Myricetin, and Kaempferol in 25 Edible Berries. J. Agric. Food Chem. 1999, 47 (6), 2274–2279. https://doi.org/10.1021/jf9811065.
(219) Williamson, G.; Manach, C. Bioavailability and Bioefficacy of Polyphenols in Humans. II. Review of 93 Intervention Studies. Am. J. Clin. Nutr. 2005, 81 (1 Suppl), 243S-255S. https://doi.org/10.1093/ajcn/81.1.243S.
(220) Wiczkowski, W.; Romaszko, J.; Bucinski, A.; Szawara-Nowak, D.; Honke, J.; Zielinski, H.; Piskula, M. K. Quercetin from Shallots (Allium Cepa L. Var. Aggregatum) Is More Bioavailable than Its Glucosides. J. Nutr. 2008, 138 (5), 885–888. https://doi.org/10.1093/jn/138.5.885.
(221) Yahfoufi, N.; Alsadi, N.; Jambi, M.; Matar, C. The Immunomodulatory and Anti-Inflammatory Role of Polyphenols. Nutrients 2018, 10 (11). https://doi.org/10.3390/nu10111618.
(222) Mamani-Matsuda, M.; Kauss, T.; Al-Kharrat, A.; Rambert, J.; Fawaz, F.; Thiolat, D.; Moynet, D.; Coves, S.; Malvy, D.; Mossalayi, M. D. Therapeutic and Preventive Properties of Quercetin in Experimental Arthritis Correlate with Decreased Macrophage Inflammatory Mediators. Biochem. Pharmacol. 2006, 72 (10), 1304–1310. https://doi.org/10.1016/j.bcp.2006.08.001.
(223) Kobori, M.; Takahashi, Y.; Sakurai, M.; Akimoto, Y.; Tsushida, T.; Oike, H.; Ippoushi, K. Quercetin Suppresses Immune Cell Accumulation and Improves Mitochondrial Gene Expression in Adipose Tissue of Diet-Induced Obese Mice. Mol Nutr Food Res 2016, 60 (2), 300–312. https://doi.org/10.1002/mnfr.201500595.
(224) Li, Y.; Yao, J.; Han, C.; Yang, J.; Chaudhry, M. T.; Wang, S.; Liu, H.; Yin, Y. Quercetin, Inflammation and Immunity. Nutrients 2016, 8 (3), 167. https://doi.org/10.3390/nu8030167.
(225) Chiow, K. H.; Phoon, M. C.; Putti, T.; Tan, B. K. H.; Chow, V. T. Evaluation of Antiviral Activities of Houttuynia Cordata Thunb. Extract, Quercetin, Quercetrin and Cinanserin on Murine Coronavirus and Dengue Virus Infection. Asian Pac J Trop Med 2016, 9 (1), 1–7. https://doi.org/10.1016/j.apjtm.2015.12.002.
(226) Jo, S.; Kim, H.; Kim, S.; Shin, D. H.; Kim, M.-S. Characteristics of Flavonoids as Potent MERS-CoV 3C-like Protease Inhibitors. Chem Biol Drug Des 2019, 94 (6), 2023–2030. https://doi.org/10.1111/cbdd.13604.
(227) Uchide, N.; Toyoda, H. Antioxidant Therapy as a Potential Approach to Severe Influenza-Associated Complications. Molecules 2011, 16 (3), 2032–2052. https://doi.org/10.3390/molecules23100000.
(228) Wu, W.; Li, R.; Li, X.; He, J.; Jiang, S.; Liu, S.; Yang, J. Quercetin as an Antiviral Agent Inhibits Influenza A Virus (IAV) Entry. Viruses 2015, 8 (1). https://doi.org/10.3390/v8010006.
(229) Farazuddin, M.; Mishra, R.; Jing, Y.; Srivastava, V.; Comstock, A. T.; Sajjan, U. S. Quercetin Prevents Rhinovirus-Induced Progression of Lung Disease in Mice with COPD Phenotype. PLoS ONE 2018, 13 (7), e0199612. https://doi.org/10.1371/journal.pone.0199612.
(230) Jo, S.; Kim, S.; Shin, D. H.; Kim, M.-S. Inhibition of SARS-CoV 3CL Protease by Flavonoids. J Enzyme Inhib Med Chem 2020, 35 (1), 145–151. https://doi.org/10.1080/14756366.2019.1690480.
(231) Heinz, S. A.; Henson, D. A.; Austin, M. D.; Jin, F.; Nieman, D. C. Quercetin Supplementation and Upper Respiratory Tract Infection: A Randomized Community Clinical Trial. Pharmacol. Res. 2010, 62 (3), 237–242. https://doi.org/10.1016/j.phrs.2010.05.001.
(232) Heinz, S. A.; Henson, D. A.; Nieman, D. C.; Austin, M. D.; Jin, F. A 12-Week Supplementation with Quercetin Does Not Affect Natural Killer Cell Activity, Granulocyte Oxidative Burst Activity or Granulocyte Phagocytosis in Female Human Subjects. Br. J. Nutr. 2010, 104 (6), 849–857. https://doi.org/10.1017/S000711451000156X.
(233) Nieman, D. C.; Henson, D. A.; Gross, S. J.; Jenkins, D. P.; Davis, J. M.; Murphy, E. A.; Carmichael, M. D.; Dumke, C. L.; Utter, A. C.; McAnulty, S. R.; McAnulty, L. S.; Mayer, E. P. Quercetin Reduces Illness but Not Immune Perturbations after Intensive Exercise. Med Sci Sports Exerc 2007, 39 (9), 1561–1569. https://doi.org/10.1249/mss.0b013e318076b566.
(234) Henson, D.; Nieman, D.; Davis, J. M.; Dumke, C.; Gross, S.; Murphy, A.; Carmichael, M.; Jenkins, D. P.; Quindry, J.; McAnulty, S.; McAnulty, L.; Utter, A.; Mayer, E. Post-160-Km Race Illness Rates and Decreases in Granulocyte Respiratory Burst and Salivary IgA Output Are Not Countered by Quercetin Ingestion. Int J Sports Med 2008, 29 (10), 856–863. https://doi.org/10.1055/s-2007-989424.
(235) Nieman, D. C.; Henson, D. A.; Maxwell, K. R.; Williams, A. S.; McAnulty, S. R.; Jin, F.; Shanely, R. A.; Lines, T. C. Effects of Quercetin and EGCG on Mitochondrial Biogenesis and Immunity. Med Sci Sports Exerc 2009, 41 (7), 1467–1475. https://doi.org/10.1249/MSS.0b013e318199491f.
(236) Song, J.; Kwon, O.; Chen, S.; Daruwala, R.; Eck, P.; Park, J. B.; Levine, M. Flavonoid Inhibition of Sodium-Dependent Vitamin C Transporter 1 (SVCT1) and Glucose Transporter Isoform 2 (GLUT2), Intestinal Transporters for Vitamin C and Glucose. J. Biol. Chem. 2002, 277 (18), 15252–15260. https://doi.org/10.1074/jbc.M110496200.
(237) Kwon, O.; Eck, P.; Chen, S.; Corpe, C. P.; Lee, J.-H.; Kruhlak, M.; Levine, M. Inhibition of the Intestinal Glucose Transporter GLUT2 by Flavonoids. FASEB J. 2007, 21 (2), 366–377. https://doi.org/10.1096/fj.06-6620com.
(238) Amaral, F. A.; Costa, V. V.; Tavares, L. D.; Sachs, D.; Coelho, F. M.; Fagundes, C. T.; Soriani, F. M.; Silveira, T. N.; Cunha, L. D.; Zamboni, D. S.; Quesniaux, V.; Peres, R. S.; Cunha, T. M.; Cunha, F. Q.; Ryffel, B.; Souza, D. G.; Teixeira, M. M. NLRP3 Inflammasome-Mediated Neutrophil Recruitment and Hypernociception Depend on Leukotriene B(4) in a Murine Model of Gout. Arthritis Rheum. 2012, 64 (2), 474–484. https://doi.org/10.1002/art.33355.
(239) Jhang, J.-J.; Lu, C.-C.; Ho, C.-Y.; Cheng, Y.-T.; Yen, G.-C. Protective Effects of Catechin against Monosodium Urate-Induced Inflammation through the Modulation of NLRP3 Inflammasome Activation. J. Agric. Food Chem. 2015, 63 (33), 7343–7352. https://doi.org/10.1021/acs.jafc.5b02605.
(240) Lim, H.; Min, D. S.; Park, H.; Kim, H. P. Flavonoids Interfere with NLRP3 Inflammasome Activation. Toxicol. Appl. Pharmacol. 2018, 355, 93–102. https://doi.org/10.1016/j.taap.2018.06.022.
(241) Chu, S.-L.; Fu, H.; Yang, J.-X.; Liu, G.-X.; Dou, P.; Zhang, L.; Tu, P.-F.; Wang, X.-M. A Randomized Double-Blind Placebo-Controlled Study of Pu’er Tea Extract on the Regulation of Metabolic Syndrome. Chin J Integr Med 2011, 17 (7), 492–498. https://doi.org/10.1007/s11655-011-0781-4.
(242) Kesic, M. J.; Simmons, S. O.; Bauer, R.; Jaspers, I. Nrf2 Expression Modifies Influenza A Entry and Replication in Nasal Epithelial Cells. Free Radic. Biol. Med. 2011, 51 (2), 444–453. https://doi.org/10.1016/j.freeradbiomed.2011.04.027.
(243) Hsu, S. Compounds Derived from Epigallocatechin-3-Gallate (EGCG) as a Novel Approach to the Prevention of Viral Infections. Inflamm Allergy Drug Targets 2015, 14 (1), 13–18. https://doi.org/10.2174/1871528114666151022150122.
(244) Xu, J.; Xu, Z.; Zheng, W. A Review of the Antiviral Role of Green Tea Catechins. Molecules 2017, 22 (8). https://doi.org/10.3390/molecules22081337.
(245) Ge, M.; Xiao, Y.; Chen, H.; Luo, F.; Du, G.; Zeng, F. Multiple Antiviral Approaches of (-)-Epigallocatechin-3-Gallate (EGCG) against Porcine Reproductive and Respiratory Syndrome Virus Infection in Vitro. Antiviral Res. 2018, 158, 52–62. https://doi.org/10.1016/j.antiviral.2018.07.012.
(246) Furushima, D.; Ide, K.; Yamada, H. Effect of Tea Catechins on Influenza Infection and the Common Cold with a Focus on Epidemiological/Clinical Studies. Molecules 2018, 23 (7). https://doi.org/10.3390/molecules23071795.
(247) Wills, E. D. Enzyme Inhibition by Allicin, the Active Principle of Garlic. Biochem J 1956, 63 (3), 514–520.
(248) Kuttan, G. Immunomodulatory Effect of Some Naturally Occuring Sulphur-Containing Compounds. J Ethnopharmacol 2000, 72 (1–2), 93–99.
(249) Nantz, M. P.; Rowe, C. A.; Muller, C. E.; Creasy, R. A.; Stanilka, J. M.; Percival, S. S. Supplementation with Aged Garlic Extract Improves Both NK and Γδ-T Cell Function and Reduces the Severity of Cold and Flu Symptoms: A Randomized, Double-Blind, Placebo-Controlled Nutrition Intervention. Clin Nutr 2012, 31 (3), 337–344. https://doi.org/10.1016/j.clnu.2011.11.019.
(250) Josling, P. Preventing the Common Cold with a Garlic Supplement: A Double-Blind, Placebo-Controlled Survey. Adv Ther 2001, 18 (4), 189–193. https://doi.org/10.1007/bf02850113.
(251) Goncagul, G.; Ayaz, E. Antimicrobial Effect of Garlic (Allium Sativum). Recent Pat Antiinfect Drug Discov 2010, 5 (1), 91–93. https://doi.org/10.2174/157489110790112536.
(252) Gökalp, F. The Inhibition Effect of Garlic-Derived Compounds on Human Immunodeficiency Virus Type 1 and Saquinavir. J. Biochem. Mol. Toxicol. 2018, 32 (11), e22215. https://doi.org/10.1002/jbt.22215.
(253) Lissiman, E.; Bhasale, A. L.; Cohen, M. Garlic for the Common Cold. Cochrane Database Syst Rev 2014, No. 11, CD006206. https://doi.org/10.1002/14651858.CD006206.pub4.
(254) Lissiman, E.; Bhasale, A. L.; Cohen, M. Garlic for the Common Cold. Cochrane Database Syst Rev 2012, No. 3, CD006206. https://doi.org/10.1002/14651858.CD006206.pub3.
(255) Santhosha, S. G.; Jamuna, P.; Prabhavathi, S. N. Bioactive Components of Garlic and Their Physiological Role in Health Maintenance: A Review. 2013.
(256) Ademiluyi, A. O.; Oboh, G.; Owoloye, T. R.; Agbebi, O. J. Modulatory Effects of Dietary Inclusion of Garlic (Allium Sativum) on Gentamycin-Induced Hepatotoxicity and Oxidative Stress in Rats. Asian Pac J Trop Biomed 2013, 3 (6), 470–475. https://doi.org/10.1016/S2221-1691(13)60098-2.
(257) Simone-Finstrom, M.; Spivak, M. Propolis and Bee Health: The Natural History and Significance of Resin Use by Honey Bees. Apidologie 2010, 41 (3), 295–311. https://doi.org/10.1051/apido/2010016.
(258) Simone-Finstrom, M.; Borba, R. S.; Wilson, M.; Spivak, M. Propolis Counteracts Some Threats to Honey Bee Health. Insects 2017, 8 (2). https://doi.org/10.3390/insects8020046.
(259) Silva-Carvalho, R.; Baltazar, F.; Almeida-Aguiar, C. Propolis: A Complex Natural Product with a Plethora of Biological Activities That Can Be Explored for Drug Development. Evid Based Complement Alternat Med 2015, 2015, 206439. https://doi.org/10.1155/2015/206439.
(260) Przybyłek, I.; Karpiński, T. M. Antibacterial Properties of Propolis. Molecules 2019, 24 (11). https://doi.org/10.3390/molecules24112047.
(261) Jafari, H. S.; Sáez-Llorens, X.; Severien, C.; Parras, F.; Friedland, I.; Rinderknecht, S.; Ehrett, S.; Olsen, K. D.; Abramowsky, C.; McCracken, G. H. Effects of Antifungal Therapy on Inflammation, Sterilization, and Histology in Experimental Candida Albicans Meningitis. Antimicrob. Agents Chemother. 1994, 38 (1), 83–89. https://doi.org/10.1128/aac.38.1.83.
(262) Marcucci, M. C. Propolis: Chemical Composition, Biological Properties and Therapeutic Activity. Apidologie 1995, 26 (2), 83–99. https://doi.org/10.1051/apido:19950202.
(263) Huleihel, M.; Isanu, V. Anti-Herpes Simplex Virus Effect of an Aqueous Extract of Propolis. Isr. Med. Assoc. J. 2002, 4 (11 Suppl), 923–927.
(264) Gekker, G.; Hu, S.; Spivak, M.; Lokensgard, J. R.; Peterson, P. K. Anti-HIV-1 Activity of Propolis in CD4(+) Lymphocyte and Microglial Cell Cultures. J Ethnopharmacol 2005, 102 (2), 158–163. https://doi.org/10.1016/j.jep.2005.05.045.
(265) Viuda-Martos, M.; Ruiz-Navajas, Y.; Fernández-López, J.; Pérez-Alvarez, J. A. Functional Properties of Honey, Propolis, and Royal Jelly. J. Food Sci. 2008, 73 (9), R117-124. https://doi.org/10.1111/j.1750-3841.2008.00966.x.
(266) Yildirim, A.; Duran, G. G.; Duran, N.; Jenedi, K.; Bolgul, B. S.; Miraloglu, M.; Muz, M. Antiviral Activity of Hatay Propolis Against Replication of Herpes Simplex Virus Type 1 and Type 2. Med. Sci. Monit. 2016, 22, 422–430. https://doi.org/10.12659/msm.897282.
(267) Sforcin, J. M. Biological Properties and Therapeutic Applications of Propolis. Phytother Res 2016, 30 (6), 894–905. https://doi.org/10.1002/ptr.5605.
(268) Debiaggi, M.; Tateo, F.; Pagani, L.; Luini, M.; Romero, E. Effects of Propolis Flavonoids on Virus Infectivity and Replication. Microbiologica 1990, 13 (3), 207–213.
(269) Leibovitz, B.; Siegel, B. V. Ascorbic Acid and the Immune Response. Adv. Exp. Med. Biol. 1981, 135, 1–25. https://doi.org/10.1007/978-1-4615-9200-6_1.
(270) Anderson, R.; Smit, M. J.; Joone, G. K.; Van Staden, A. M. Vitamin C and Cellular Immune Functions. Protection against Hypochlorous Acid-Mediated Inactivation of Glyceraldehyde-3-Phosphate Dehydrogenase and ATP Generation in Human Leukocytes as a Possible Mechanism of Ascorbate-Mediated Immunostimulation. Ann. N. Y. Acad. Sci. 1990, 587, 34–48. https://doi.org/10.1111/j.1749-6632.1990.tb00131.x.
(271) Siegel, B. V. Enhancement of Interferon Production by Poly(RI)-Poly(RC) in Mouse Cell Cultures by Ascorbic Acid. Nature 1975, 254 (5500), 531–532. https://doi.org/10.1038/254531a0.
(272) Manzella, J. P.; Roberts, N. J. Human Macrophage and Lymphocyte Responses to Mitogen Stimulation after Exposure to Influenza Virus, Ascorbic Acid, and Hyperthermia. J. Immunol. 1979, 123 (5), 1940–1944.
(273) Jeong, Y.-J.; Kim, J.-H.; Hong, J.-M.; Kang, J. S.; Kim, H.-R.; Lee, W. J.; Hwang, Y. Vitamin C Treatment of Mouse Bone Marrow-Derived Dendritic Cells Enhanced CD8(+) Memory T Cell Production Capacity of These Cells in Vivo. Immunobiology 2014, 219 (7), 554–564. https://doi.org/10.1016/j.imbio.2014.03.006.
(274) White, L. A.; Freeman, C. Y.; Forrester, B. D.; Chappell, W. A. In Vitro Effect of Ascorbic Acid on Infectivity of Herpesviruses and Paramyxoviruses. J. Clin. Microbiol. 1986, 24 (4), 527–531.
(275) Oudemans-van Straaten, H. M.; Spoelstra-de Man, A. M.; de Waard, M. C. Vitamin C Revisited. Crit Care 2014, 18 (4), 460. https://doi.org/10.1186/s13054-014-0460-x.
(276) Klenner, F. R. The Treatment of Poliomyelitis and Other Virus Diseases with Vitamin C. South Med Surg 1949, 111 (7), 209–214.
(277) Pauling, L. Ascorbic Acid and the Common Cold. Am. J. Clin. Nutr. 1971, 24 (11), 1294–1299. https://doi.org/10.1093/ajcn/24.11.1294.
(278) Larsen, R.; Gozzelino, R.; Jeney, V.; Tokaji, L.; Bozza, F. A.; Japiassú, A. M.; Bonaparte, D.; Cavalcante, M. M.; Chora, A.; Ferreira, A.; Marguti, I.; Cardoso, S.; Sepúlveda, N.; Smith, A.; Soares, M. P. A Central Role for Free Heme in the Pathogenesis of Severe Sepsis. Sci Transl Med 2010, 2 (51), 51ra71. https://doi.org/10.1126/scitranslmed.3001118.
(279) Seo, M. Y.; Lee, S. M. Protective Effect of Low Dose of Ascorbic Acid on Hepatobiliary Function in Hepatic Ischemia/Reperfusion in Rats. J. Hepatol. 2002, 36 (1), 72–77. https://doi.org/10.1016/s0168-8278(01)00236-7.
(280) Kuck, J. L.; Bastarache, J. A.; Shaver, C. M.; Fessel, J. P.; Dikalov, S. I.; May, J. M.; Ware, L. B. Ascorbic Acid Attenuates Endothelial Permeability Triggered by Cell-Free Hemoglobin. Biochem. Biophys. Res. Commun. 2018, 495 (1), 433–437. https://doi.org/10.1016/j.bbrc.2017.11.058.
(281) Mühlhöfer, A.; Mrosek, S.; Schlegel, B.; Trommer, W.; Rozario, F.; Böhles, H.; Schremmer, D.; Zoller, W. G.; Biesalski, H. K. High-Dose Intravenous Vitamin C Is Not Associated with an Increase of pro-Oxidative Biomarkers. Eur J Clin Nutr 2004, 58 (8), 1151–1158. https://doi.org/10.1038/sj.ejcn.1601943.
(282) Chen, Q.; Espey, M. G.; Krishna, M. C.; Mitchell, J. B.; Corpe, C. P.; Buettner, G. R.; Shacter, E.; Levine, M. Pharmacologic Ascorbic Acid Concentrations Selectively Kill Cancer Cells: Action as a pro-Drug to Deliver Hydrogen Peroxide to Tissues. Proc. Natl. Acad. Sci. U.S.A. 2005, 102 (38), 13604–13609. https://doi.org/10.1073/pnas.0506390102.
(283) Hu, X.; Yuan, L.; Wang, H.; Li, C.; Cai, J.; Hu, Y.; Ma, C. Efficacy and Safety of Vitamin C for Atrial Fibrillation after Cardiac Surgery: A Meta-Analysis with Trial Sequential Analysis of Randomized Controlled Trials. Int J Surg 2017, 37, 58–64. https://doi.org/10.1016/j.ijsu.2016.12.009.
(284) Marik, P. E. Hydrocortisone, Ascorbic Acid and Thiamine (HAT Therapy) for the Treatment of Sepsis. Focus on Ascorbic Acid. Nutrients 2018, 10 (11). https://doi.org/10.3390/nu10111762.
(285) Carr, A.; Frei, B. Does Vitamin C Act as a Pro-Oxidant under Physiological Conditions? FASEB J. 1999, 13 (9), 1007–1024. https://doi.org/10.1096/fasebj.13.9.1007.
(286) Hemilä, H.; Douglas, R. M. Vitamin C and Acute Respiratory Infections. Int. J. Tuberc. Lung Dis. 1999, 3 (9), 756–761.
(287) Field, C. J.; Johnson, I. R.; Schley, P. D. Nutrients and Their Role in Host Resistance to Infection. J. Leukoc. Biol. 2002, 71 (1), 16–32.
(288) Hemilä, H.; Chalker, E. Vitamin C for Preventing and Treating the Common Cold. Cochrane Database Syst Rev 2013, No. 1, CD000980. https://doi.org/10.1002/14651858.CD000980.pub4.
(289) Ran, L.; Zhao, W.; Wang, J.; Wang, H.; Zhao, Y.; Tseng, Y.; Bu, H. Extra Dose of Vitamin C Based on a Daily Supplementation Shortens the Common Cold: A Meta-Analysis of 9 Randomized Controlled Trials. Biomed Res Int 2018, 2018, 1837634. https://doi.org/10.1155/2018/1837634.
(290) Douglas, R. M.; Hemilä, H.; Chalker, E.; Treacy, B. Vitamin C for Preventing and Treating the Common Cold. Cochrane Database Syst Rev 2007, No. 3, CD000980. https://doi.org/10.1002/14651858.CD000980.pub3.
(291) Hemilä, H. Vitamin C Intake and Susceptibility to Pneumonia. Pediatr. Infect. Dis. J. 1997, 16 (9), 836–837. https://doi.org/10.1097/00006454-199709000-00003.
(292) Atherton, J. G.; Kratzing, C. C.; Fisher, A. The Effect of Ascorbic Acid on Infection Chick-Embryo Ciliated Tracheal Organ Cultures by Coronavirus. Arch. Virol. 1978, 56 (3), 195–199. https://doi.org/10.1007/bf01317848.
(293) Hemilä, H. Vitamin C and SARS Coronavirus. J. Antimicrob. Chemother. 2003, 52 (6), 1049–1050. https://doi.org/10.1093/jac/dkh002.
(294) Cai, Y.; Li, Y.-F.; Tang, L.-P.; Tsoi, B.; Chen, M.; Chen, H.; Chen, X.-M.; Tan, R.-R.; Kurihara, H.; He, R.-R. A New Mechanism of Vitamin C Effects on A/FM/1/47(H1N1) Virus-Induced Pneumonia in Restraint-Stressed Mice. Biomed Res Int 2015, 2015, 675149. https://doi.org/10.1155/2015/675149.
(295) Chen, J.-Y.; Chang, C.-Y.; Feng, P.-H.; Chu, C.-C.; So, E. C.; Hu, M.-L. Plasma Vitamin C Is Lower in Postherpetic Neuralgia Patients and Administration of Vitamin C Reduces Spontaneous Pain but Not Brush-Evoked Pain. Clin J Pain 2009, 25 (7), 562–569. https://doi.org/10.1097/AJP.0b013e318193cf32.
(296) Kim, G. N.; Yoo, W. S.; Park, M. H.; Chung, J. K.; Han, Y. S.; Chung, I. Y.; Seo, S. W.; Yoo, J. M.; Kim, S. J. Clinical Features of Herpes Simplex Keratitis in a Korean Tertiary Referral Center: Efficacy of Oral Antiviral and Ascorbic Acid on Recurrence. Korean J Ophthalmol 2018, 32 (5), 353–360. https://doi.org/10.3341/kjo.2017.0131.
(297) Colunga Biancatelli, R. M. L.; Berrill, M.; Marik, P. E. The Antiviral Properties of Vitamin C. Expert Rev Anti Infect Ther 2020, 18 (2), 99–101. https://doi.org/10.1080/14787210.2020.1706483.
(298) Marik, P. E. Vitamin C for the Treatment of Sepsis: The Scientific Rationale. Pharmacol. Ther. 2018, 189, 63–70. https://doi.org/10.1016/j.pharmthera.2018.04.007.
(299) Douglas, R. M.; Chalker, E. B.; Treacy, B. Vitamin C for Preventing and Treating the Common Cold. Cochrane Database Syst Rev 2000, No. 2, CD000980. https://doi.org/10.1002/14651858.CD000980.
(300) Weber, P.; Bendich, A.; Schalch, W. Vitamin C and Human Health–a Review of Recent Data Relevant to Human Requirements. Int J Vitam Nutr Res 1996, 66 (1), 19–30.
(301) Lang, P. O.; Samaras, N.; Samaras, D.; Aspinall, R. How Important Is Vitamin D in Preventing Infections? Osteoporos Int 2013, 24 (5), 1537–1553. https://doi.org/10.1007/s00198-012-2204-6.
(302) Zdrenghea, M. T.; Makrinioti, H.; Bagacean, C.; Bush, A.; Johnston, S. L.; Stanciu, L. A. Vitamin D Modulation of Innate Immune Responses to Respiratory Viral Infections. Rev. Med. Virol. 2017, 27 (1). https://doi.org/10.1002/rmv.1909.
(303) Lang, P. O.; Aspinall, R. Vitamin D Status and the Host Resistance to Infections: What It Is Currently (Not) Understood. Clin Ther 2017, 39 (5), 930–945. https://doi.org/10.1016/j.clinthera.2017.04.004.
(304) Hoe, E.; Nathanielsz, J.; Toh, Z. Q.; Spry, L.; Marimla, R.; Balloch, A.; Mulholland, K.; Licciardi, P. V. Anti-Inflammatory Effects of Vitamin D on Human Immune Cells in the Context of Bacterial Infection. Nutrients 2016, 8 (12). https://doi.org/10.3390/nu8120806.
(305) Lang, P. O.; Aspinall, R. Can We Translate Vitamin D Immunomodulating Effect on Innate and Adaptive Immunity to Vaccine Response? Nutrients 2015, 7 (3), 2044–2060. https://doi.org/10.3390/nu7032044.
(306) Li, Y. C.; Chen, Y.; Du, J. Critical Roles of Intestinal Epithelial Vitamin D Receptor Signaling in Controlling Gut Mucosal Inflammation. J. Steroid Biochem. Mol. Biol. 2015, 148, 179–183. https://doi.org/10.1016/j.jsbmb.2015.01.011.
(307) MacLaughlin, J.; Holick, M. F. Aging Decreases the Capacity of Human Skin to Produce Vitamin D3. J. Clin. Invest. 1985, 76 (4), 1536–1538. https://doi.org/10.1172/JCI112134.
(308) Tangpricha, V.; Pearce, E. N.; Chen, T. C.; Holick, M. F. Vitamin D Insufficiency among Free-Living Healthy Young Adults. Am J Med 2002, 112 (8), 659–662.
(309) Holick, M. F. Sunlight and Vitamin D for Bone Health and Prevention of Autoimmune Diseases, Cancers, and Cardiovascular Disease. Am. J. Clin. Nutr. 2004, 80 (6 Suppl), 1678S-88S. https://doi.org/10.1093/ajcn/80.6.1678S.
(310) Nonnecke, B. J.; McGill, J. L.; Ridpath, J. F.; Sacco, R. E.; Lippolis, J. D.; Reinhardt, T. A. Acute Phase Response Elicited by Experimental Bovine Diarrhea Virus (BVDV) Infection Is Associated with Decreased Vitamin D and E Status of Vitamin-Replete Preruminant Calves. J. Dairy Sci. 2014, 97 (9), 5566–5579. https://doi.org/10.3168/jds.2014-8293.
(311) Martineau, A. R.; Jolliffe, D. A.; Hooper, R. L.; Greenberg, L.; Aloia, J. F.; Bergman, P.; Dubnov-Raz, G.; Esposito, S.; Ganmaa, D.; Ginde, A. A.; Goodall, E. C.; Grant, C. C.; Griffiths, C. J.; Janssens, W.; Laaksi, I.; Manaseki-Holland, S.; Mauger, D.; Murdoch, D. R.; Neale, R.; Rees, J. R.; Simpson, S.; Stelmach, I.; Kumar, G. T.; Urashima, M.; Camargo, C. A. Vitamin D Supplementation to Prevent Acute Respiratory Tract Infections: Systematic Review and Meta-Analysis of Individual Participant Data. BMJ 2017, 356, i6583. https://doi.org/10.1136/bmj.i6583.
(312) de Castro Kroner, J.; Sommer, A.; Fabri, M. Vitamin D Every Day to Keep the Infection Away? Nutrients 2015, 7 (6), 4170–4188. https://doi.org/10.3390/nu7064170.
(313) Ginde, A. A.; Mansbach, J. M.; Camargo, C. A. Association between Serum 25-Hydroxyvitamin D Level and Upper Respiratory Tract Infection in the Third National Health and Nutrition Examination Survey. Arch. Intern. Med. 2009, 169 (4), 384–390. https://doi.org/10.1001/archinternmed.2008.560.
(314) de Haan, K.; Groeneveld, A. B. J.; de Geus, H. R. H.; Egal, M.; Struijs, A. Vitamin D Deficiency as a Risk Factor for Infection, Sepsis and Mortality in the Critically Ill: Systematic Review and Meta-Analysis. Crit Care 2014, 18 (6), 660. https://doi.org/10.1186/s13054-014-0660-4.
(315) Upala, S.; Sanguankeo, A.; Permpalung, N. Significant Association between Vitamin D Deficiency and Sepsis: A Systematic Review and Meta-Analysis. BMC Anesthesiol 2015, 15, 84. https://doi.org/10.1186/s12871-015-0063-3.
(316) Matysiak-Luśnia, K. Vitamin D in Critically Ill Patients. Anaesthesiol Intensive Ther 2016, 48 (3), 201–207. https://doi.org/10.5603/AIT.a2016.0034.
(317) Amrein, K.; Schnedl, C.; Holl, A.; Riedl, R.; Christopher, K. B.; Pachler, C.; Urbanic Purkart, T.; Waltensdorfer, A.; Münch, A.; Warnkross, H.; Stojakovic, T.; Bisping, E.; Toller, W.; Smolle, K.-H.; Berghold, A.; Pieber, T. R.; Dobnig, H. Effect of High-Dose Vitamin D3 on Hospital Length of Stay in Critically Ill Patients with Vitamin D Deficiency: The VITdAL-ICU Randomized Clinical Trial. JAMA 2014, 312 (15), 1520–1530. https://doi.org/10.1001/jama.2014.13204.
(318) Science, M.; Maguire, J. L.; Russell, M. L.; Smieja, M.; Walter, S. D.; Loeb, M. Serum 25-Hydroxyvitamin D Level and Influenza Vaccine Immunogenicity in Children and Adolescents. PLoS One 2014, 9 (1). https://doi.org/10.1371/journal.pone.0083553.
(319) He, C.-S.; Aw Yong, X. H.; Walsh, N. P.; Gleeson, M. Is There an Optimal Vitamin D Status for Immunity in Athletes and Military Personnel? Exerc Immunol Rev 2016, 22, 42–64.
(320) Takács, I.; Tóth, B. E.; Szekeres, L.; Szabó, B.; Bakos, B.; Lakatos, P. Randomized Clinical Trial to Comparing Efficacy of Daily, Weekly and Monthly Administration of Vitamin D3. Endocrine 2017, 55 (1), 60–65. https://doi.org/10.1007/s12020-016-1137-9.
(321) Bergman, P.; Lindh, A. U.; Björkhem-Bergman, L.; Lindh, J. D. Vitamin D and Respiratory Tract Infections: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS ONE 2013, 8 (6), e65835. https://doi.org/10.1371/journal.pone.0065835.
(322) Handel, A. E.; Sandve, G. K.; Disanto, G.; Berlanga-Taylor, A. J.; Gallone, G.; Hanwell, H.; Drabløs, F.; Giovannoni, G.; Ebers, G. C.; Ramagopalan, S. V. Vitamin D Receptor ChIP-Seq in Primary CD4+ Cells: Relationship to Serum 25-Hydroxyvitamin D Levels and Autoimmune Disease. BMC Med 2013, 11, 163. https://doi.org/10.1186/1741-7015-11-163.
(323) Seuter, S.; Neme, A.; Carlberg, C. Epigenome-Wide Effects of Vitamin D and Their Impact on the Transcriptome of Human Monocytes Involve CTCF. Nucleic Acids Res. 2016, 44 (9), 4090–4104. https://doi.org/10.1093/nar/gkv1519.
(324) Aglipay, M.; Birken, C. S.; Parkin, P. C.; Loeb, M. B.; Thorpe, K.; Chen, Y.; Laupacis, A.; Mamdani, M.; Macarthur, C.; Hoch, J. S.; Mazzulli, T.; Maguire, J. L.; TARGet Kids! Collaboration. Effect of High-Dose vs Standard-Dose Wintertime Vitamin D Supplementation on Viral Upper Respiratory Tract Infections in Young Healthy Children. JAMA 2017, 318 (3), 245–254. https://doi.org/10.1001/jama.2017.8708.
(325) Wu, D.; Lewis, E. D.; Pae, M.; Meydani, S. N. Nutritional Modulation of Immune Function: Analysis of Evidence, Mechanisms, and Clinical Relevance. Front Immunol 2018, 9, 3160. https://doi.org/10.3389/fimmu.2018.03160.
(326) Lee, G. Y.; Han, S. N. The Role of Vitamin E in Immunity. Nutrients 2018, 10 (11). https://doi.org/10.3390/nu10111614.
(327) Meydani, S. N.; Meydani, M.; Blumberg, J. B.; Leka, L. S.; Siber, G.; Loszewski, R.; Thompson, C.; Pedrosa, M. C.; Diamond, R. D.; Stollar, B. D. Vitamin E Supplementation and in Vivo Immune Response in Healthy Elderly Subjects. A Randomized Controlled Trial. JAMA 1997, 277 (17), 1380–1386. https://doi.org/10.1001/jama.1997.03540410058031.
(328) Ravaglia, G.; Forti, P.; Maioli, F.; Bastagli, L.; Facchini, A.; Mariani, E.; Savarino, L.; Sassi, S.; Cucinotta, D.; Lenaz, G. Effect of Micronutrient Status on Natural Killer Cell Immune Function in Healthy Free-Living Subjects Aged >/=90 y. Am. J. Clin. Nutr. 2000, 71 (2), 590–598. https://doi.org/10.1093/ajcn/71.2.590.
(329) Hemilä, H.; Kaprio, J.; Albanes, D.; Heinonen, O. P.; Virtamo, J. Vitamin C, Vitamin E, and Beta-Carotene in Relation to Common Cold Incidence in Male Smokers. Epidemiology 2002, 13 (1), 32–37. https://doi.org/10.1097/00001648-200201000-00006.
(330) Meydani, S. N.; Leka, L. S.; Fine, B. C.; Dallal, G. E.; Keusch, G. T.; Singh, M. F.; Hamer, D. H. Vitamin E and Respiratory Tract Infections in Elderly Nursing Home Residents: A Randomized Controlled Trial. JAMA 2004, 292 (7), 828–836. https://doi.org/10.1001/jama.292.7.828.
(331) Beck, M. A.; Kolbeck, P. C.; Rohr, L. H.; Shi, Q.; Morris, V. C.; Levander, O. A. Vitamin E Deficiency Intensifies the Myocardial Injury of Coxsackievirus B3 Infection of Mice. J. Nutr. 1994, 124 (3), 345–358. https://doi.org/10.1093/jn/124.3.345.
(332) Beck, M. A. Increased Virulence of Coxsackievirus B3 in Mice Due to Vitamin E or Selenium Deficiency. J. Nutr. 1997, 127 (5 Suppl), 966S-970S. https://doi.org/10.1093/jn/127.5.966S.
(333) Meydani, S. N.; Lewis, E. D.; Wu, D. Perspective: Should Vitamin E Recommendations for Older Adults Be Increased? Adv Nutr 2018, 9 (5), 533–543. https://doi.org/10.1093/advances/nmy035.
(334) Semba, R. D. The Role of Vitamin A and Related Retinoids in Immune Function. Nutr. Rev. 1998, 56 (1 Pt 2), S38-48. https://doi.org/10.1111/j.1753-4887.1998.tb01643.x.
(335) Semba, R. D. Vitamin A and Immunity to Viral, Bacterial and Protozoan Infections. Proc Nutr Soc 1999, 58 (3), 719–727. https://doi.org/10.1017/s0029665199000944.
(336) Tielsch, J. M.; West, K. P.; Katz, J.; Chirambo, M. C.; Schwab, L.; Johnson, G. J.; Tizazu, T.; Swartwood, J.; Sommer, A. Prevalence and Severity of Xerophthalmia in Southern Malawi. Am. J. Epidemiol. 1986, 124 (4), 561–568. https://doi.org/10.1093/oxfordjournals.aje.a114428.
(337) Jee, J.; Hoet, A. E.; Azevedo, M. P.; Vlasova, A. N.; Loerch, S. C.; Pickworth, C. L.; Hanson, J.; Saif, L. J. Effects of Dietary Vitamin A Content on Antibody Responses of Feedlot Calves Inoculated Intramuscularly with an Inactivated Bovine Coronavirus Vaccine. Am. J. Vet. Res. 2013, 74 (10), 1353–1362. https://doi.org/10.2460/ajvr.74.10.1353.
(338) West, C. E.; Sijtsma, S. R.; Kouwenhoven, B.; Rombout, J. H.; van der Zijpp, A. J. Epithelia-Damaging Virus Infections Affect Vitamin A Status in Chickens. J. Nutr. 1992, 122 (2), 333–339. https://doi.org/10.1093/jn/122.2.333.
(339) Omenn, G. S.; Goodman, G. E.; Thornquist, M. D.; Balmes, J.; Cullen, M. R.; Glass, A.; Keogh, J. P.; Meyskens, F. L.; Valanis, B.; Williams, J. H.; Barnhart, S.; Cherniack, M. G.; Brodkin, C. A.; Hammar, S. Risk Factors for Lung Cancer and for Intervention Effects in CARET, the Beta-Carotene and Retinol Efficacy Trial. J. Natl. Cancer Inst. 1996, 88 (21), 1550–1559. https://doi.org/10.1093/jnci/88.21.1550.
(340) Middha, P.; Weinstein, S. J.; Männistö, S.; Albanes, D.; Mondul, A. M. β-Carotene Supplementation and Lung Cancer Incidence in the Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study: The Role of Tar and Nicotine. Nicotine Tob. Res. 2019, 21 (8), 1045–1050. https://doi.org/10.1093/ntr/nty115.
(341) Goodman, G. E.; Thornquist, M. D.; Balmes, J.; Cullen, M. R.; Meyskens, F. L.; Omenn, G. S.; Valanis, B.; Williams, J. H. The Beta-Carotene and Retinol Efficacy Trial: Incidence of Lung Cancer and Cardiovascular Disease Mortality during 6-Year Follow-up after Stopping Beta-Carotene and Retinol Supplements. J. Natl. Cancer Inst. 2004, 96 (23), 1743–1750. https://doi.org/10.1093/jnci/djh320.
(342) The Alpha-Tocopherol, Beta-Carotene Lung Cancer Prevention Study: Design, Methods, Participant Characteristics, and Compliance. The ATBC Cancer Prevention Study Group. Ann Epidemiol 1994, 4 (1), 1–10. https://doi.org/10.1016/1047-2797(94)90036-1.
(343) Brigelius-Flohé, R.; Maiorino, M. Glutathione Peroxidases. Biochim. Biophys. Acta 2013, 1830 (5), 3289–3303. https://doi.org/10.1016/j.bbagen.2012.11.020.
(344) Guillin, O. M.; Vindry, C.; Ohlmann, T.; Chavatte, L. Selenium, Selenoproteins and Viral Infection. Nutrients 2019, 11 (9). https://doi.org/10.3390/nu11092101.
(345) Beck, M. A.; Nelson, H. K.; Shi, Q.; Van Dael, P.; Schiffrin, E. J.; Blum, S.; Barclay, D.; Levander, O. A. Selenium Deficiency Increases the Pathology of an Influenza Virus Infection. FASEB J. 2001, 15 (8), 1481–1483.
(346) Beck, M. A.; Williams-Toone, D.; Levander, O. A. Coxsackievirus B3-Resistant Mice Become Susceptible in Se/Vitamin E Deficiency. Free Radic. Biol. Med. 2003, 34 (10), 1263–1270. https://doi.org/10.1016/s0891-5849(03)00101-1.
(347) Beck, M. A.; Shi, Q.; Morris, V. C.; Levander, O. A. Benign Coxsackievirus Damages Heart Muscle in Iron-Loaded Vitamin E-Deficient Mice. Free Radic. Biol. Med. 2005, 38 (1), 112–116. https://doi.org/10.1016/j.freeradbiomed.2004.10.007.
(348) Jaspers, I.; Zhang, W.; Brighton, L. E.; Carson, J. L.; Styblo, M.; Beck, M. A. Selenium Deficiency Alters Epithelial Cell Morphology and Responses to Influenza. Free Radic. Biol. Med. 2007, 42 (12), 1826–1837. https://doi.org/10.1016/j.freeradbiomed.2007.03.017.
(349) Nelson, H. K.; Shi, Q.; Van Dael, P.; Schiffrin, E. J.; Blum, S.; Barclay, D.; Levander, O. A.; Beck, M. A. Host Nutritional Selenium Status as a Driving Force for Influenza Virus Mutations. FASEB J. 2001, 15 (10), 1846–1848.
(350) Maares, M.; Haase, H. Zinc and Immunity: An Essential Interrelation. Arch. Biochem. Biophys. 2016, 611, 58–65. https://doi.org/10.1016/j.abb.2016.03.022.
(351) Prasad, A. S.; Meftah, S.; Abdallah, J.; Kaplan, J.; Brewer, G. J.; Bach, J. F.; Dardenne, M. Serum Thymulin in Human Zinc Deficiency. J. Clin. Invest. 1988, 82 (4), 1202–1210. https://doi.org/10.1172/JCI113717.
(352) Keen, C. L.; Gershwin, M. E. Zinc Deficiency and Immune Function. Annu. Rev. Nutr. 1990, 10, 415–431. https://doi.org/10.1146/annurev.nu.10.070190.002215.
(353) Prasad, A. S. Effects of Zinc Deficiency on Th1 and Th2 Cytokine Shifts. J. Infect. Dis. 2000, 182 Suppl 1, S62-68. https://doi.org/10.1086/315916.
(354) Hawrylowicz, C. M.; O’Garra, A. Potential Role of Interleukin-10-Secreting Regulatory T Cells in Allergy and Asthma. Nat. Rev. Immunol. 2005, 5 (4), 271–283. https://doi.org/10.1038/nri1589.
(355) Kitabayashi, C.; Fukada, T.; Kanamoto, M.; Ohashi, W.; Hojyo, S.; Atsumi, T.; Ueda, N.; Azuma, I.; Hirota, H.; Murakami, M.; Hirano, T. Zinc Suppresses Th17 Development via Inhibition of STAT3 Activation. Int. Immunol. 2010, 22 (5), 375–386. https://doi.org/10.1093/intimm/dxq017.
(356) Rosenkranz, E.; Maywald, M.; Hilgers, R.-D.; Brieger, A.; Clarner, T.; Kipp, M.; Plümäkers, B.; Meyer, S.; Schwerdtle, T.; Rink, L. Induction of Regulatory T Cells in Th1-/Th17-Driven Experimental Autoimmune Encephalomyelitis by Zinc Administration. J. Nutr. Biochem. 2016, 29, 116–123. https://doi.org/10.1016/j.jnutbio.2015.11.010.
(357) Driessen, C.; Hirv, K.; Kirchner, H.; Rink, L. Zinc Regulates Cytokine Induction by Superantigens and Lipopolysaccharide. Immunology 1995, 84 (2), 272–277.
(358) Maret, W.; Sandstead, H. H. Zinc Requirements and the Risks and Benefits of Zinc Supplementation. J Trace Elem Med Biol 2006, 20 (1), 3–18. https://doi.org/10.1016/j.jtemb.2006.01.006.
(359) Maggini, S.; Beveridge, S.; Suter, M. A Combination of High-Dose Vitamin C plus Zinc for the Common Cold. J. Int. Med. Res. 2012, 40 (1), 28–42. https://doi.org/10.1177/147323001204000104.
(360) Rosenkranz, E.; Hilgers, R.-D.; Uciechowski, P.; Petersen, A.; Plümäkers, B.; Rink, L. Zinc Enhances the Number of Regulatory T Cells in Allergen-Stimulated Cells from Atopic Subjects. Eur J Nutr 2017, 56 (2), 557–567. https://doi.org/10.1007/s00394-015-1100-1.
(361) Wadhwa, N.; Basnet, S.; Natchu, U. C. M.; Shrestha, L. P.; Bhatnagar, S.; Sommerfelt, H.; Strand, T. A.; Ramji, S.; Aggarwal, K. C.; Chellani, H.; Govil, A.; Jajoo, M.; Mathur, N. B.; Bhatt, M.; Mohta, A.; Ansari, I.; Basnet, S.; Chapagain, R. H.; Shah, G. P.; Shrestha, B. M. Zinc as an Adjunct Treatment for Reducing Case Fatality Due to Clinical Severe Infection in Young Infants: Study Protocol for a Randomized Controlled Trial. BMC Pharmacol Toxicol 2017, 18. https://doi.org/10.1186/s40360-017-0162-5.
(362) Eby, G. A.; Davis, D. R.; Halcomb, W. W. Reduction in Duration of Common Colds by Zinc Gluconate Lozenges in a Double-Blind Study. Antimicrob. Agents Chemother. 1984, 25 (1), 20–24. https://doi.org/10.1128/aac.25.1.20.
(363) Science, M.; Johnstone, J.; Roth, D. E.; Guyatt, G.; Loeb, M. Zinc for the Treatment of the Common Cold: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. CMAJ 2012, 184 (10), E551-561. https://doi.org/10.1503/cmaj.111990.
(364) Macknin, M. L.; Piedmonte, M.; Calendine, C.; Janosky, J.; Wald, E. Zinc Gluconate Lozenges for Treating the Common Cold in Children: A Randomized Controlled Trial. JAMA 1998, 279 (24), 1962–1967. https://doi.org/10.1001/jama.279.24.1962.
(365) Singh, M.; Das, R. R. WITHDRAWN: Zinc for the Common Cold. Cochrane Database Syst Rev 2015, No. 4, CD001364. https://doi.org/10.1002/14651858.CD001364.pub5.
(366) te Velthuis, A. J. W.; van den Worm, S. H. E.; Sims, A. C.; Baric, R. S.; Snijder, E. J.; van Hemert, M. J. Zn(2+) Inhibits Coronavirus and Arterivirus RNA Polymerase Activity in Vitro and Zinc Ionophores Block the Replication of These Viruses in Cell Culture. PLoS Pathog. 2010, 6 (11), e1001176. https://doi.org/10.1371/journal.ppat.1001176.
(367) Wellinghausen, N.; Driessen, C.; Rink, L. Stimulation of Human Peripheral Blood Mononuclear Cells by Zinc and Related Cations. Cytokine 1996, 8 (10), 767–771. https://doi.org/10.1006/cyto.1996.0102.
(368) Campo, C. A.; Wellinghausen, N.; Faber, C.; Fischer, A.; Rink, L. Zinc Inhibits the Mixed Lymphocyte Culture. Biol Trace Elem Res 2001, 79 (1), 15–22. https://doi.org/10.1385/BTER:79:1:15.
(369) Faber, C.; Gabriel, P.; Ibs, K.-H.; Rink, L. Zinc in Pharmacological Doses Suppresses Allogeneic Reaction without Affecting the Antigenic Response. Bone Marrow Transplant. 2004, 33 (12), 1241–1246. https://doi.org/10.1038/sj.bmt.1704509.
(370) Duchateau, J.; Delepesse, G.; Vrijens, R.; Collet, H. Beneficial Effects of Oral Zinc Supplementation on the Immune Response of Old People. Am. J. Med. 1981, 70 (5), 1001–1004. https://doi.org/10.1016/0002-9343(81)90849-4.
(371) Van Campen, D. R. Copper Interference with the Intestinal Absorption of Zinc-65 by Rats. J. Nutr. 1969, 97 (1), 104–108. https://doi.org/10.1093/jn/97.1.104.
(372) Fiske, D. N.; McCoy, H. E.; Kitchens, C. S. Zinc-Induced Sideroblastic Anemia: Report of a Case, Review of the Literature, and Description of the Hematologic Syndrome. Am. J. Hematol. 1994, 46 (2), 147–150. https://doi.org/10.1002/ajh.2830460217.
(373) Sandstead, H. H. Requirements and Toxicity of Essential Trace Elements, Illustrated by Zinc and Copper. Am. J. Clin. Nutr. 1995, 61 (3 Suppl), 621S-624S. https://doi.org/10.1093/ajcn/61.3.621S.
(374) Jarrard, D. F. Does Zinc Supplementation Increase the Risk of Prostate Cancer? Arch. Ophthalmol. 2005, 123 (1), 102–103. https://doi.org/10.1001/archopht.123.1.102.
(375) Jayaweera, J. A. A. S.; Reyes, M.; Joseph, A. Childhood Iron Deficiency Anemia Leads to Recurrent Respiratory Tract Infections and Gastroenteritis. Sci Rep 2019, 9 (1), 12637. https://doi.org/10.1038/s41598-019-49122-z.
(376) Weinberg, E. D. Iron Withholding: A Defense against Viral Infections. Biometals 1996, 9 (4), 393–399. https://doi.org/10.1007/bf00140609.
(377) Ganz, T. Systemic Iron Homeostasis. Physiol. Rev. 2013, 93 (4), 1721–1741. https://doi.org/10.1152/physrev.00008.2013.
(378) Fujita, N.; Sugimoto, R.; Urawa, N.; Araki, J.; Mifuji, R.; Yamamoto, M.; Horiike, S.; Tanaka, H.; Iwasa, M.; Kobayashi, Y.; Adachi, Y.; Kaito, M. Hepatic Iron Accumulation Is Associated with Disease Progression and Resistance to Interferon/Ribavirin Combination Therapy in Chronic Hepatitis C. J. Gastroenterol. Hepatol. 2007, 22 (11), 1886–1893. https://doi.org/10.1111/j.1440-1746.2006.04759.x.
(379) Wessling-Resnick, M. Crossing the Iron Gate: Why and How Transferrin Receptors Mediate Viral Entry. Annu. Rev. Nutr. 2018, 38, 431–458. https://doi.org/10.1146/annurev-nutr-082117-051749.
(380) Keil, S. D.; Bowen, R.; Marschner, S. Inactivation of Middle East Respiratory Syndrome Coronavirus (MERS-CoV) in Plasma Products Using a Riboflavin-Based and Ultraviolet Light-Based Photochemical Treatment. Transfusion 2016, 56 (12), 2948–2952. https://doi.org/10.1111/trf.13860.
(381) Kyme, P.; Thoennissen, N. H.; Tseng, C. W.; Thoennissen, G. B.; Wolf, A. J.; Shimada, K.; Krug, U. O.; Lee, K.; Müller-Tidow, C.; Berdel, W. E.; Hardy, W. D.; Gombart, A. F.; Koeffler, H. P.; Liu, G. Y. C/EBPε Mediates Nicotinamide-Enhanced Clearance of Staphylococcus Aureus in Mice. J. Clin. Invest. 2012, 122 (9), 3316–3329. https://doi.org/10.1172/JCI62070.
(382) Jones, H. D.; Yoo, J.; Crother, T. R.; Kyme, P.; Ben-Shlomo, A.; Khalafi, R.; Tseng, C. W.; Parks, W. C.; Arditi, M.; Liu, G. Y.; Shimada, K. Correction: Nicotinamide Exacerbates Hypoxemia in Ventilator-Induced Lung Injury Independent of Neutrophil Infiltration. PLoS One 2015, 10 (5). https://doi.org/10.1371/journal.pone.0128735.
(383) Zhang, L.; Liu, Y. Potential Interventions for Novel Coronavirus in China: A Systematic Review. J. Med. Virol. 2020, 92 (5), 479–490. https://doi.org/10.1002/jmv.25707.
(384) Fraternale, A.; Paoletti, M. F.; Casabianca, A.; Nencioni, L.; Garaci, E.; Palamara, A. T.; Magnani, M. GSH and Analogs in Antiviral Therapy. Mol. Aspects Med. 2009, 30 (1–2), 99–110. https://doi.org/10.1016/j.mam.2008.09.001.
(385) Mak, T. W.; Grusdat, M.; Duncan, G. S.; Dostert, C.; Nonnenmacher, Y.; Cox, M.; Binsfeld, C.; Hao, Z.; Brüstle, A.; Itsumi, M.; Jäger, C.; Chen, Y.; Pinkenburg, O.; Camara, B.; Ollert, M.; Bindslev-Jensen, C.; Vasiliou, V.; Gorrini, C.; Lang, P. A.; Lohoff, M.; Harris, I. S.; Hiller, K.; Brenner, D. Glutathione Primes T Cell Metabolism for Inflammation. Immunity 2017, 46 (4), 675–689. https://doi.org/10.1016/j.immuni.2017.03.019.
(386) Lian, G.; Gnanaprakasam, J. R.; Wang, T.; Wu, R.; Chen, X.; Liu, L.; Shen, Y.; Yang, M.; Yang, J.; Chen, Y.; Vasiliou, V.; Cassel, T. A.; Green, D. R.; Liu, Y.; Fan, T. W.; Wang, R. Glutathione de Novo Synthesis but Not Recycling Process Coordinates with Glutamine Catabolism to Control Redox Homeostasis and Directs Murine T Cell Differentiation. Elife 2018, 7. https://doi.org/10.7554/eLife.36158.
(387) Zhang, H.; Forman, H. J.; Choi, J. Gamma-Glutamyl Transpeptidase in Glutathione Biosynthesis. Meth. Enzymol. 2005, 401, 468–483. https://doi.org/10.1016/S0076-6879(05)01028-1.
(388) Kretzschmar, M. Regulation of Hepatic Glutathione Metabolism and Its Role in Hepatotoxicity. Exp. Toxicol. Pathol. 1996, 48 (5), 439–446. https://doi.org/10.1016/S0940-2993(96)80054-6.
(389) de Andrade, K. Q.; Moura, F. A.; dos Santos, J. M.; de Araújo, O. R. P.; de Farias Santos, J. C.; Goulart, M. O. F. Oxidative Stress and Inflammation in Hepatic Diseases: Therapeutic Possibilities of N-Acetylcysteine. Int J Mol Sci 2015, 16 (12), 30269–30308. https://doi.org/10.3390/ijms161226225.
(390) Sekhar, R. V.; McKay, S. V.; Patel, S. G.; Guthikonda, A. P.; Reddy, V. T.; Balasubramanyam, A.; Jahoor, F. Glutathione Synthesis Is Diminished in Patients with Uncontrolled Diabetes and Restored by Dietary Supplementation with Cysteine and Glycine. Diabetes Care 2011, 34 (1), 162–167. https://doi.org/10.2337/dc10-1006.
(391) McCarty, M. F.; O’Keefe, J. H.; DiNicolantonio, J. J. Dietary Glycine Is Rate-Limiting for Glutathione Synthesis and May Have Broad Potential for Health Protection. Ochsner J 2018, 18 (1), 81–87.
(392) Cruzat, V. F.; Bittencourt, A.; Scomazzon, S. P.; Leite, J. S. M.; de Bittencourt, P. I. H.; Tirapegui, J. Oral Free and Dipeptide Forms of Glutamine Supplementation Attenuate Oxidative Stress and Inflammation Induced by Endotoxemia. Nutrition 2014, 30 (5), 602–611. https://doi.org/10.1016/j.nut.2013.10.019.
(393) Cruzat, V.; Macedo Rogero, M.; Noel Keane, K.; Curi, R.; Newsholme, P. Glutamine: Metabolism and Immune Function, Supplementation and Clinical Translation. Nutrients 2018, 10 (11). https://doi.org/10.3390/nu10111564.
(394) Ardawi, M. S. M.; Newsholme, E. A. Maximum Activities of Some Enzymes of Glycolysis, the Tricarboxylic Acid Cycle and Ketone-Body and Glutamine Utilization Pathways in Lymphocytes of the Rat. Biochem J 1982, 208 (3), 743–748.
(395) Newsholme, P.; Curi, R.; Gordon, S.; Newsholme, E. A. Metabolism of Glucose, Glutamine, Long-Chain Fatty Acids and Ketone Bodies by Murine Macrophages. Biochem J 1986, 239 (1), 121–125.
(396) Curi, R.; Newsholme, P.; Newsholme, E. A. Intracellular Distribution of Some Enzymes of the Glutamine Utilisation Pathway in Rat Lymphocytes. Biochem. Biophys. Res. Commun. 1986, 138 (1), 318–322. https://doi.org/10.1016/0006-291x(86)90282-2.
(397) Newsholme, E. A.; Newsholme, P.; Curi, R. The Role of the Citric Acid Cycle in Cells of the Immune System and Its Importance in Sepsis, Trauma and Burns. Biochem. Soc. Symp. 1987, 54, 145–162.
(398) Souba, W. W.; Smith, R. J.; Wilmore, D. W. Glutamine Metabolism by the Intestinal Tract. JPEN J Parenter Enteral Nutr 1985, 9 (5), 608–617. https://doi.org/10.1177/0148607185009005608.
(399) Labow, B. I.; Souba, W. W.; Abcouwer, S. F. Mechanisms Governing the Expression of the Enzymes of Glutamine Metabolism–Glutaminase and Glutamine Synthetase. J. Nutr. 2001, 131 (9 Suppl), 2467S-74S; discussion 2486S-7S. https://doi.org/10.1093/jn/131.9.2467S.
(400) Kim, M.-H.; Kim, H. The Roles of Glutamine in the Intestine and Its Implication in Intestinal Diseases. Int J Mol Sci 2017, 18 (5). https://doi.org/10.3390/ijms18051051.
(401) Lenders, C. M.; Liu, S.; Wilmore, D. W.; Sampson, L.; Dougherty, L. W.; Spiegelman, D.; Willett, W. C. Evaluation of a Novel Food Composition Database That Includes Glutamine and Other Amino Acids Derived from Gene Sequencing Data. Eur J Clin Nutr 2009, 63 (12), 1433–1439. https://doi.org/10.1038/ejcn.2009.110.
(402) Pouchieu, C.; Fassier, P.; Druesne-Pecollo, N.; Zelek, L.; Bachmann, P.; Touillaud, M.; Bairati, I.; Hercberg, S.; Galan, P.; Cohen, P.; Latino-Martel, P.; Touvier, M. Dietary Supplement Use among Cancer Survivors of the NutriNet-Santé Cohort Study. Br. J. Nutr. 2015, 113 (8), 1319–1329. https://doi.org/10.1017/S0007114515000239.
(403) Stehle, P.; Kuhn, K. S. Glutamine: An Obligatory Parenteral Nutrition Substrate in Critical Care Therapy. Biomed Res Int 2015, 2015. https://doi.org/10.1155/2015/545467.
(404) Sayles, C.; Hickerson, S. C.; Bhat, R. R.; Hall, J.; Garey, K. W.; Trivedi, M. V. Oral Glutamine in Preventing Treatment-Related Mucositis in Adult Patients With Cancer: A Systematic Review. Nutr Clin Pract 2016, 31 (2), 171–179. https://doi.org/10.1177/0884533615611857.
(405) Raizel, R.; Leite, J. S. M.; Hypólito, T. M.; Coqueiro, A. Y.; Newsholme, P.; Cruzat, V. F.; Tirapegui, J. Determination of the Anti-Inflammatory and Cytoprotective Effects of l-Glutamine and l-Alanine, or Dipeptide, Supplementation in Rats Submitted to Resistance Exercise. Br. J. Nutr. 2016, 116 (3), 470–479. https://doi.org/10.1017/S0007114516001999.
(406) Gu, C.-Q.; Li, J.; Li, J.-W.; Chao, F.-H. Inhibition of Hepatitis B Virus by D-Fraction from Grifola Frondosa: Synergistic Effect of Combination with Interferon-Alpha in HepG2 2.2.15. Antiviral Res. 2006, 72 (2), 162–165. https://doi.org/10.1016/j.antiviral.2006.05.011.
(407) Goodridge, H. S.; Wolf, A. J.; Underhill, D. M. Beta-Glucan Recognition by the Innate Immune System. Immunol. Rev. 2009, 230 (1), 38–50. https://doi.org/10.1111/j.1600-065X.2009.00793.x.
(408) Dai, X.; Stanilka, J. M.; Rowe, C. A.; Esteves, E. A.; Nieves, C.; Spaiser, S. J.; Christman, M. C.; Langkamp-Henken, B.; Percival, S. S. Consuming Lentinula Edodes (Shiitake) Mushrooms Daily Improves Human Immunity: A Randomized Dietary Intervention in Healthy Young Adults. J Am Coll Nutr 2015, 34 (6), 478–487. https://doi.org/10.1080/07315724.2014.950391.
(409) Zhao, C.; Gao, L.; Wang, C.; Liu, B.; Jin, Y.; Xing, Z. Structural Characterization and Antiviral Activity of a Novel Heteropolysaccharide Isolated from Grifola Frondosa against Enterovirus 71. Carbohydr Polym 2016, 144, 382–389. https://doi.org/10.1016/j.carbpol.2015.12.005.
(410) Netea, M. G.; Joosten, L. A. B.; Latz, E.; Mills, K. H. G.; Natoli, G.; Stunnenberg, H. G.; O’Neill, L. A. J.; Xavier, R. J. Trained Immunity: A Program of Innate Immune Memory in Health and Disease. Science 2016, 352 (6284), aaf1098. https://doi.org/10.1126/science.aaf1098.
(411) Gourbal, B.; Pinaud, S.; Beckers, G. J. M.; Van Der Meer, J. W. M.; Conrath, U.; Netea, M. G. Innate Immune Memory: An Evolutionary Perspective. Immunol. Rev. 2018, 283 (1), 21–40. https://doi.org/10.1111/imr.12647.
(412) Mao, X.; Hu, H.; Xiao, X.; Chen, D.; Yu, B.; He, J.; Yu, J.; Zheng, P.; Luo, J.; Luo, Y.; Wang, J. Lentinan Administration Relieves Gut Barrier Dysfunction Induced by Rotavirus in a Weaned Piglet Model. Food Funct 2019, 10 (4), 2094–2101. https://doi.org/10.1039/c8fo01764f.
(413) Wang, X.; Wang, W.; Wang, L.; Yu, C.; Zhang, G.; Zhu, H.; Wang, C.; Zhao, S.; Hu, C.-A. A.; Liu, Y. Lentinan Modulates Intestinal Microbiota and Enhances Barrier Integrity in a Piglet Model Challenged with Lipopolysaccharide. Food Funct 2019, 10 (1), 479–489. https://doi.org/10.1039/c8fo02438c.
(414) Ueda, Y.; Mori, K.; Satoh, S.; Dansako, H.; Ikeda, M.; Kato, N. Anti-HCV Activity of the Chinese Medicinal Fungus Cordyceps Militaris. Biochem. Biophys. Res. Commun. 2014, 447 (2), 341–345. https://doi.org/10.1016/j.bbrc.2014.03.150.
(415) Ying, M.; Yu, Q.; Zheng, B.; Wang, H.; Wang, J.; Chen, S.; Nie, S.; Xie, M. Cultured Cordyceps Sinensis Polysaccharides Modulate Intestinal Mucosal Immunity and Gut Microbiota in Cyclophosphamide-Treated Mice. Carbohydr Polym 2020, 235, 115957. https://doi.org/10.1016/j.carbpol.2020.115957.
(416) Stamets, P. Growing Gourmet and Medicinal Mushrooms; Potter/Ten Speed/Harmony/Rodale, 2011.
(417) Wachtel-Galor, S.; Yuen, J.; Buswell, J. A.; Benzie, I. F. F. Ganoderma Lucidum (Lingzhi or Reishi): A Medicinal Mushroom. In Herbal Medicine: Biomolecular and Clinical Aspects; Benzie, I. F. F., Wachtel-Galor, S., Eds.; CRC Press/Taylor & Francis: Boca Raton (FL), 2011.
(418) Xia, Q.; Zhang, H.; Sun, X.; Zhao, H.; Wu, L.; Zhu, D.; Yang, G.; Shao, Y.; Zhang, X.; Mao, X.; Zhang, L.; She, G. A Comprehensive Review of the Structure Elucidation and Biological Activity of Triterpenoids from Ganoderma Spp. Molecules 2014, 19 (11), 17478–17535. https://doi.org/10.3390/molecules191117478.
(419) Ferreira, I. C. F. R.; Vaz, J. A.; Vasconcelos, M. H.; Martins, A. Compounds from Wild Mushrooms with Antitumor Potential. Anticancer Agents Med Chem 2010, 10 (5), 424–436.
(420) Stojković, D. S.; Barros, L.; Calhelha, R. C.; Glamočlija, J.; Ćirić, A.; van Griensven, L. J. L. D.; Soković, M.; Ferreira, I. C. F. R. A Detailed Comparative Study between Chemical and Bioactive Properties of Ganoderma Lucidum from Different Origins. Int J Food Sci Nutr 2014, 65 (1), 42–47. https://doi.org/10.3109/09637486.2013.832173.
(421) Lubbe, A.; Seibert, I.; Klimkait, T.; van der Kooy, F. Ethnopharmacology in Overdrive: The Remarkable Anti-HIV Activity of Artemisia Annua. J Ethnopharmacol 2012, 141 (3), 854–859. https://doi.org/10.1016/j.jep.2012.03.024.
(422) Munyangi, J.; Cornet-Vernet, L.; Idumbo, M.; Lu, C.; Lutgen, P.; Perronne, C.; Ngombe, N.; Bianga, J.; Mupenda, B.; Lalukala, P.; Guy, M.; Mumba, D.; Towler, M.; Weathers, P. Artemisia Annua and Artemisia Afra Tea Infusions vs. Artesunate-Amodiaquine (ASAQ) in Treating Plasmodium Falciparum Malaria in a Large Scale, Double Blind, Randomized Clinical Trial. Phytomedicine 2018, 57. https://doi.org/10.1016/j.phymed.2018.12.002.
(423) ÉTUDES CLINIQUES https://webcache.googleusercontent.com/search?q=cache:8Yo0jNjnMDIJ:https://maison-artemisia.org/Maison-Artemisia-Cliniques.pdf+&cd=1&hl=fr&ct=clnk&gl=fr (accessed Jul 11, 2019).
(424) Romero, M. R.; Serrano, M. A.; Vallejo, M.; Efferth, T.; Alvarez, M.; Marin, J. J. G. Antiviral Effect of Artemisinin from Artemisia Annua against a Model Member of the Flaviviridae Family, the Bovine Viral Diarrhoea Virus (BVDV). Planta Med. 2006, 72 (13), 1169–1174. https://doi.org/10.1055/s-2006-947198.
(425) Efferth, T.; Romero, M. R.; Wolf, D. G.; Stamminger, T.; Marin, J. J. G.; Marschall, M. The Antiviral Activities of Artemisinin and Artesunate. Clin. Infect. Dis. 2008, 47 (6), 804–811. https://doi.org/10.1086/591195.
(426) Yan, H.; Wang, H.; Ma, L.; Ma, X.; Yin, J.; Wu, S.; Huang, H.; Li, Y. Cirsimaritin Inhibits Influenza A Virus Replication by Downregulating the NF-ΚB Signal Transduction Pathway. Virol. J. 2018, 15 (1), 88. https://doi.org/10.1186/s12985-018-0995-6.
(427) Chang, Y.-S.; Woo, E.-R. Korean Medicinal Plants Inhibiting to Human Immunodeficiency Virus Type 1 (HIV-1) Fusion. Phytother Res 2003, 17 (4), 426–429. https://doi.org/10.1002/ptr.1155.
(428) Wu, T. S.; Tsang, Z. J.; Wu, P. L.; Lin, F. W.; Li, C. Y.; Teng, C. M.; Lee, K. H. New Constituents and Antiplatelet Aggregation and Anti-HIV Principles of Artemisia Capillaris. Bioorg. Med. Chem. 2001, 9 (1), 77–83. https://doi.org/10.1016/s0968-0896(00)00225-x.
(429) Lin, H.-W.; Sun, M.-X.; Wang, Y.-H.; Yang, L.-M.; Yang, Y.-R.; Huang, N.; Xuan, L.-J.; Xu, Y.-M.; Bai, D.-L.; Zheng, Y.-T.; Xiao, K. Anti-HIV Activities of the Compounds Isolated from Polygonum Cuspidatum and Polygonum Multiflorum. Planta Med. 2010, 76 (9), 889–892. https://doi.org/10.1055/s-0029-1240796.
(430) Chang, J.-S.; Liu, H.-W.; Wang, K.-C.; Chen, M.-C.; Chiang, L.-C.; Hua, Y.-C.; Lin, C.-C. Ethanol Extract of Polygonum Cuspidatum Inhibits Hepatitis B Virus in a Stable HBV-Producing Cell Line. Antiviral Res. 2005, 66 (1), 29–34. https://doi.org/10.1016/j.antiviral.2004.12.006.
(431) Liu, Z.; Wei, F.; Chen, L.-J.; Xiong, H.-R.; Liu, Y.-Y.; Luo, F.; Hou, W.; Xiao, H.; Yang, Z.-Q. In Vitro and in Vivo Studies of the Inhibitory Effects of Emodin Isolated from Polygonum Cuspidatum on Coxsakievirus B₄. Molecules 2013, 18 (10), 11842–11858. https://doi.org/10.3390/molecules181011842.
(432) Yiu, C.-Y.; Chen, S.-Y.; Yang, T.-H.; Chang, C.-J.; Yeh, D.-B.; Chen, Y.-J.; Lin, T.-P. Inhibition of Epstein-Barr Virus Lytic Cycle by an Ethyl Acetate Subfraction Separated from Polygonum Cuspidatum Root and Its Major Component, Emodin. Molecules 2014, 19 (1), 1258–1272. https://doi.org/10.3390/molecules19011258.
(433) Lin, C.-J.; Lin, H.-J.; Chen, T.-H.; Hsu, Y.-A.; Liu, C.-S.; Hwang, G.-Y.; Wan, L. Polygonum Cuspidatum and Its Active Components Inhibit Replication of the Influenza Virus through Toll-like Receptor 9-Induced Interferon Beta Expression. PLoS ONE 2015, 10 (2), e0117602. https://doi.org/10.1371/journal.pone.0117602.
(434) Karsch-Völk, M.; Barrett, B.; Kiefer, D.; Bauer, R.; Ardjomand-Woelkart, K.; Linde, K. Echinacea for Preventing and Treating the Common Cold. Cochrane Database Syst Rev 2014, No. 2, CD000530. https://doi.org/10.1002/14651858.CD000530.pub3.
(435) Holst, L.; Havnen, G. C.; Nordeng, H. Echinacea and Elderberry-Should They Be Used against Upper Respiratory Tract Infections during Pregnancy? Front Pharmacol 2014, 5, 31. https://doi.org/10.3389/fphar.2014.00031.
(436) David, S.; Cunningham, R. Echinacea for the Prevention and Treatment of Upper Respiratory Tract Infections: A Systematic Review and Meta-Analysis. Complement Ther Med 2019, 44, 18–26. https://doi.org/10.1016/j.ctim.2019.03.011.
(437) Ali, T.; Choe, J.; Awab, A.; Wagener, T. L.; Orr, W. C. Sleep, Immunity and Inflammation in Gastrointestinal Disorders. World J. Gastroenterol. 2013, 19 (48), 9231–9239. https://doi.org/10.3748/wjg.v19.i48.9231.
(438) Qazi, T.; Farraye, F. A. Sleep and Inflammatory Bowel Disease: An Important Bi-Directional Relationship. Inflamm. Bowel Dis. 2019, 25 (5), 843–852. https://doi.org/10.1093/ibd/izy334.
(439) Lange, T.; Dimitrov, S.; Born, J. Effects of Sleep and Circadian Rhythm on the Human Immune System. Ann. N. Y. Acad. Sci. 2010, 1193, 48–59. https://doi.org/10.1111/j.1749-6632.2009.05300.x.
(440) Schmidt, M. H. The Energy Allocation Function of Sleep: A Unifying Theory of Sleep, Torpor, and Continuous Wakefulness. Neurosci Biobehav Rev 2014, 47, 122–153. https://doi.org/10.1016/j.neubiorev.2014.08.001.
(441) Ibarra-Coronado, E. G.; Pantaleón-Martínez, A. M.; Velazquéz-Moctezuma, J.; Prospéro-García, O.; Méndez-Díaz, M.; Pérez-Tapia, M.; Pavón, L.; Morales-Montor, J. The Bidirectional Relationship between Sleep and Immunity against Infections. J Immunol Res 2015, 2015, 678164. https://doi.org/10.1155/2015/678164.
(442) Piercy, K. L.; Troiano, R. P.; Ballard, R. M.; Carlson, S. A.; Fulton, J. E.; Galuska, D. A.; George, S. M.; Olson, R. D. The Physical Activity Guidelines for Americans. JAMA 2018, 320 (19), 2020–2028. https://doi.org/10.1001/jama.2018.14854.
(443) Campbell, J. P.; Turner, J. E. Debunking the Myth of Exercise-Induced Immune Suppression: Redefining the Impact of Exercise on Immunological Health Across the Lifespan. Front Immunol 2018, 9, 648. https://doi.org/10.3389/fimmu.2018.00648.
(444) Luan, X.; Tian, X.; Zhang, H.; Huang, R.; Li, N.; Chen, P.; Wang, R. Exercise as a Prescription for Patients with Various Diseases. J Sport Health Sci 2019, 8 (5), 422–441. https://doi.org/10.1016/j.jshs.2019.04.002.
(445) Weyh, C.; Krüger, K.; Strasser, B. Physical Activity and Diet Shape the Immune System during Aging. Nutrients 2020, 12 (3). https://doi.org/10.3390/nu12030622.
(446) Duggal, N. A.; Pollock, R. D.; Lazarus, N. R.; Harridge, S.; Lord, J. M. Major Features of Immunesenescence, Including Reduced Thymic Output, Are Ameliorated by High Levels of Physical Activity in Adulthood. Aging Cell 2018, 17 (2). https://doi.org/10.1111/acel.12750.
(447) Grande, A. J.; Keogh, J.; Hoffmann, T. C.; Beller, E. M.; Del Mar, C. B. Exercise versus No Exercise for the Occurrence, Severity and Duration of Acute Respiratory Infections. Cochrane Database Syst Rev 2015, No. 6, CD010596. https://doi.org/10.1002/14651858.CD010596.pub2.
(448) Owen, N.; Sparling, P. B.; Healy, G. N.; Dunstan, D. W.; Matthews, C. E. Sedentary Behavior: Emerging Evidence for a New Health Risk. Mayo Clin. Proc. 2010, 85 (12), 1138–1141. https://doi.org/10.4065/mcp.2010.0444.
(449) L’IMPACT DU SPORT SUR LE SYSTEME IMMUNITAIRE. 100.
(450) Tate, D. F.; Lyons, E. J.; Valle, C. G. High-Tech Tools for Exercise Motivation: Use and Role of Technologies Such as the Internet, Mobile Applications, Social Media, and Video Games. Diabetes Spectr 2015, 28 (1), 45–54. https://doi.org/10.2337/diaspect.28.1.45.
(451) Andrade, A.; Dominski, F. H.; Pereira, M. L.; de Liz, C. M.; Buonanno, G. Infection Risk in Gyms during Physical Exercise. Environ Sci Pollut Res Int 2018, 25 (20), 19675–19686. https://doi.org/10.1007/s11356-018-1822-8.
(452) Sun, P.; Lu, X.; Xu, C.; Sun, W.; Pan, B. Understanding of COVID-19 Based on Current Evidence. Journal of Medical Virology n/a (n/a). https://doi.org/10.1002/jmv.25722.
(453) Exercise and Infectious Diseases – Covid-19 | BJSM blog – social media’s leading SEM voice https://blogs.bmj.com/bjsm/2020/03/17/exercise-and-infectious-diseases-covid-19/ (accessed Mar 23, 2020).
(454) Chen, P.; Mao, L.; Nassis, G. P.; Harmer, P.; Ainsworth, B. E.; Li, F. Wuhan Coronavirus (2019-NCoV): The Need to Maintain Regular Physical Activity While Taking Precautions. J Sport Health Sci 2020, 9 (2), 103–104. https://doi.org/10.1016/j.jshs.2020.02.001.
(455) Guo, Y.; Shi, H.; Yu, D.; Qiu, P. Health Benefits of Traditional Chinese Sports and Physical Activity for Older Adults: A Systematic Review of Evidence. J Sport Health Sci 2016, 5 (3), 270–280. https://doi.org/10.1016/j.jshs.2016.07.002.
(456) Cohen, S. Psychological Stress and Susceptibility to Upper Respiratory Infections. Am. J. Respir. Crit. Care Med. 1995, 152 (4 Pt 2), S53-58. https://doi.org/10.1164/ajrccm/152.4_Pt_2.S53.
(457) Kilpeläinen, M.; Koskenvuo, M.; Helenius, H.; Terho, E. O. Stressful Life Events Promote the Manifestation of Asthma and Atopic Diseases. Clin. Exp. Allergy 2002, 32 (2), 256–263.
(458) Heffner, K. L.; Kiecolt-Glaser, J. K.; Glaser, R.; Malarkey, W. B.; Marshall, G. D. Stress and Anxiety Effects on Positive Skin Test Responses in Young Adults with Allergic Rhinitis. Ann. Allergy Asthma Immunol. 2014, 113 (1), 13–18. https://doi.org/10.1016/j.anai.2014.03.008.
(459) Luo, H.; Wei, J.; Yasin, Y.; Wu, S. J.; Barszczyk, A.; Feng, Z.-P.; Lee, K. Stress Determined through Heart Rate Variability Predicts Immune Function. Neuroimmunomodulation 2019, 26 (4), 167–173. https://doi.org/10.1159/000500863.
(460) Cohen, S.; Tyrrell, D. A.; Smith, A. P. Psychological Stress and Susceptibility to the Common Cold. N. Engl. J. Med. 1991, 325 (9), 606–612. https://doi.org/10.1056/NEJM199108293250903.
(461) Stover, C. M. Mechanisms of Stress-Mediated Modulation of Upper and Lower Respiratory Tract Infections. Adv. Exp. Med. Biol. 2016, 874, 215–223. https://doi.org/10.1007/978-3-319-20215-0_10.
(462) Turner-Cobb, J. M.; Rixon, L.; Jessop, D. S. Hypothalamic-Pituitary-Adrenal Axis Activity and Upper Respiratory Tract Infection in Young Children Transitioning to Primary School. Psychopharmacology (Berl.) 2011, 214 (1), 309–317. https://doi.org/10.1007/s00213-010-1965-x.
(463) Wieduwild, E.; Girard-Madoux, M. J.; Quatrini, L.; Laprie, C.; Chasson, L.; Rossignol, R.; Bernat, C.; Guia, S.; Ugolini, S. Β2-Adrenergic Signals Downregulate the Innate Immune Response and Reduce Host Resistance to Viral Infection. J. Exp. Med. 2020, 217 (4). https://doi.org/10.1084/jem.20190554.
(464) Cohen, S.; Alper, C. M.; Doyle, W. J.; Treanor, J. J.; Turner, R. B. Positive Emotional Style Predicts Resistance to Illness after Experimental Exposure to Rhinovirus or Influenza a Virus. Psychosom Med 2006, 68 (6), 809–815. https://doi.org/10.1097/01.psy.0000245867.92364.3c.
(465) Barrett, B.; Hayney, M. S.; Muller, D.; Rakel, D.; Brown, R.; Zgierska, A. E.; Barlow, S.; Hayer, S.; Barnet, J. H.; Torres, E. R.; Coe, C. L. Meditation or Exercise for Preventing Acute Respiratory Infection (MEPARI-2): A Randomized Controlled Trial. PLoS ONE 2018, 13 (6), e0197778. https://doi.org/10.1371/journal.pone.0197778.
(466) Zgierska, A.; Obasi, C. N.; Brown, R.; Ewers, T.; Muller, D.; Gassman, M.; Barlow, S.; Barrett, B. Randomized Controlled Trial of Mindfulness Meditation and Exercise for the Prevention of Acute Respiratory Infection: Possible Mechanisms of Action. Evid Based Complement Alternat Med 2013, 2013, 952716. https://doi.org/10.1155/2013/952716.
(467) Lippi, G.; Henry, B. M. Active Smoking Is Not Associated with Severity of Coronavirus Disease 2019 (COVID-19). Eur. J. Intern. Med. 2020. https://doi.org/10.1016/j.ejim.2020.03.014.
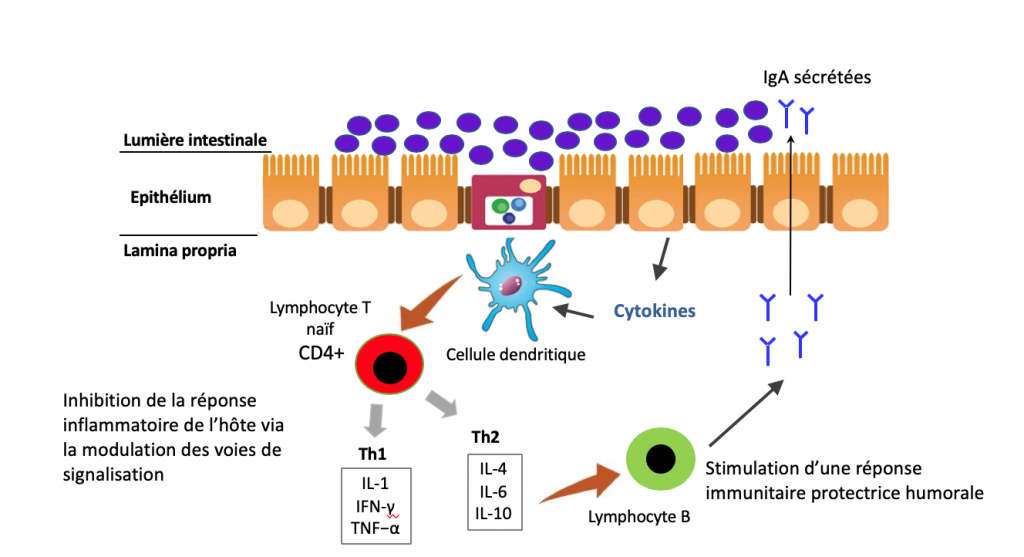



Bonjour
très bon article qui conforte ce qui je présentais. j’essaie d’avoir une hygiène de vie saine et naturelle, comptant sur la bonne santé de mon système immunitaire.( hopefully).
pardonnez le manque de rédaction dans le texte ci dessous, qui vous suite à des interrogations sur la lutte globale contre ce virus.
pour rebondir sur votre article qui préconise une hygiène de vie saine. Des mesures de confinement mal gérées seraient contre productives à bien des égards ( exemple le confinement va priver les français de vitamine D à la fin de l’hiver …).
2ème point sur l’après confinement : je ne suis pas médecin, j’espère parfois me tromper mais je me pose tout simplement des questions :
le confinement est nécessaire à ce stade (vu que nos institutions n’ont pas su anticiper …), mais je pense qu’il faudra bien passer par une immunisation des personnes “non à risques”, progressivement,
En effet ce virus présente de nombreuse caractéristiques :
est très contagieux,
son temps d’incubation sans symptômes est long(14 jours);
beaucoup de personnes ne présentent pas de symptômes ou des symptômes non discriminants( type rhume …),
phénomène des porteurs sains ( personne hébergeant le virus de manière permanente et pouvant le diffuser périodiquement ,
Toutes ces caractéristiques expliquent la difficulté de l’éradiquer. Surtout maintenant que c’est mondial.
de plus, il faudrait qu’il soit éradiqué dans tous les pays à un instant t pour être sûr qu’il ne réapparaisse pas demain. ce qui est très difficile compte tenu de la mondialisation et de l’état de pauvreté de certains états. Autant dire la vérité aux gens, ce virus risque de perdurer toute notre vie, sinon de l’abréger…
l’immunisation des personnes non à risques me parait la seule solution viable.
et encore, ce ne serait que une solution partielle car ce virus pourrait muter et nous n’en savons rien pour l’instant. mais c’est possible puisque c’est un virus comme le rhume et la grippe. ( ils mutent tout le temps) .
Heureusement, la mutation n’en fait pas des nouveaux virus et la plupart du temps , notre système immunitaire les reconnait et arrivent à les combattre plutôt bien. mais pas toujours voir grippe espagnole.
L’espoir réside aussi dans un vaccin même imparfait qui pourrait s’appliquer aux personnes fragiles.
en tant qu’expert, qu’en pensez vous ?
merci
bien cordialement
Tout à fait d’accord ……
Bonjour,
J’ai lu avec beaucoup d’intérêt votre article, non seulement en raison de la crise sanitaire que nous vivons mais pour aussi comprendre et trouver des solutions à un problème de santé récurent chez mon mari. Aucun médecin n’a jusqu’à présent trouvé de solution. Je lis actuellement le livre de Guilia Enders le charme discret de l’intestin, votre article fait écho à ma lecture.
A votre connaissance existe-t-il un médecin, un centre médical à même d’envisager un problème de santé sous l’angle que vous exposez si bien ?
Merci pour votre aide.
Bonjour,
ESSAYER AVEC LE PROFESSEUR HENRY JOYEUX , sinon je peux vous donner d’autres possibilités et BON COURAGE de la part de jean-luc BRUNIE SUR FACEBOOK
Excellent article
Merci pour le partage
Le don n’est pas toujours de l’argent
La connaissance (que vous donnez) est, dans la plupart du temps, plus importante qu’un don d’argent
Continuez comme ça et que Dieu vous préserve
Merci
Soit livrer son corps à un système de santé palliatif dont les capacités techniques ne sont pas infinies, soit prendre en main sa nutrition et son système immunitaire.
C’est trop long, c’est trop compliqué ? Souvenez-vous des 256 pages et de la complexité du Code de la Route…
Merci pour cet article très pointu et précis.
Merci infiniment pour ce travail colossal et pour toutes ces informations très utiles.
Bonjour et merci beaucoup!!!!
Un peu “TROP ” technique quelques fois (pour moi) mais tellement intéressant, alors un grand merci.
Absolument magnifique Anthony. Merci pour tout ce travail, merci pour ce partage… Une bible à lui tout seul cet article. Prend soin de toi
merci merci merci….
bonjour une petite question il est dit qu il faut éviter les anti inflammatoires natuels tel que reine des prés saule h.e de gaultherie extrait curcuma …qu en est il de la bromelaine?? et la serrapeptase…….?? merci..
trés cordialement
Bonjour,
Tout dépend des principes actifs : aucun problème pour le curcuma et la bromelaïne. Pour les HE de gaultherie, reine des près, saule, je ne suis pas expert sur le sujet mais la prudence me semble de mise. Pour la serrapeptase, aucun problème
Merci pour cet article, ce travail que vous avez fait de regroupement et de recoupement pour nous tous, pour qu’on devienne un peu plus maîtres à bord de notre vaisseau corporel ;-).
Belle et bonne vie à vous Anthony !
Merci pour ce travail riche de conseils dans un domaine peu courant
Bonjour,
Merci beaucoup pour votre article. Une question sur le dioxyde de titane E171 dans les cosmétiques :
C’est l’ingrédient utilisé systématiquement dans les crèmes solaires minérales et biologiques. Personnellement je ne tolère pas les crèmes solaires à filtre chimique.
Donc je suis embêtée parce ce que vous en dites. Pouvez-vous m’en dire plus à ce sujet ?
Non, des crèmes sans dioxyde de titane existent : il suffit de lire les étiquettes!
Exemple : marque GAMARDE.
Bonne journée et surtout bon confinement.
bonjour Leïla,
Le dioxyde de titane fait partie des composés pouvant augmenter l’hyperperméabilité intestinale.
Bonjour
Vous devriez faire part de tout votre savoir à des personnes compétentes ou responsables comme Mr. Salomon (directeur général de la santé).
Pour des profanes comme la plus part d’entre nous,vos explications et votre vocabulaire sont du “chinois” qui nous apportent rien de concluant. tout ce qui est compréhensible dans votre lettre ce sont vos explications pour commander vos produits où vous n’avez aucun intérêt (comme l’air que nous respirons).
En espérant que vos dires soient entérinés par les “savants” de notre médecine et nous aident à combattre ce virus.
Salutations.
Claude
Puis-je avoir une copie pdf de votre article ? Moyennant cotisation, bien entendu.
A la suite de votre énorme travail de synthèse, je pourrais conseiller une gymnastique douce, mais énergique, dispensée dans le livre de Bernadette de Gasquet (je n’y ai aucun intérêt !) :
“Mon programme coaching sans dégâts”.
Impresionnant en savoir et possibilité et donnant le profil d’une toute autre société et rapport au monde.
Merci à vous pour la part de travail qui reste insividuel et au travail d’appropriation et et de choix!
J’ai une vie de DÉFRICHAGE” EN TANT QUE PSYCHANALYSTE PROCHE MAIS MOINS IMPRESSIONNANTE ! ENCORE MERCI POUR L’OPÉRABILITÉ ET LE TRANSISSIONS POSSIBLE À L’ENTOURAGE , ENFANTS, PETITS ENFANTS ET LES GENS!
Vous avez raison c’est documents sont parfaits bravo!
Merci pour cet article d’une immense qualité!
Je poste un deuxième commentaire : Martine je parle de crèmes solaires, je suis allée vérifier la marque Gamarde que vous citez, il y a du dioxyde de titane dedans.
Anthony, si vous avez une réponse à formuler à mon premier commentaire sur le problème du dioxyde de titane dans les cosmétiques. Merci
Article passionnant. Bravo pour tout ce travail de recherche et de restitution !
Bonjour, tout d’abord je vous remercie pour cet article; c’est ce que j’ai trouvé de mieux pour m’informer. Je sais que je vais vous en demander beaucoup mais je suis vraiment perdue et démunie!!!! J’ai un épanchement de synovie du à de l’arthrose précoce, depuis le début du confinement un médecin m’a informer qu’on ne pouvez pas faire une ponction, pas assez de liquide mais il me propose une infiltration de cortisone, cela ne m’enchante pas vraiment!!! Je fais des cataplasmes d’argile plusieurs fois par jour. Je cherche des solution mais chaque huile essentielle efficace est anti inflammatoire donc déconseillé. J’allais me tourner ver l’aloe véra et idem. J’ai arrêté ma cure d’harpagophytum. J’ai suspendu toute activité physique et je craque…Si vous avez quelques solutions à me proposer j’en serai ravie. Je vous remercie d’avance d’avoir pris de votre temps. Prenez soin de vous. Cordialement,
Ariane
Bonjour Anthony et merci pour vos articles très intéressants.
Je voudrais avoir votre avis sur les pâtes au konjak et à l’avoine.
J’essaie de privilégier une alimentation à index glycérique faible.
Je commande ces pâtes chez LIV Happy food.
Merci de me donner un avis éclairé.
Bonne journée
Bonjour Anthony,
Bravo pour ce travail de synthèse particulièrement abouti (467 références scientifiques !)
Je me permet de partager le lien avec les coachs du réseau WTS et je vais aussi l’insérer dans l’article que j’ai écris récemment :
https://www.wts.fr/coronavirus-et-sport-comment-adapter-son-entrainement-en-periode-de-coronavirus/
Sportivement,
Un grand merci de nous avoir offert cet article incroyablement complet!
Merci pour cet ENORME travail de synthèse ! GREAT !
Wahou, quel travail cet article ! Hyper riche et documenté
Merci pour ces recommandations générales pour une bonne santé et donc une meilleure immunité.
Intéressant mais je rajouterais d’éviter aussi les aliments contenant trop de purine, responsable de la goutte et les aliments avec trop de fructose épuisant le foie.
Dans votre liste selon mes convictions personnelles j’éviterai le thé vert que j’aime en temps normal, la glutamine que je prends souvent en faisant du sport et les algues séchées.
Je mangerais plus des aliments frais,les plus frais possibles, pas trop conservés, trop cuits, séchés ou brulés.
Quel travail immense
et quel dévouement pour cette collecte et cette synthèse de vos recherches.
Sans être pro, on arrive à comprendre l’essentiel.
Merci pour tout, tous, nous.
Félicitations pour cet excellent article de synthèse…tout à fait digne d’une revue scientifique.
Un Grand Merci Anthony,
pour ce Beau Travail à travers lequel vous diffusez une Information Santé de Qualité,
donnant à chacun les clés de compréhension pour raisonner,
et retrouver le libre-arbitre de sa Santé.
La Pandémie est une véritable opportunité pour que chaque personne réalise l’importance d’une information de qualité pour se soigner avec justesse et efficacité.
Vous êtes doué nous faire plonger dans le fonctionnement de la cellule mais aussi pour donner des conseils concrets à appliquer dès maintenant.
Selon son cas particulier, chacun saura piocher l’info dont il a besoin pour avancer,
et si nécessaire entreprendre un travail en Micronutrition, pour une prise en charge précise, biologie à l’appui !
Merci pour tout : le temps passé à Etudier et à retransmettre…
A bientôt,
Dr Aurélie Lun
http://www.nutritionsanteglobale.com
Merci pour article ! Bonnne journée à toi 🙂