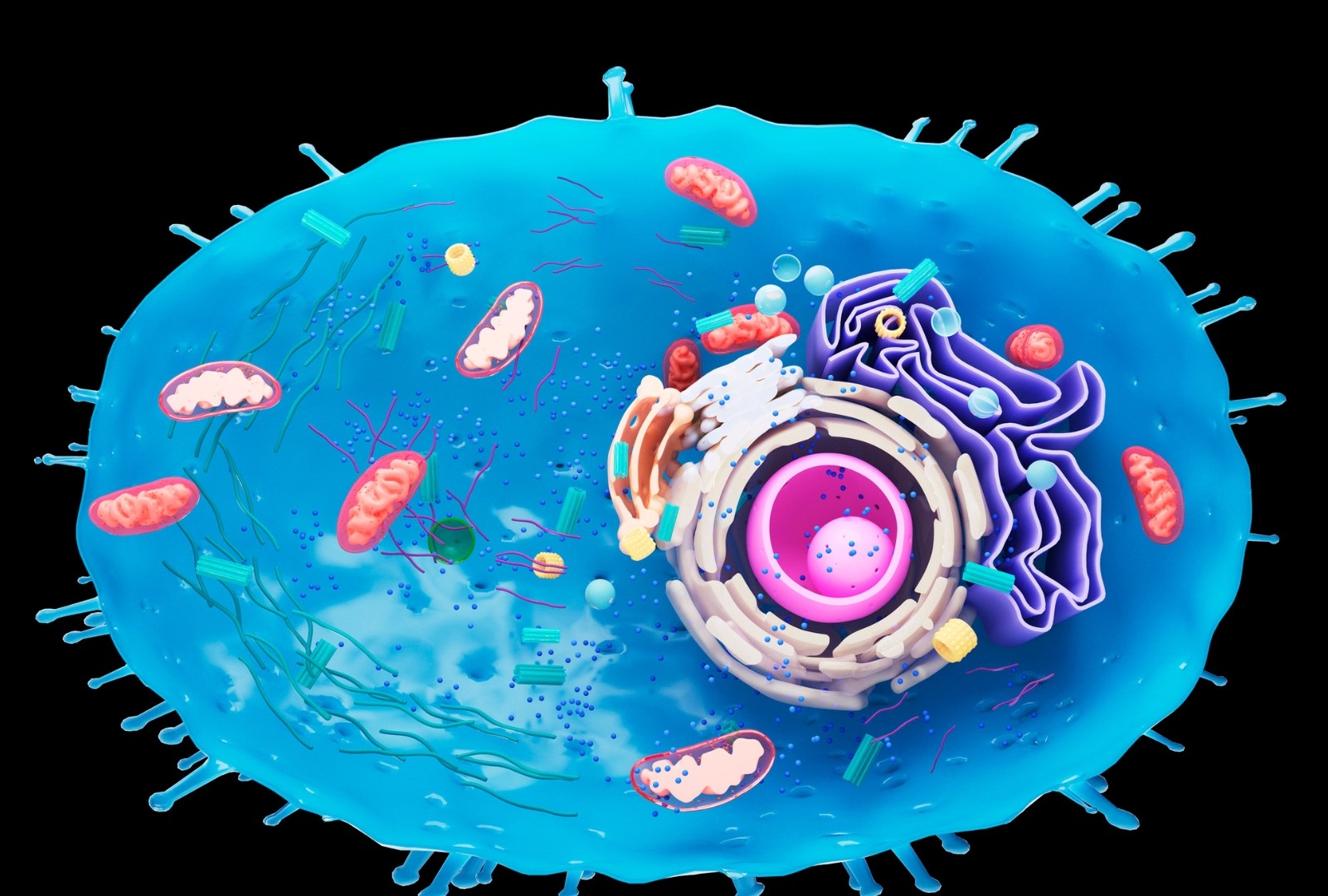
Les mitochondries sont vos centrales nucléaires en charge de transformer les nutriments en ATP, l’unité énergétique utilisée par vos cellules, grâce à l’oxygène1. Il s’agit de petites structures ovoïdes présentes dans le cytoplasme de la cellule et au fonctionnement autonome. Alors que la plupart des organismes unicellulaires ne possèdent qu’une mitochondrie, une seule cellule du foie humain en contient quant à elle plusieurs milliers. En moyenne, les cellules en possèdent chacune 300 à 400. Seuls les globules rouges en sont dépourvus. Et les centaines de milliards de cellules ne sont pas de trop pour produire, tenez-vous bien, plus de 6 kg d’ATP par jour rien que pour le cerveau humain ! Un seul neurone consomme (au repos) pas moins de 4,7 milliards de molécules d’ATP chaque seconde2.
La mitochondrie est par ailleurs le seul organite disposant de son propre ADN, différent de celui qui code chacune de toutes les autres protéines de l’organisme, transmis par la mère et originellement issue d’une bactérie. Vous avez bien lu. Il y a environ 2 milliards d’années, une cellule a en effet englouti une bactérie qui, au lieu d’être détruite, s’est développée en symbiose pour donner naissance à cet organite si particulier qu’est la mitochondrie. Cette spécificité génétique lui permet de fonctionner de manière autonome mais la rend également plus fragile aux mutations génétiques, 10 à 20 fois plus fréquentes que celui de l’ADN du noyau. On parle alors de maladie mitochondriale ou de mitochondropathie.
Le processus de fabrication d’ATP à partir de l’oxygène (et d’ADP) se réalise grâce à un extraordinaire ensemble de réactions enzymatiques et de transport d’électrons entre les deux membranes de la mitochondrie (cette double membrane est issue de la fusion de la cellule originelle et de la bactérie). C’est ce que l’on appelle la chaîne respiratoire mitochondriale (CRM). Au-delà de la production d’énergie, ces transferts d’électrons sont également au cœur de la régulation du stress oxydatif. La mitochondrie est en effet un générateur important de radicaux libres, ce qui apparait totalement logique puisque c’est elle qui utilise l’oxygène. Toutefois, il en résulte également un jeu dit d’oxydo-réduction entre les différents composés intervenant dans le contrôle du stress oxydatif. Pour faire simple, des mitochondries en bonne santé sont en mesure de renforcer le système de protection des cellules contre le stress oxydatif alors qu’elles l’amenuisent si elles dysfonctionnement. Il s’en suit alors des dommages oxydatifs majeurs, accélérant le vieillissement cellulaire. Ce qui nous permet d’aborder un autre rôle essentiel des mitochondries.
Ces petits organites ovoïdes assurent la fonction de régulateurs de l’horloge interne de la cellule. Ce sont en effet elles qui peuvent décider d’initier la mort prématurée d’une cellule si elles estiment que celle-ci n’est plus en mesure d’assurer ses fonctions. Il s’agit de l’apoptose, dont l’objectif est de permettre à une nouvelle cellule, celle-ci en pleine forme, de prendre le relais. Si toutefois les mitochondries sont altérées, notamment du fait d’un stress oxydatif majeur, ce renouvellement cellulaire est remplacé par une mort cellulaire prématurée. Dans le cas de l’apoptose, les macrophages du système immunitaire vont jouer leur rôle d’éboueurs en engloutissant les résidus cellulaires, sans laisser de traces, au risque le cas échéant d’alerter leurs acolytes du système immunitaire et de déclencher une réponse inflammatoire. Lorsque la cellule meurt de manière anormale, la réaction inflammatoire a bel et bien lieu car le contenu de la cellule se retrouve disséminé dans l’environnement du tissu. L’inflammation est donc initiée. Tout est une question de dosage du stress mitochondrial. Si celui-ci reste mineur et positif, la mitochondrie active sa fusion avec l’une de ses consœurs et va initier de nouvelles mitochondries. La cellule dispose ainsi de mitochondries plus efficaces et plus nombreuses, c’est le principe dit de biogénèse mitochondriale. Si, toutefois le stress est trop important, la mitochondrie se concentre sur sa propre réparation et ses fonctions essentielles (mitophagie) dans l’objectif de ramener au plus vite la cellule à un état d’équilibre (principe d’homéostasie). Cette notion de quantification du stress est déterminante car elle est à la base de l’évolution de la vie. Il s’agit du principe dit d’hormèse que je vous invite vivement à découvrir dans l’article dédié. Les mitochondries sont en effet au cœur de l’hormèse. Il existe d’ailleurs un terme spécifique utilisé pour qualifier son effet sur le fonctionnement mitochondrial, la mitohormèse.
Les mitochondries exercent encore d’autres fonctions, comme la synthèse de neuromédiateurs (monoamines), d’hormones stéroïdiennes à partir du cholestérol ou encore la production de chaleur par le tissu adipeux dit brun. Un bébé prématuré doit par exemple être placé dans une couveuse car il ne dispose pas suffisamment de ce tissu adipeux fonctionnel, les mitochondries n’apparaissant surtout qu’au cours des trois derniers mois de grossesse dans celui-ci.
La dose fait le poison
Cette expression bien connue pourrait trouver son origine 120 ans avant Jésus-Christ. Cette année-là, le roi du pont (aujourd’hui la Turquie) Mithridate V organisa un somptueux banquet au cours duquel il fut empoisonné. Son fils ainé, craignant que sa mère lui préparât le même sort, s’exila pendant 7 ans pour ingérer régulièrement de petites doses de poisons, convaincu qu’il deviendrait ainsi plus résistant à un empoisonnement potentiel. Il revint par la suite pour occuper le trône pendant les soixante années suivantes, tout en continuant de boire un cocktail de 54 composés toxiques, nommé pour l’occasion Antidotum Mithridaticum. Son peuple et la famille royale firent de même pendant les 1900 années suivantes…
Maladies de civilisation et mitochondries
En dehors des maladies d’origine génétique, il existe une myriade de troubles fonctionnels, depuis la simple fatigue jusqu’aux pathologies de civilisation, pouvant s’expliquer par une altération des fonctions mitochondriales ou issues de celles-ci. En d’autres termes, le dysfonctionnement des mitochondries peut être autant une cause qu’une conséquence d’un trouble. Au regard de la place centrale de leurs rôles sur la production d’énergie mais aussi sur la gestion du stress oxydatif et donc sur l’inflammation de bas-grade associée, la très grande majorité des maladies métaboliques et neurodégénératives voient leurs fonctions mitochondriales altérées3 : dysfonctionnement endothélial4, athérosclérose5-10, infarctus du myocarde11-13 (justifiant l’importance du pré-conditionnement que j’évoquerai dans la partie relative à l’hormèse14,15), l’hypertension artérielle16-18, l’insulino-résistance et le diabète de type 219-21, les maladies d’Alzheimer22-24 et de Parkinson25-29, la sclérose en plaques30,31, les maladies auto-immunes32-34 ou encore le cancer35-38. Je développerai par la suite les mécanismes dans les parties concernées. Bien entendu, l’hygiène de vie (ce que nous mangeons, la façon dont nous bougeons, dormons ou gérons nos émotions) module cette réponse, au même titre que l’environnement dans lequel nous évoluons.
Comment prendre soin de vos mitochondries ?
1. Envisager la restriction calorique ou le régime cétogène
L’alimentation est un modulateur clé de l’hormèse mitochondriale, notamment le type de nutriments consommés et la quantité de calories consommées. Pour ces deux raisons, deux modèles alimentaires sont particulièrement mis en avant : la restriction calorique (ou jeûne intermittent, voire jeûne thérapeutique) et le régime cétogène.
La restriction calorique est un outil particulièrement puissant pour stimuler l’hormèse, notamment via notamment le principe dit d’autophagie. Il s’agit d’un processus initié par les cellules en cas de stress majeur, par exemple lors d’un jeûne ou d’une intoxication, et consistant à recycler plus efficacement les « déchets » issus de la dégradation des protéines cellulaires39-41. Le terme spécifique utilisé dans le cas de mitochondries la mitophagie42. C’est un mécanisme cellulaire complexe, dont le but final est de « forcer » l’adaptation en centrant la cellule sur ses fonctions vitales. Une réponse hormétique poussée à son paroxysme43-47. Au regard des bénéfices attendus et confirmés par de très nombreuses études sur le sujet, réalisées essentiellement in vitro ou chez l’animal (cancer, maladies neurodégénératives, diabète, obésité, infections, etc.)48-59, il peut facilement paraître séduisant de se lancer dans l’aventure. Attention toutefois, une telle décision nécessite d’être intégrée au contexte de chaque individu, notamment en fonction de votre capacité d’adaptation. Certes, la cellule dispose de pouvoirs incroyables de régénération et le jeûne est un moyen de la stimuler en ce sens. Néanmoins, tout dépend de la capacité de la cellule à revenir à son état d’homéostasie. Des états nutritionnels fortement dégradés comme une dénutrition protéique observée notamment chez certaines personnes âgées, l’existence de pathologies importantes ou encore un état d’épuisement avancé traduisent une faible amplitude d’adaptation face à un tel stress. C’est pourquoi la décision de pratiquer un jeûne thérapeutique de longue durée, pouvant s’étendre parfois sur plus de trois semaines, doit être prise de concert avec un professionnel de santé spécialisé dans cette pratique. La vérité se trouvant souvent dans le principe d’homéostasie, une pratique fait de plus en plus parler d’elle : le jeûne intermittent ou la restriction calorique60-64. Ces phases d’absence de prise alimentaire permettent en effet de stimuler le processus d’autophagie, mais de manière plus modérée et plus douce qu’un jeûne thérapeutique65. Bien équilibré sur le reste de la journée, des habitudes alimentaires incluant ces périodes de jeûne, pouvant durant 15 à 16h toutes les 24h ou pendant 24h une à deux fois par semaine, permettent de renforcer l’activité mitochondriale. A l’inverse, l’excès calorique diminue l’adaptation mitochondriale66. Le respect du rythme circadien est toutefois à considérer67,68. Il est en effet plus indiqué de débuter le jeûne en soirée pour le terminer le lendemain midi, plutôt que de jeûner tout au long de la journée. En clair, mieux vaut supprimer le dîner (ou souper) que le petit déjeuner.
En privant l’organisme d’une grande majorité des apports glucidiques, le régime cétogène est à l’origine d’une production importante de corps cétoniques, en particulier le β-OHB. Au-delà de son effet protecteur contre les dommages oxydatifs, ce composé est reconnu pour stimuler l’activité et le nombre de mitochondries. Par ailleurs, le β-OHB possédant la capacité à traverser la barrière hémato-encéphalique, il s’avère particulièrement efficace sur l’activité des mitochondries neuronales. Pour cette raison, il peut être conseillé dans le cas de maladies neurodégénératives ou de troubles tels que l’épilepsie. Le jeûne, s’il est prolongé au-delà de 15 à 24h (la durée étant variable selon l’état des réserves initiales en glycogène), est un autre moyen d’orienter le métabolisme de l’organisme vers la production de corps cétoniques. Toutefois, alors que le régime cétogène maintient un apport de calories via les graisses et les protéines, le jeûne consiste par définition à supprimer totalement toute source calorique. Il en résulte alors une production bien plus importante de β-OHB, qui a tendance à acidifier fortement l’organisme. C’est une des raisons pour lesquelles le jeûne ne peut perdurer au-delà de quelques jours (voire quelques semaines selon les individus et avec l’accompagnement d’un professionnel), à la différence du régime cétogène. Attention, ce dernier n’est pas dénué de conséquences et nécessite donc certaines précautions pour pouvoir être maintenu pendant plusieurs mois (voir article dédié).
2. Limitez la charge glycémique
Les mitochondries sont protégées du stress oxydatif issus des produits de la glycation par des composés spécifiques dits dicarbonyles. Or, pour certains auteurs, les dommages causés par la glycation du dicarbonyle pourraient représenter un point d’initiation au dysfonctionnement mitochondrial, donc à l’amplification du stress oxydatif69,70. Ainsi, au-delà de favoriser une alimentation riche en antioxydants, la limitation des variations de glycémie au cours de la journée représente un axe de préservation de l’intégrité des mitochondries. Je vous conseille donc de vous reporter aux conseils relatifs à la charge glycémique.
3. Renforcez votre statut en antioxydants
La plupart des antioxydants sont de puissants modulateurs mitochondriaux, en particulier les composés phénoliques ou polyphénols. Leurs propriétés sont d’ailleurs dû à leurs effets « stresseurs » vis-à-vis des mitochondries. Produits par les plants pour se défendre des agressions d’insectes ou de micro-organismes71,72, ces antioxydants renforcent le système de protection des cellules de l’organisme contre les dommages oxydatifs73. Les flavonoïdes représentent la catégorie d’antioxydants la plus puissante en ce sens, à l’image de la quercétine présente dans les pommes, l’oignon ou encore le thé74-76, de l’EGCG du thé vert77-80, le sulforaphane issu des crucifères, la curcumine du curcuma81, le kaempférol des fraises82, du trisulfure de diallyle de l’ail ou encore du resvératrol contenu dans les petites baies foncées comme le raisin83. Ce composé de la grande famille des polyphénols est considéré comme un puissant protecteur mitochondrial84-86. Une des principales propriétés du resvératrol est sa capacité à moduler in vitro et chez le rongeur le potentiel redox des mitochondries en interagissant avec l’enzyme SOD87,88. Alors plus efficace, cette dernière réduit le niveau de stress oxydatif. Le resvératrol stimule par ailleurs la biogénèse mitochondriale en activant les sirtuines (SIRT1), PGC-alpha et le processus d’autophagie89-92. De nombreuses études animales ont mis en évidence un bénéfice de l’apport de resvératrol sur les fonctions mitochondriales, par exemple dans le cas de la maladie d’Alzheimer93-96, de Parkinson97-99, de Huttington100 ou de Charcot101. Néanmoins, les bénéfices des essais cliniques menés chez l’homme sont insuffisants pour le considérer comme un antioxydant de référence. En effet, bien qu’il ait toute sa place dans un modèle santé et que les études montrent un effet positif sur l’activité des mitochondries, les paramètres cliniques analysés ne sont pas améliorés pour autant102,103. Toutefois, tous les polyphénols sont globalement bénéfiques. Par sa richesse en antioxydants, l’alimentation méditerranéenne représente une solution optimale également pour le pilier mitochondrial. Une étude menée auprès de 43 patients obèses dans le cadre de la cohorte PREDIMED a par exemple mis en évidence l’effet positif du régime méditerranéen sur la régulation des sirtuines104. Un modèle alimentaire spécifique associant les principes de l’alimentation méditerranéenne avec le régime cétogène, fait également l’objet d’attentions particulières ces dernières années. Son objectif est en effet séduisant sur le papier dans la mesure où il concilie les bénéfices du régime cétogène et d’une partie de l’alimentation méditerranéenne, par exemple dans le cas de la maladie de Charcot105. Les publications sont toutefois peu nombreuses à ce jour.
Privilégier des fruits et légumes d’origine biologique et si possible de permaculture, en mangeant la peau si vous la tolérez, permet de renforcer leurs teneurs en polyphénols. Attention, le recours à des compléments alimentaires riches en antioxydants présents sous forme unitaire et à très forte dose peut exercer un effet hormétique délétère, notamment chez les personnes déjà sujettes à un stress oxydatif important106-109.
4. Attention aux contaminants
Au regard du rôle déterminant de la mitochondrie dans la survie cellulaire, il apparait logique que cet organite fasse partie des cibles potentielles de certains biocides dans l’objectif de limiter le développement de certains végétaux, champignons et autres êtres vivants. Même s’ils ne sont pas systématiquement reconnus, des liens sont bel et bien établis entre le développement de certaines pathologies et l’usage de pesticides par altération du fonctionnement mitochondrial chez l’homme. On peut ainsi citer le paraquat110, notamment impliqué dans l’augmentation des risques de maladie de Parkinson111-115, le tristement célèbre glyphosate116-122, le dicamba (utilisé depuis plus de 50 ans aux États-Unis, il serait selon certains médias considéré entre 75 et 400 fois plus puissant que le glyphosate et particulièrement volatile)123-125, le chlorpyrifos (désormais officiellement interdit dans l’Union Européenne mais toujours autorisé en France pour la semence des épinards et aux Etats-Unis)126-128, l’atrazine (interdit en Europe depuis 2004 mais fait encore partie des pesticides les plus utilisés dans le monde)129-132, le spinosad (pesticide autorisé en agriculture biologique)133,134, le roténone (interdit en Union Européenne et aux États-Unis sauf… en agriculture biologique dans la mesure où il provient initialement des plants de légumineuses135. On le retrouve également dans les bananes d’origine biologique importées)136,137, le trichlorfon (insecticide interdit en France et dans la plupart des pays. Il peut toutefois être retrouvé sous forme de préparations anti-poux pour le bétail aux États-Unis ou contre les chenilles)138-140 ou encore le fenpyroximate (plus de 50 pays l’utilisent)141-144. Il en est de même concernant certains fongicides145,146, à l’image du Ziram147-150.
Malheureusement, les habitations ne sont pas épargnées. Selon une étude française publiée en Juillet 2019 par l’équipe du Dr Béranger, sur la base de recherche de 276 pesticides, 125 ont été retrouvés dans les poussières intérieures, en ville comme à la campagne151.
Les composés perfluorés, présents notamment dans le téflon, font également partie des perturbateurs mitochondriaux152,153.
Les mitochondries sont également fragilisées par les excès de métaux lourds, notamment du mercure, du cadmium et du cuivre154. A très faible dose, ces cations exercent un léger effet pro-oxydatif plutôt favorable à l’activité des mitochondries via l’effet hormétique155. Le cuivre est également un cofacteur de deux enzymes à l’action antioxydante et présentes dans la mitochondrie (COX et SOD1). A l’inverse, un excès de cuivre est reconnu pour exercer un effet pro-oxydatif majeur au sein de la mitochondrie156,157, il s’agit d’ailleurs d’une des caractéristiques de la maladie de Wilson, une maladie génétique à l’origine d’une surcharge en cuivre dans le foie et dans le cerveau158,159. Le mercure, présent en grande quantité dans les amalgames dentaires, est également bien connu pour épuiser les réserves en glutathion réduit et, de ce fait, favoriser le stress oxydatif. Il est également à l’origine d’un épuisement des réserves en sélénium pourtant essentiel au bon fonctionnement des enzymes antioxydantes160. Le mercure apparait donc particulièrement délétère pour les mitochondries, notamment au niveau rénal161,162. L’aluminium et ses adjuvants sont amplement pointés du doigt comme de potentiels responsables de l’atteinte mitochondriale neuronale (mais aussi hépatique et cardiaque), en particulier quand ils sont utilisés sous forme de nanoparticules163-166. Une telle action explique en partie son implication dans le développement de maladies neurodégénératives, notamment d’Alzheimer167,168. Le cadmium et l’arsenic inorganique sont également à rajouter sur la liste169-172.
Les additifs ne sont pas en reste, à l’image du sorbate de potassium et de l’aspartam173,174 ou encore du polysorbate 80175. Il en est de même concernant les contaminants : phtalates176,177, bisphénols A178-181 et S182, dioxines183,184,182 ou encore PCB185,186.
5. Alcool : avec modération
Pour faire simple, l’alcool est une molécule toxique pour les mitochondries187,188. Elles y sont en effet particulièrement sensibles dans la mesure où ce sont elles qui métabolisent l’acétaldéhyde (la molécule toxique issue de l’alcool) en acétate via une enzyme spécifique (ALDH). La forme activée de l’acétate, l’acétyl-CoA, peut alors servir à la synthèse de corps cétoniques et d’acides gras, expliquant d’ailleurs la prise de poids potentielle en cas de consommation importante189,190. Un des principaux mécanismes en jeu dans la toxicité de l’éthanol est son effet pro-oxydatif, notamment sur les mitochondries neuronales191, hépatiques et cardiaques191,192. Une consommation importante d’alcool initie alors un véritable cercle vicieux : l’éthanol favorise la production de radicaux libres à l’origine d’altérations des fonctions mitochondriales, qui génèrent elles-mêmes encore davantage de stress oxydatif. Il en résulte ainsi une perméabilité anormale des membranes mitochondriales qui deviennent plus sensibles aux autres toxiques potentiels. Ce processus amène progressivement à une augmentation des risques de mort neuronale. Les dommages mitochondriaux induits par l’alcool seraient particulièrement importants au cours de la vie intra-utérine193, mais aussi pendant l’adolescence194.
6. Bougez !
L’activité physique est également un excellent moyen de renforcer autant le nombre de mitochondries que leur efficacité195,196. Les adaptations varient selon la nature des fibres sollicitées et de l’effort réalisé, mais tout type d’activité est bénéfique, que ce soit en endurance, en résistance (exercice de force) ou en associant des périodes courtes à haute intensité (de type HIIT)197,198. Toutefois, le principe hormétique prévaut également en matière de pratique sportive. Une activité trop importante peut en effet apparaitre délétère pour vos mitochondries199. Elle permet par ailleurs de réduire la perte de masse musculaire induite par la restriction calorique chez les personnes âgées200. On peut donc conclure que, oui, faire du sport conserve… vos mitochondries !
7. Prenez soin de votre sommeil
Au même titre que vous, vos mitochondries ont besoin de profiter d’un bon sommeil récupérateur. La dette de sommeil altère les fonctions mitochondriales201 et la quantité de métabolites potentiellement neurotoxiques, notamment par l’intermédiaire du stress oxydatif203,203. Or, la mélatonine est une hormone qui, au-delà de réguler les cycles veille-sommeil204, possède également une très forte activité antioxydante. Elle est produite à 80% par la glande pinéale où elle exerce localement son effet de régulation sur le rythme circadien, mais elle est également synthétisée par les mitochondries pour y exercer un effet antioxydant au sein de nombreux tissus. Certains aliments en contiennent d’ailleurs de faibles quantités, à l’image du riz, des fruits (fraises, kiwis, pommes, ananas, bananes, etc.) ou encore des graines, mais elle est détruite par la chaleur. L’alimentation ne représente donc pas une source significative pour couvrir vos besoins.
En cas de difficulté d’endormissement ou de décalage horaire (jetlag), une supplémentation de mélatonine à hauteur de 2 à 3 mg par jour a démontré de légers bénéfices. Elle est à prendre environ 1h avant le coucher. L’usage de la mélatonine est autorisé en complément alimentaires dans des dosages inférieurs à 2mg/j, elle est considérée comme médicament au cas d’apports plus élevés.
En cas de douleurs de type neuropathique, la mélatonine peut diminuer la fréquence et l’intensité des syndromes douloureux, y compris en cas de migraines205,206. Les dosages utilisés sont alors différents de ceux indiqués contre les troubles de l’endormissement, à savoir au moins de 5 à 10mg/j207.
En cas de pathologie inflammatoire ou immunitaire chronique, la mélatonine exercerait un rôle immunitaire « tampon », à savoir plutôt de type anti-inflammatoire en cas d’inflammation aigue exacerbée et, à l’inverse, des effets de stimulation immunitaire en cas d’immunosuppression ou de maladie auto-immune208. Elle serait donc à éviter en cas de polyarthrite rhumatoïde, de lupus ou de diabète de type 1. Dans le cadre des maladies neurodégénératives, elle apparait plutôt régulatrice de l’inflammation de bas-grade209, sauf lorsque la pathologie est présente à un stade avancé (de maladie d’Alzheimer par exemple) dans laquelle elle initierait plutôt un cercle vicieux. Les résultats dans le cas de la sclérose en plaques sont hétérogènes, notamment en fonction de l’existence d’autres facteurs inflammatoires et des effets multiples de la mélatonine. Les protocoles expérimentaux incluent parfois des doses de 300 mg/j dans le cas de maladies neurodégénératives lourdes comme la maladie de Charcot pendant 2 ans, sans pour autant que des effets secondaires soient constatés210.
Il n’a pas été démontré de risques de dépendance ou de sevrage à l’arrêt, contrairement aux somnifères. La mélatonine est très bien assimilée211. Lipophile, elle est à consommer plutôt avec des aliments gras mais pauvres en glucose et en protéines. Il existe des formes spécifiques de mélatonine, par exemple à prendre en sublingual pour favoriser son assimilation en shuntant le circuit digestif. Certains laboratoires proposent également des formes dites retards ou prolongées. La durée de demi-vie de la mélatonine étant courte et très variable selon les individus212, cette forme galénique permet de libérer progressivement la mélatonine213,214, dont le pic de production se déroule normalement entre 2 et 4h du matin215,216.
8. Prenez soin de vos émotions
Sans surprise, le stress psychologique interagit avec l’activité mitochondriale. La mitochondrie peut être considérée comme une cible mais aussi comme un médiateur du stress217. Selon le principe de l’hormèse, un faible niveau de stress, positif ou négatif, génère un mécanisme d’adaptation à cette situation pour mieux y faire face par la suite218. A l’inverse, en cas de dysfonctionnement mitochondrial initial, un stress important pourrait orienter l’organisme vers un processus pathologique219,220. Par ailleurs, que le stress aigu augmente les fonctions mitochondriales apparait cohérent dans la mesure où les hormones produites pendant cette période ont pour objectif de lutter ou de fuir, le besoin en énergie est alors accru. Certaines hormones stéroïdes comme le cortisol sont d’ailleurs produites par les mitochondries221,222. Plusieurs études ont également mis en évidence des dysfonctionnements mitochondriaux chez les personnes souffrant de troubles psychiatriques223,224. Même s’il ne s’agit pas de l’origine du trouble, une altération de leurs fonctions détériore les fonctions synaptiques et peut donc contribuer à l’augmentation des symptômes à long terme225 en accentuant la neuro-inflammation220,226,227,228. Il existe par ailleurs des atteintes spécifiques de neuromédiateurs en fonction du mécanisme à l’origine de l’altération mitochondriale229. Cette dernière pourrait par ailleurs contribuer au processus de perte des capacités intellectuelles dans le cadre de pathologies comme l’autisme ou la trisomie 21230. La pratique de techniques de gestion du stress peut avoir des effets positifs sur les fonctions corporelles en quelques minutes. Pratiquées régulièrement, ces techniques régulent à la hausse les gènes réduisant les dommages oxydatifs et à la baisse ceux favorisant l’inflammation tout en soutenant la production d’ATP231. Les études menées chez l’homme et les essais cliniques de qualité permettant d’établir un lien entre le stress chronique ou les troubles psychiatriques et les fonctions mitochondriales sont toutefois encore peu nombreux. Les études disponibles présentent souvent des limites méthodologiques, notamment l’impossibilité de mesurer l’activité mitochondriale cérébrale de manière spécifique. Il s’agirait donc, pour certains auteurs, d’une conséquence davantage que d’une cause d’altération des mitochondries232.
9. Une petite douche froide ?
Connaissez-vous la thérapie par le froid et la méthode Wim Hof, également surnommé Ice-Man ? Il est devenu célèbre grâce à son extraordinaire capacité à résister au froid, en grimpant par exemple l’Everest jusqu’à 7400 m en short ou encore en restant plus d’une heure dans un tube rempli de glace. Pour réaliser de tels exploits, cet homme associe toutefois à l’exposition au froid des techniques de méditation et de respiration dont l’hyperventilation. Utiliser le froid pour guérir ne date pourtant pas d’hier. Le premier texte médical relatant les bienfaits de l’hypothermie daterait de 3500 ans avant J.C.233. Le principe consiste à faire baisser la température corporelle à 35 voire 32°C, pour diminuer l’irrigation sanguine et générer ainsi une hypoxie, soit un stress hormétique majeur. Il en résulte de nombreux bénéfices potentiels, comme l’activation mitochondriale, la diminution du stress oxydatif, la réduction de la perméabilité de la membrane hémato-encéphalique, la diminution du métabolisme de base ou encore un effet anticoagulant234-239. Cette méthode fait d’ailleurs partie des techniques documentées pour réduire les conséquences des arrêts cardiaques240,241, de l’hypoxie périnatale242-244 ou encore des traumatismes crâniens245-247. Il s’agit toutefois ici de situations d’urgence. Se pose alors la question de l’intérêt de créer un stress thermique chez les personnes en bonne santé. Plusieurs études menées in vitro concluent en un bénéfice de l’hypothermie lors d’infections génératrices de neuro-inflammations248 ou en cas de neurotoxicité249. Au regard des études menées chez l’animal, le cerveau apparait en effet particulièrement tolérant au choc thermique250-253, les effets secondaires répertoriés chez l’homme étant mineurs et dépendants du niveau de stress thermique, critique surtout en-dessous de 32°C. Les études animales ou in vitro sur des cellules neuronales humaines confirment l‘extraordinaire adaptabilité des mitochondries à l’hypothermie254-256. Cette propriété permet d’ailleurs à certaines populations de vivre en altitude avec des variations de disponibilité en oxygène257, par exemple tibétaines ou éthiopiennes258,259. L’augmentation de la production d’EPO tant convoitée par les sportifs réalisant des stages d’entraînement en altitude en est également une illustration parfaite260.
Au-delà de la restauration d’une fonction mitochondriale optimale par effet hormèse, le stress intermittent induit par le froid chez l’animal permet également d’augmenter le taux de tissu adipeux brun, à l’origine d’une dépense énergétique plus importante grâce aux mitochondries (du fait des frissons) parfois jusqu’à 80%261-263. Elle est associée à une meilleure combustion des graisses par augmentation du taux d’adiponectine, aux propriétés par ailleurs anti-inflammatoires264-266. Il en résulte également une augmentation de la stimulation immunitaire267 du fait d’une plus forte sensibilité de la réponse inflammatoire, en particulier neuronale268,269. La pratique d’un effort physique dans le froid représente d’ailleurs une solution optimale pour soutenir l’immunité si celui-ci est modéré et de courte durée (40min)270. Afin de crédibiliser sa démarche, Wim Hof a cherché à prouver l’efficacité de son protocole grâce à une publication dans la sérieuse revue PNAS en 2014. Les résultats apparaissent favorables de prime abord à l’amélioration du système immunitaire. Toutefois, la rigueur scientifique de cette étude est faible (échantillon de 24 personnes, uniquement des hommes, arrêt d’une partie d’entre eux, évaluation subjective des symptômes, absence de placebo, etc.). Par ailleurs, n’oublions pas que la méthode Ice-Man associe au froid de la méditation, dont les bénéfices sur l’immunité sont eux parfaitement bien établis271.
La mise en place d’une telle hygiène de vie n’a pas vocation à se faire de manière brutale, encore une fois le principe de l’hormèse prévaut. Un choc trop important peut générer un véritable choc physiologique à l’origine d’une augmentation de la fréquence cardio-respiratoire et de la tension artérielle, potentiellement mortel et connu sous l’expression de cold shock response272,273. L’adaptation doit donc être progressive. Vous pouvez commencer par laisser une partie de votre corps (par exemple vos pieds) sous l’eau froide lors de votre douche, avant de passer au corps entier au fil des jours et d’adapter la durée selon votre tolérance. Au bout de quelques semaines, les bains à l’eau froide, voire glacés pourraient être les prochaines étapes. Sur le long terme, cette exposition intermittente au froid ne serait pas dénuée d’effets délétères, comme par exemple une augmentation de la résistance à l’insuline chez le rat274. Toutefois, ces résultats sont issus de stress dont l’intensité est nullement reproductible chez l’homme, à l’image de souris laissées 6h par jour dans une eau à 4°C pendant 2 semaines275.
10. Connaissez-vous la lumière rouge proche infrarouge (NIR) ?
Savez-vous que vos mitochondries sont sensibles à la lumière rouge dite proche infrarouge (NIR) ? Il existe d’ailleurs une technique développée à partir de cette propriété, la photostimulation mitochondriale ou photobiomodulation. Elle reprend d’ailleurs le principe de la photosynthèse des plantes, consistant à absorber l’énergie issus des photons du spectre visible et invisible. Selon certaines études, des longueurs d’ondes spécifiques seraient en mesure d’initier ce mécanisme également au sein de cellules non photosynthétiques chez les mammifères276-283, l’objectif étant d’augmenter la production d’ATP284,285 et de stimuler l’hormèse mitochondriale286-289. Cette photosensibilité serait une propriété commune à tous les animaux, leur permettant de favoriser la production d’énergie à l’aube, période au cours de laquelle la lumière rouge-orange est la plus forte290,291. La lumière rouge et proche infrarouge agit sur une enzyme de la chaîne respiratoire mitochondriale jouant alors le rôle de photorécepteur, la cytochrome C oxydase292,293,286,294-300. Les cellules les plus réactives à cette thérapie semblent être les cellules cancéreuses, les fibroblastes et les cellules épithéliales, en particulier lorsqu’elles sont en phase de prolifération, donc en état pro-oxydatif301,302. Pour cette raison, les dermatologues et les chirurgiens font partie des spécialités médicales y ayant davantage recours, par exemple pour optimiser la qualité de la cicatrisation ou en cas de troubles de la pigmentation comme le vitiligo303-305. La pertinence de cette méthode reste débattue au sein de la communauté scientifique pour d’autres indications au regard des résultats souvent contradictoires. Cette méthode a pourtant fait l’objet de publications récentes concernant un bénéfice potentiel en cas d’atteintes cérébrales306, de maladie d’Alzheimer307, de traumatismes cérébraux308,309, de dépression310, de fractures311-313, de syndrome de Raynaud314, d’hypothyroïdies315-317, de douleurs chroniques318,319, de tendinopathies320, de troubles de la fertilité chez l’homme321,322 ou encore d’acné323. Pour faire simple, tous les troubles en lien avec un dysfonctionnement mitochondrial ! Attention, l’usage thérapeutique de ces ondes semble augmenter les besoins en caroténoïdes et en particulier en lycopène324. Par ailleurs, un échauffement supérieur à 39°C accroit de manière importante le stress oxydatif et doit donc être évité325,326. Des start-ups se lancent sur ce marché émergent pour proposer des appareils, à l’image de la société Cytoled.
Que penser des compléments alimentaires ?
Il n’existe pas de compléments alimentaires permettant d’augmenter l’activité mitochondriale en l’absence de déficit des micronutriments. Seule la restauration d’un statut optimal justifie le recours à une supplémentation. Tout dépend donc de votre situation personnelle et en particulier de votre niveau de protection antioxydante. La priorité est en effet de permettre à votre organisme de gérer positivement l’hormèse mitochondriale, donc le stress oxydatif associé aux sollicitations. Je ne peux donc que vous recommander de suivre en priorité l’ensemble des recommandations visant à renforcer vos apports en antioxydants (voir votre indice relatif au stress oxydatif et les conseils associés).
Voici mes recommandations par ordre de priorité :
1. Le Coenzyme Q10 : à hauteur de 300 mg/j minimum, voire 2400 mg/j selon les études et les indications. Cette supplémentation est prioritaire en cas d’antécédents cardiovasculaires327, notamment d’insuffisance cardiaque328-332, d’hypertension artérielle333-339, de myocardite340, d’infarctus du myocarde341-345 ou de prise de statines346-353. Attention, le coenzyme Q10 peut interagir avec des traitements anticoagulants du fait de sa structure biochimique proche de la vitamine K2, en particulier avec la warfarine354. D’autres études ne montrent néanmoins pas d’effets355. Dans le doute, ce paramètre devra être surveillé. Elle également indiquée en cas de diabète de type 2356-359, de maladie de Parkinson360-362, maladie d’Alzheimer363, maladie de Huntington364, ataxie de Friedreich365-367, sclérose en plaques368-371, fibromyalgie372,373, maladie de la Peyronie374,375 et troubles de la fertilité masculine376-379. Les personnes âgées, véganes et/ou sportives présentent un risque majoré de déficit. L’idéal est de réaliser un dosage sanguin en CoQ10 même si la fiabilité de ce dernier n’est pas totale. Pour en savoir davantage sur le CoQ10, je vous invite à découvrir votre indice correspond à ce micronutriments et l’article Comment choisir et bien utiliser votre complément alimentaire à base de CoQ10 ?
2. Le glutathion. Il s’agit sans aucun doute du principal antioxydant de la mitochondrie. Pour en savoir davantage sur la façon d’optimiser votre statut, je vous invite à découvrir l’article Comment choisir et bien utiliser votre complément alimentaire à base de glutathion ?
3. La vitamine D agit en tant qu’antioxydant protecteur de la mitochondrie380,381. Un déficit est d’ailleurs associé à une altération de la consommation d’oxygène et à un dysfonctionnement mitochondrial382-384. Cet effet serait attribué à une meilleure capacité de la mitochondrie à métaboliser les lipides en ATP385, la vitamine D3 étant considérée par certains scientifiques comme le « gardien » de l’activité de la chaîne respiratoire386,387. Elle semble également faciliter l’autophagie et le renouvellement mitochondrial388,389. Je vous invite donc à découvrir votre indice Vitamine D et les conseils associés Comment optimiser votre statut en vitamine D ?
4. Surveillez votre taux de fer. Savez-vous que les mitochondries sont les principaux organites en charge d’utiliser et d’accumuler le fer ? Dans les cellules du foie (de rongeurs), la concentration de fer disponible est par exemple deux fois plus concentrée au sein des mitochondries comparativement au cytosol390. Un tel mécanisme n’a rien du fruit du hasard. Le fer joue en effet un rôle de cofacteur des protéines dites fer-soufre nécessaires au bon fonctionnement de la chaîne respiratoire mitochondriale391. La capacité des cellules cancéreuses à concentrer davantage de fer dans leurs mitochondries (engendrant par voie de conséquence une déplétion en fer dans le cytosol) est d’ailleurs considérée comme un mécanisme potentiellement impliqué dans le développement tumoral392,393. 20% du fer cellulaire total de l’organisme ont par exemple été retrouvés dans des cellules tumorales pulmonaires394. Le fer est également indispensable à la synthèse de l’hème, qui dépend elle-même des mitochondries. Un manque de fer altère fortement le fonctionnement de ces organites, en diminuant notamment l’efficacité de la néoglucogénèse et en modifiant leur morphologie395,396. A l’inverse, l’excès de fer est à l’origine, non seulement d’une atteinte de l’ADN mitochondrial par le stress oxydatif majeur qu’il génère, mais également d’une baisse de production d’ATP397,398. L’hépcidine est une hormone régulatrice des flux de fer dans l’organisme particulièrement étudiée. Son métabolisme semble fortement impliqué dans la capacité des cellules à limiter la toxicité des excès de fer sur les mitochondries399. Je vous invite à découvrir votre indice Fer et les conseils associés Comment optimiser votre statut en Fer ?
5. L’acide alpha-lipoïque : entre 100 et 1200 mg/j selon les études et surtout votre portefeuille. Il s’agit en effet d’un complément alimentaire particulièrement onéreux, l’apport optimal étant d’au-moins 600mg/j400. Des cas de déficit primaire (atteinte mitochondriale d’origine génétique) ont été décrits lors d’épilepsie, d’hypotonie musculaire ou encore d’acidose lactique401. Une supplémentation de 600 mg d’acide R-alpha-lipoïque a amélioré de manière significative l’activité mitochondriale de patients atteints de maladie génétique. Les autres indications sont essentiellement le diabète pour son activité insulinomimétique402-405 et pour prévenir les complications du diabète, en particulier les rétinopathies, les neuropathies et autres maladies vasculaires406-408. Globalement, les bénéfices de l’acide alpha-lipoïque pour limiter les complications vasculaires du diabète demeurent discutés409-411. Une supplémentation chronique mais de manière intermittente semble une piste bénéfique412. L’acide alpha-lipoïque est également connu pour ses propriétés neuroprotectrices et régulatrices des voies de l’inflammation413,414, notamment en cas de sclérose en plaques415, de maladie d’Alzheimer416, de maladie de Parkinson417,418, de menace de fausse couche au cours de la grossesse (saignements intra-utérins, hématomes sous-chorioniques) surtout au cours du premier trimestre419-421 ou de prise de statines422 surtout en cas d’hypertension artérielle423,424. Pour en savoir davantage sur l’acide alpha-lipoïque, je vous invite à découvrir l’article Comment choisir et bien utiliser votre complément alimentaire à base d’acide alpha-lipoïque ?
6. La carnitine : un intérêt de la L-carnitine a été mis en évidence en cas de maladies neurodégénératives425-428, sclérose en plaques429-431, maladie de Parkinson432-437, de maladie d’Alzheimer438,439. Toutefois, les études qualitatives menées chez l’homme manquent à ce jour. Au regard du rôle physiologique que joue la L-carnitine envers la mitochondrie et son effet neuroprotecteur par réduction du stress oxydatif, proposer 2 à 3 g (en plusieurs prises) d’acétyl-L-carnitine en cas d’atteinte neuro-inflammatoire pourrait apparaître comme une stratégie nutritionnelle cohérente. Comme pour le CoQ10, des interactions avec la warfarine ont toutefois été identifiées440,441. Si vous êtes concerné(e) par une prise d’anticoagulants, je vous invite donc à demander conseil à votre médecin. Mais, et c’est le point essentiel, la L-carnitine d’origine alimentaire (ou via une supplémentation) augmente fortement les taux de TMAO par l’intermédiaire du microbiote intestinal. Il s’agit d’un composé aujourd’hui considéré comme un marqueur de risques cardiovasculaires442. Les auteurs concluent, à juste titre, sur le fait que si elle est nécessaire, une supplémentation doit se faire de manière ponctuelle et idéalement par voie intraveineuse pour éviter tout passage de la carnitine par le microbiote intestinal.
7. La créatine est bien connue du monde sportif pour augmenter la force musculaire, mais elle a également démontré son intérêt en cas de myopathie et globalement de maladie mitochondriale443-446. Elle permet en effet de maintenir l’intégrité de la mitochondrie en agissant comme un régulateur potentiel de la synthèse musculaire447-449. Les composés toxiques pour les mitochondries (antimycine A, chloramphénicol, carbonylcyanure m-chlorophénylhydrazone, bromure d’éthidium, myxothiazol, roténone, oligomycine) inhibent par exemple le processus de synthèse des cellules musculaires450. Toutefois et même si les études chez l’animal étaient prometteuses451, les essais cliniques menés chez l’homme et visant à étudier les effets de la créatine dans le cas de maladies neurodégénératives ne se sont pas avérés concluants452.
8. La vitamine B3 est impliquée dans le fonctionnement mitochondrial en tant que précurseur d’un composé essentiel à la chaîne respiratoire mitochondriale, le NAD+. Les œufs, la viande, le poisson ou les œufs en contiennent en quantité significative. Un déficit génère, in vitro ou chez l’animal, une augmentation des risques de complications neuropathiques du diabète453,454, de maladies neurodégénératives455,456 comme la sclérose en plaques457 ou de maladie d’Alzheimer458-460, d’ischémie cérébrale461 ou encore d’inflammation de bas-grade462. Toutefois, une supplémentation ne se justifie qu’en cas de déficit, d’alcoolisme chronique, d’avancée dans l’âge et/ou d’inflammation chronique. Un complément alimentaire dérivant de la vitamine B3 est proposé depuis quelques années sur le marché, la nicotinamide riboside. Les études menées chez l’homme montrent bien une augmentation des taux de NAD+ à la suite d’une supplémentation en nicotinamide riboside entre 500mg et 2g/jour. Toutefois, cette situation ne se traduit pas par une amélioration significative de l’état clinique des participants, autant sur les fonctions musculaires, que cardiovasculaires ou insuliniques463-467, sans compter sur le fait que de nombreux auteurs d’études présentent des conflits d’intérêts468. Je vous invite à découvrir votre indice Vitamines du groupe B et les conseils associés Comment optimiser votre statut en Vitamines du groupe B ? Vous y trouverez également des conseils relatifs à aux vitamines B2 et B9 (folates)469,470 également essentielles au bon fonctionnement mitochondrial.
9. Les oméga 3 à longue chaîne (EPA et DHA) modulent la composition en phospholipides des membranes mitochondriales, ce que l’on nomme le phospholipidome471,472. Selon une étude menée auprès de 18 adultes, la supplémentation en oméga 3 pendant 12 semaines à hauteur de 2g d’EPA et 1g de DHA par jour a permis d’augmenter la teneur des membranes mitochondriales des cellules musculaires de respectivement 450 et 320%. Une telle réorganisation a engendré une augmentation de leur production de radicaux libres du fait d’une meilleure activité, sans toutefois augmenter les dommages oxydatifs473. Chez l’animal, la supplémentation en oméga 3 permet également, par des mécanismes mitochondriaux, de retarder le vieillissement neuronal474, d’améliorer les fonctions endothéliales475, la sensibilité à l’insuline476 ou encore le syndrome NASH476. Toutefois, l’activité mitochondriale semble davantage modulée par la quantité de lipides consommés que par leur nature477. Je vous invite à découvrir votre indice Oméga 3 et les conseils associés Comment optimiser votre statut en Oméga 3 ?
10. Le PQQ et le D-Ribose : malgré leur spécificité d’action sur le fonctionnement mitochondrial, l’intérêt d’une supplémentation n’a pas été avéré sauf en cas d’insuffisance cardiaque (3 à 5g de D-Ribose)478,479. A noter, le PQQ est naturellement présent dans l’alimentation480, en particulier dans le lait maternel humain et dans le cacao. Découvrir l’article Que penser des compléments alimentaires à base de PQQ et de D-Ribose ?
Anthony Bertou
Sources :
(1) Bliek, A. M. van der; Sedensky, M. M.; Morgan, P. G. Cell Biology of the Mitochondrion. Genetics 2017, 207 (3), 843–871. https://doi.org/10.1534/genetics.117.300262.
(2) Zhu, X.-H.; Qiao, H.; Du, F.; Xiong, Q.; Liu, X.; Zhang, X.; Ugurbil, K.; Chen, W. Quantitative Imaging of Energy Expenditure in Human Brain. Neuroimage 2012, 60 (4), 2107–2117. https://doi.org/10.1016/j.neuroimage.2012.02.013.
(3) Pérez-Treviño, P.; Velásquez, M.; García, N. Mechanisms of Mitochondrial DNA Escape and Its Relationship with Different Metabolic Diseases. Biochim Biophys Acta Mol Basis Dis 2020, 1866 (6), 165761. https://doi.org/10.1016/j.bbadis.2020.165761.
(4) Chen, Y.; Lin, J.-R.; Gao, P.-J. Mitochondrial Division Inhibitor Mdivi-1 Ameliorates Angiotensin II-Induced Endothelial Dysfunction. Sheng Li Xue Bao 2016, 68 (5), 669–676.
(5) Ballinger, S. W.; Patterson, C.; Yan, C. N.; Doan, R.; Burow, D. L.; Young, C. G.; Yakes, F. M.; Van Houten, B.; Ballinger, C. A.; Freeman, B. A.; Runge, M. S. Hydrogen Peroxide- and Peroxynitrite-Induced Mitochondrial DNA Damage and Dysfunction in Vascular Endothelial and Smooth Muscle Cells. Circ. Res. 2000, 86 (9), 960–966. https://doi.org/10.1161/01.res.86.9.960.
(6) Ballinger, S. W.; Patterson, C.; Knight-Lozano, C. A.; Burow, D. L.; Conklin, C. A.; Hu, Z.; Reuf, J.; Horaist, C.; Lebovitz, R.; Hunter, G. C.; McIntyre, K.; Runge, M. S. Mitochondrial Integrity and Function in Atherogenesis. Circulation 2002, 106 (5), 544–549. https://doi.org/10.1161/01.cir.0000023921.93743.89.
(7) Chen, J.; Mehta, J. L.; Haider, N.; Zhang, X.; Narula, J.; Li, D. Role of Caspases in Ox-LDL-Induced Apoptotic Cascade in Human Coronary Artery Endothelial Cells. Circ. Res. 2004, 94 (3), 370–376. https://doi.org/10.1161/01.RES.0000113782.07824.BE.
(8) Vindis, C.; Elbaz, M.; Escargueil-Blanc, I.; Augé, N.; Heniquez, A.; Thiers, J.-C.; Nègre-Salvayre, A.; Salvayre, R. Two Distinct Calcium-Dependent Mitochondrial Pathways Are Involved in Oxidized LDL-Induced Apoptosis. Arterioscler. Thromb. Vasc. Biol. 2005, 25 (3), 639–645. https://doi.org/10.1161/01.ATV.0000154359.60886.33.
(9) Yu, E.; Calvert, P. A.; Mercer, J. R.; Harrison, J.; Baker, L.; Figg, N. L.; Kumar, S.; Wang, J. C.; Hurst, L. A.; Obaid, D. R.; Logan, A.; West, N. E. J.; Clarke, M. C. H.; Vidal-Puig, A.; Murphy, M. P.; Bennett, M. R. Mitochondrial DNA Damage Can Promote Atherosclerosis Independently of Reactive Oxygen Species through Effects on Smooth Muscle Cells and Monocytes and Correlates with Higher-Risk Plaques in Humans. Circulation 2013, 128 (7), 702–712. https://doi.org/10.1161/CIRCULATIONAHA.113.002271.
(10) Grootaert, M. O. J.; Moulis, M.; Roth, L.; Martinet, W.; Vindis, C.; Bennett, M. R.; De Meyer, G. R. Y. Vascular Smooth Muscle Cell Death, Autophagy and Senescence in Atherosclerosis. Cardiovasc. Res. 2018, 114 (4), 622–634. https://doi.org/10.1093/cvr/cvy007.
(11) Paradies, G.; Petrosillo, G.; Pistolese, M.; Di Venosa, N.; Federici, A.; Ruggiero, F. M. Decrease in Mitochondrial Complex I Activity in Ischemic/Reperfused Rat Heart: Involvement of Reactive Oxygen Species and Cardiolipin. Circ. Res. 2004, 94 (1), 53–59. https://doi.org/10.1161/01.RES.0000109416.56608.64.
(12) Chen, Q.; Camara, A. K. S.; Stowe, D. F.; Hoppel, C. L.; Lesnefsky, E. J. Modulation of Electron Transport Protects Cardiac Mitochondria and Decreases Myocardial Injury during Ischemia and Reperfusion. Am. J. Physiol., Cell Physiol. 2007, 292 (1), C137-147. https://doi.org/10.1152/ajpcell.00270.2006.
(13) Wang, J.; Toan, S.; Zhou, H. New Insights into the Role of Mitochondria in Cardiac Microvascular Ischemia/Reperfusion Injury. Angiogenesis 2020. https://doi.org/10.1007/s10456-020-09720-2.
(14) Przyklenk, K.; Bauer, B.; Ovize, M.; Kloner, R. A.; Whittaker, P. Regional Ischemic “preconditioning” Protects Remote Virgin Myocardium from Subsequent Sustained Coronary Occlusion. Circulation 1993, 87 (3), 893–899. https://doi.org/10.1161/01.cir.87.3.893.
(15) Muntean, D. M.; Sturza, A.; Dănilă, M. D.; Borza, C.; Duicu, O. M.; Mornoș, C. The Role of Mitochondrial Reactive Oxygen Species in Cardiovascular Injury and Protective Strategies. Oxid Med Cell Longev 2016, 2016, 8254942. https://doi.org/10.1155/2016/8254942.
(16) Postnov, I. V. [The role of mitochondrial calcium overload and energy deficiency in pathogenesis of arterial hypertension]. Arkh. Patol. 2001, 63 (3), 3–10.
(17) Stefanadi, E.; Tousoulis, D.; Androulakis, E. S.; Papageorgiou, N.; Charakida, M.; Siasos, G.; Tsioufis, C.; Stefanadis, C. Inflammatory Markers in Essential Hypertension: Potential Clinical Implications. Curr Vasc Pharmacol 2010, 8 (4), 509–516. https://doi.org/10.2174/157016110791330870.
(18) Dikalov, S. I.; Ungvari, Z. Role of Mitochondrial Oxidative Stress in Hypertension. Am. J. Physiol. Heart Circ. Physiol. 2013, 305 (10), H1417-1427. https://doi.org/10.1152/ajpheart.00089.2013.
(19) Szendroedi, J.; Phielix, E.; Roden, M. The Role of Mitochondria in Insulin Resistance and Type 2 Diabetes Mellitus. Nat Rev Endocrinol 2011, 8 (2), 92–103. https://doi.org/10.1038/nrendo.2011.138.
(20) Montgomery, M. K.; Turner, N. Mitochondrial Dysfunction and Insulin Resistance: An Update. Endocr Connect 2014, 4 (1), R1–R15. https://doi.org/10.1530/EC-14-0092.
(21) Watanabe, T.; Saotome, M.; Nobuhara, M.; Sakamoto, A.; Urushida, T.; Katoh, H.; Satoh, H.; Funaki, M.; Hayashi, H. Roles of Mitochondrial Fragmentation and Reactive Oxygen Species in Mitochondrial Dysfunction and Myocardial Insulin Resistance. Exp. Cell Res. 2014, 323 (2), 314–325. https://doi.org/10.1016/j.yexcr.2014.02.027.
(22) Kapogiannis, D.; Mattson, M. P. Disrupted Energy Metabolism and Neuronal Circuit Dysfunction in Cognitive Impairment and Alzheimer’s Disease. Lancet Neurol 2011, 10 (2), 187–198. https://doi.org/10.1016/S1474-4422(10)70277-5.
(23) Wilkins, H. M.; Swerdlow, R. H. Amyloid Precursor Protein Processing and Bioenergetics. Brain Res. Bull. 2017, 133, 71–79. https://doi.org/10.1016/j.brainresbull.2016.08.009.
(24) Overk, C.; Masliah, E. Perspective on the Calcium Dyshomeostasis Hypothesis in the Pathogenesis of Selective Neuronal Degeneration in Animal Models of Alzheimer’s Disease. Alzheimers Dement 2017, 13 (2), 183–185. https://doi.org/10.1016/j.jalz.2017.01.005.
(25) Kulich, S. M.; Chu, C. T. Role of Reactive Oxygen Species in Extracellular Signal-Regulated Protein Kinase Phosphorylation and 6-Hydroxydopamine Cytotoxicity. J. Biosci. 2003, 28 (1), 83–89. https://doi.org/10.1007/BF02970136.
(26) Moore, D. J.; West, A. B.; Dawson, V. L.; Dawson, T. M. Molecular Pathophysiology of Parkinson’s Disease. Annu. Rev. Neurosci. 2005, 28, 57–87. https://doi.org/10.1146/annurev.neuro.28.061604.135718.
(27) Aguiar, L. M. V.; Nobre, H. V.; Macêdo, D. S.; Oliveira, A. A.; Freitas, R. M.; Vasconcelos, S. M.; Cunha, G. M. A.; Sousa, F. C. F.; Viana, G. S. B. Neuroprotective Effects of Caffeine in the Model of 6-Hydroxydopamine Lesion in Rats. Pharmacol. Biochem. Behav. 2006, 84 (3), 415–419. https://doi.org/10.1016/j.pbb.2006.05.027.
(28) Haddad, D.; Nakamura, K. Understanding the Susceptibility of Dopamine Neurons to Mitochondrial Stressors in Parkinson’s Disease. FEBS Lett 2015, 589 (24 0 0), 3702–3713. https://doi.org/10.1016/j.febslet.2015.10.021.
(29) Liu, X.-L.; Wang, Y.-D.; Yu, X.-M.; Li, D.-W.; Li, G.-R. Mitochondria-Mediated Damage to Dopaminergic Neurons in Parkinson’s Disease (Review). Int. J. Mol. Med. 2018, 41 (2), 615–623. https://doi.org/10.3892/ijmm.2017.3255.
(30) Fetisova, E.; Chernyak, B.; Korshunova, G.; Muntyan, M.; Skulachev, V. Mitochondria-Targeted Antioxidants as a Prospective Therapeutic Strategy for Multiple Sclerosis. Curr. Med. Chem. 2017, 24 (19), 2086–2114. https://doi.org/10.2174/0929867324666170316114452.
(31) de Barcelos, I. P.; Troxell, R. M.; Graves, J. S. Mitochondrial Dysfunction and Multiple Sclerosis. Biology (Basel) 2019, 8 (2). https://doi.org/10.3390/biology8020037.
(32) Weinberg, S. E.; Sena, L. A.; Chandel, N. S. Mitochondria in the Regulation of Innate and Adaptive Immunity. Immunity 2015, 42 (3), 406–417. https://doi.org/10.1016/j.immuni.2015.02.002.
(33) Angajala, A.; Lim, S.; Phillips, J. B.; Kim, J.-H.; Yates, C.; You, Z.; Tan, M. Diverse Roles of Mitochondria in Immune Responses: Novel Insights Into Immuno-Metabolism. Front Immunol 2018, 9. https://doi.org/10.3389/fimmu.2018.01605.
(34) Xu, Y.; Shen, J.; Ran, Z. Emerging Views of Mitophagy in Immunity and Autoimmune Diseases. Autophagy 2020, 16 (1), 3–17. https://doi.org/10.1080/15548627.2019.1603547.
(35) Wallace, D. C. Mitochondria and Cancer. Nat Rev Cancer 2012, 12 (10), 685–698. https://doi.org/10.1038/nrc3365.
(36) Zong, W.-X.; Rabinowitz, J. D.; White, E. Mitochondria and Cancer. Mol. Cell 2016, 61 (5), 667–676. https://doi.org/10.1016/j.molcel.2016.02.011.
(37) Vyas, S.; Zaganjor, E.; Haigis, M. C. Mitochondria and Cancer. Cell 2016, 166 (3), 555–566. https://doi.org/10.1016/j.cell.2016.07.002.
(38) Choudhury, A. R.; Singh, K. K. Mitochondrial Determinants of Cancer Health Disparities. Semin Cancer Biol 2017, 47, 125–146. https://doi.org/10.1016/j.semcancer.2017.05.001.
(39) Kume, S.; Uzu, T.; Horiike, K.; Chin-Kanasaki, M.; Isshiki, K.; Araki, S.-I.; Sugimoto, T.; Haneda, M.; Kashiwagi, A.; Koya, D. Calorie Restriction Enhances Cell Adaptation to Hypoxia through Sirt1-Dependent Mitochondrial Autophagy in Mouse Aged Kidney. J. Clin. Invest. 2010, 120 (4), 1043–1055. https://doi.org/10.1172/JCI41376.
(40) Glick, D.; Barth, S.; Macleod, K. F. Autophagy: Cellular and Molecular Mechanisms. J. Pathol. 2010, 221 (1), 3–12. https://doi.org/10.1002/path.2697.
(41) Kroemer, G.; Mariño, G.; Levine, B. Autophagy and the Integrated Stress Response. Mol. Cell 2010, 40 (2), 280–293. https://doi.org/10.1016/j.molcel.2010.09.023.
(42) Pickles, S.; Vigié, P.; Youle, R. J. Mitophagy and Quality Control Mechanisms in Mitochondrial Maintenance. Curr. Biol. 2018, 28 (4), R170–R185. https://doi.org/10.1016/j.cub.2018.01.004.
(43) Lanza, I. R.; Zabielski, P.; Klaus, K. A.; Morse, D. M.; Heppelmann, C. J.; Bergen, H. R.; Dasari, S.; Walrand, S.; Short, K. R.; Johnson, M. L.; Robinson, M. M.; Schimke, J. M.; Jakaitis, D. R.; Asmann, Y. W.; Sun, Z.; Nair, K. S. Chronic Caloric Restriction Preserves Mitochondrial Function in Senescence without Increasing Mitochondrial Biogenesis. Cell Metab. 2012, 16 (6), 777–788. https://doi.org/10.1016/j.cmet.2012.11.003.
(44) Ning, Y.-C.; Cai, G.-Y.; Zhuo, L.; Gao, J.-J.; Dong, D.; Cui, S.; Feng, Z.; Shi, S.-Z.; Bai, X.-Y.; Sun, X.-F.; Chen, X.-M. Short-Term Calorie Restriction Protects against Renal Senescence of Aged Rats by Increasing Autophagic Activity and Reducing Oxidative Damage. Mech. Ageing Dev. 2013, 134 (11–12), 570–579. https://doi.org/10.1016/j.mad.2013.11.006.
(45) Ueno, T.; Komatsu, M. Autophagy in the Liver: Functions in Health and Disease. Nat Rev Gastroenterol Hepatol 2017, 14 (3), 170–184. https://doi.org/10.1038/nrgastro.2016.185.
(46) Luévano-Martínez, L. A.; Forni, M. F.; Peloggia, J.; Watanabe, I.-S.; Kowaltowski, A. J. Calorie Restriction Promotes Cardiolipin Biosynthesis and Distribution between Mitochondrial Membranes. Mech. Ageing Dev. 2017, 162, 9–17. https://doi.org/10.1016/j.mad.2017.02.004.
(47) Sciarretta, S.; Maejima, Y.; Zablocki, D.; Sadoshima, J. The Role of Autophagy in the Heart. Annual Review of Physiology 2018, 80 (1), 1–26. https://doi.org/10.1146/annurev-physiol-021317-121427.
(48) Jiang, P.; Mizushima, N. Autophagy and Human Diseases. Cell Res 2014, 24 (1), 69–79. https://doi.org/10.1038/cr.2013.161.
(49) Rubinsztein, D. C.; Bento, C. F.; Deretic, V. Therapeutic Targeting of Autophagy in Neurodegenerative and Infectious Diseases. J. Exp. Med. 2015, 212 (7), 979–990. https://doi.org/10.1084/jem.20150956.
(50) Ravanan, P.; Srikumar, I. F.; Talwar, P. Autophagy: The Spotlight for Cellular Stress Responses. Life Sci. 2017, 188, 53–67. https://doi.org/10.1016/j.lfs.2017.08.029.
(51) Li, Q.; Liu, Y.; Sun, M. Autophagy and Alzheimer’s Disease. Cell. Mol. Neurobiol. 2017, 37 (3), 377–388. https://doi.org/10.1007/s10571-016-0386-8.
(52) Moors, T. E.; Hoozemans, J. J. M.; Ingrassia, A.; Beccari, T.; Parnetti, L.; Chartier-Harlin, M.-C.; van de Berg, W. D. J. Therapeutic Potential of Autophagy-Enhancing Agents in Parkinson’s Disease. Mol Neurodegener 2017, 12 (1), 11. https://doi.org/10.1186/s13024-017-0154-3.
(53) Levy, J. M. M.; Towers, C. G.; Thorburn, A. Targeting Autophagy in Cancer. Nat. Rev. Cancer 2017, 17 (9), 528–542. https://doi.org/10.1038/nrc.2017.53.
(54) Sarparanta, J.; García-Macia, M.; Singh, R. Autophagy and Mitochondria in Obesity and Type 2 Diabetes. Curr Diabetes Rev 2017, 13 (4), 352–369. https://doi.org/10.2174/1573399812666160217122530.
(55) Hamano, T.; Hayashi, K.; Shirafuji, N.; Nakamoto, Y. The Implications of Autophagy in Alzheimer’s Disease. Curr Alzheimer Res 2018, 15 (14), 1283–1296. https://doi.org/10.2174/1567205015666181004143432.
(56) Marasco, M. R.; Linnemann, A. K. β-Cell Autophagy in Diabetes Pathogenesis. Endocrinology 2018, 159 (5), 2127–2141. https://doi.org/10.1210/en.2017-03273.
(57) Cerri, S.; Blandini, F. Role of Autophagy in Parkinson’s Disease. Curr. Med. Chem. 2019, 26 (20), 3702–3718. https://doi.org/10.2174/0929867325666180226094351.
(58) Germic, N.; Frangez, Z.; Yousefi, S.; Simon, H.-U. Regulation of the Innate Immune System by Autophagy: Neutrophils, Eosinophils, Mast Cells, NK Cells. Cell Death & Differentiation 2019, 26 (4), 703–714. https://doi.org/10.1038/s41418-019-0295-8.
(59) Levine, B.; Kroemer, G. Biological Functions of Autophagy Genes: A Disease Perspective. Cell 2019, 176 (1–2), 11–42. https://doi.org/10.1016/j.cell.2018.09.048.
(60) Tapia, P. C. Sublethal Mitochondrial Stress with an Attendant Stoichiometric Augmentation of Reactive Oxygen Species May Precipitate Many of the Beneficial Alterations in Cellular Physiology Produced by Caloric Restriction, Intermittent Fasting, Exercise and Dietary Phytonutrients: “Mitohormesis” for Health and Vitality. Medical Hypotheses 2006, 66 (4), 832–843. https://doi.org/10.1016/j.mehy.2005.09.009.
(61) López-Lluch, G.; Hunt, N.; Jones, B.; Zhu, M.; Jamieson, H.; Hilmer, S.; Cascajo, M. V.; Allard, J.; Ingram, D. K.; Navas, P.; de Cabo, R. Calorie Restriction Induces Mitochondrial Biogenesis and Bioenergetic Efficiency. Proc Natl Acad Sci U S A 2006, 103 (6), 1768–1773. https://doi.org/10.1073/pnas.0510452103.
(62) Lettieri-Barbato, D.; Cannata, S. M.; Casagrande, V.; Ciriolo, M. R.; Aquilano, K. Time-Controlled Fasting Prevents Aging-like Mitochondrial Changes Induced by Persistent Dietary Fat Overload in Skeletal Muscle. PLoS One 2018, 13 (5). https://doi.org/10.1371/journal.pone.0195912.
(63) Miller, V. J.; Villamena, F. A.; Volek, J. S. Nutritional Ketosis and Mitohormesis: Potential Implications for Mitochondrial Function and Human Health. J Nutr Metab 2018, 2018. https://doi.org/10.1155/2018/5157645.
(64) Palmeira, C. M.; Teodoro, J. S.; Amorim, J. A.; Steegborn, C.; Sinclair, D. A.; Rolo, A. P. Mitohormesis and Metabolic Health: The Interplay between ROS, CAMP and Sirtuins. Free Radical Biology and Medicine 2019, 141, 483–491. https://doi.org/10.1016/j.freeradbiomed.2019.07.017.
(65) Bagherniya, M.; Butler, A. E.; Barreto, G. E.; Sahebkar, A. The Effect of Fasting or Calorie Restriction on Autophagy Induction: A Review of the Literature. Ageing Res. Rev. 2018, 47, 183–197. https://doi.org/10.1016/j.arr.2018.08.004.
(66) Bach, D.; Pich, S.; Soriano, F. X.; Vega, N.; Baumgartner, B.; Oriola, J.; Daugaard, J. R.; Lloberas, J.; Camps, M.; Zierath, J. R.; Rabasa-Lhoret, R.; Wallberg-Henriksson, H.; Laville, M.; Palacín, M.; Vidal, H.; Rivera, F.; Brand, M.; Zorzano, A. Mitofusin-2 Determines Mitochondrial Network Architecture and Mitochondrial Metabolism. A Novel Regulatory Mechanism Altered in Obesity. J. Biol. Chem. 2003, 278 (19), 17190–17197. https://doi.org/10.1074/jbc.M212754200.
(67) Ma, D.; Li, S.; Molusky, M. M.; Lin, J. D. Circadian Autophagy Rhythm: A Link between Clock and Metabolism? Trends Endocrinol. Metab. 2012, 23 (7), 319–325. https://doi.org/10.1016/j.tem.2012.03.004.
(68) Maiese, K. Moving to the Rhythm with Clock (Circadian) Genes, Autophagy, MTOR, and SIRT1 in Degenerative Disease and Cancer. Curr Neurovasc Res 2017, 14 (3), 299–304. https://doi.org/10.2174/1567202614666170718092010.
(69) Rabbani, N.; Thornalley, P. J. Dicarbonyls Linked to Damage in the Powerhouse: Glycation of Mitochondrial Proteins and Oxidative Stress. Biochem Soc Trans 2008, 36 (Pt 5), 1045–1050. https://doi.org/10.1042/BST0361045.
(70) Naudí, A.; Jové, M.; Ayala, V.; Portero-Otín, M.; Pamplona, R. [Glycation of mitochondrial proteins, oxidative stress and aging]. Rev Esp Geriatr Gerontol 2010, 45 (3), 156–166. https://doi.org/10.1016/j.regg.2010.02.001.
(71) Balsano, C.; Alisi, A. Antioxidant Effects of Natural Bioactive Compounds. Curr. Pharm. Des. 2009, 15 (26), 3063–3073. https://doi.org/10.2174/138161209789058084.
(72) Ibanez, F.; Bang, W. Y.; Lombardini, L.; Cisneros-Zevallos, L. Solving the Controversy of Healthier Organic Fruit: Leaf Wounding Triggers Distant Gene Expression Response of Polyphenol Biosynthesis in Strawberry Fruit (Fragaria x Ananassa). Sci Rep 2019, 9. https://doi.org/10.1038/s41598-019-55033-w.
(73) Soane, L.; Li Dai, W.; Fiskum, G.; Bambrick, L. L. Sulforaphane Protects Immature Hippocampal Neurons against Death Caused by Exposure to Hemin or to Oxygen and Glucose Deprivation. J. Neurosci. Res. 2010, 88 (6), 1355–1363. https://doi.org/10.1002/jnr.22307.
(74) de Oliveira, M. R.; Nabavi, S. M.; Braidy, N.; Setzer, W. N.; Ahmed, T.; Nabavi, S. F. Quercetin and the Mitochondria: A Mechanistic View. Biotechnol. Adv. 2016, 34 (5), 532–549. https://doi.org/10.1016/j.biotechadv.2015.12.014.
(75) Chen, X.; Peng, X.; Luo, Y.; You, J.; Yin, D.; Xu, Q.; He, H.; He, M. Quercetin Protects Cardiomyocytes against Doxorubicin-Induced Toxicity by Suppressing Oxidative Stress and Improving Mitochondrial Function via 14-3-3γ. Toxicol. Mech. Methods 2019, 29 (5), 344–354. https://doi.org/10.1080/15376516.2018.1564948.
(76) Amanzadeh, E.; Esmaeili, A.; Rahgozar, S.; Nourbakhshnia, M. Application of Quercetin in Neurological Disorders: From Nutrition to Nanomedicine. Rev Neurosci 2019, 30 (5), 555–572. https://doi.org/10.1515/revneuro-2018-0080.
(77) Wu, C.; Hsu, M.; Hsieh, C.; Lin, J.; Lai, P.; Wung, B. Upregulation of Heme Oxygenase-1 by Epigallocatechin-3-Gallate via the Phosphatidylinositol 3-Kinase/Akt and ERK Pathways. Life Sci 2005, 78 (25), 2889–2897. https://doi.org/10.1016/j.lfs.2005.11.013.
(78) Schroeder, E. K.; Kelsey, N. A.; Doyle, J.; Breed, E.; Bouchard, R. J.; Loucks, F. A.; Harbison, R. A.; Linseman, D. A. Green Tea Epigallocatechin 3-Gallate Accumulates in Mitochondria and Displays a Selective Antiapoptotic Effect against Inducers of Mitochondrial Oxidative Stress in Neurons. Antioxid. Redox Signal. 2009, 11 (3), 469–480. https://doi.org/10.1089/ars.2008.2215.
(79) Oliveira, M. R. de; Nabavi, S. F.; Daglia, M.; Rastrelli, L.; Nabavi, S. M. Epigallocatechin Gallate and Mitochondria-A Story of Life and Death. Pharmacol. Res. 2016, 104, 70–85. https://doi.org/10.1016/j.phrs.2015.12.027.
(80) Shi, W.; Li, L.; Ding, Y.; Yang, K.; Chen, Z.; Fan, X.; Jiang, S.; Guan, Y.; Liu, Z.; Xu, D.; Wu, L. The Critical Role of Epigallocatechin Gallate in Regulating Mitochondrial Metabolism. Future Med Chem 2018, 10 (7), 795–809. https://doi.org/10.4155/fmc-2017-0204.
(81) Pae, H.-O.; Jeong, G.-S.; Jeong, S.-O.; Kim, H. S.; Kim, S.-A.; Kim, Y.-C.; Yoo, S.-J.; Kim, H.-D.; Chung, H.-T. Roles of Heme Oxygenase-1 in Curcumin-Induced Growth Inhibition in Rat Smooth Muscle Cells. Exp. Mol. Med. 2007, 39 (3), 267–277. https://doi.org/10.1038/emm.2007.30.
(82) Wu, W.; Yang, B.; Qiao, Y.; Zhou, Q.; He, H.; He, M. Kaempferol Protects Mitochondria and Alleviates Damages against Endotheliotoxicity Induced by Doxorubicin. Biomed. Pharmacother. 2020, 126, 110040. https://doi.org/10.1016/j.biopha.2020.110040.
(83) Hsieh, T.; Lu, X.; Wang, Z.; Wu, J. M. Induction of Quinone Reductase NQO1 by Resveratrol in Human K562 Cells Involves the Antioxidant Response Element ARE and Is Accompanied by Nuclear Translocation of Transcription Factor Nrf2. Med Chem 2006, 2 (3), 275–285. https://doi.org/10.2174/157340606776930709.
(84) Valero, T. Mitochondrial Biogenesis: Pharmacological Approaches. Curr. Pharm. Des. 2014, 20 (35), 5507–5509. https://doi.org/10.2174/138161282035140911142118.
(85) Tellone, E.; Galtieri, A.; Russo, A.; Giardina, B.; Ficarra, S. Resveratrol: A Focus on Several Neurodegenerative Diseases. Oxid Med Cell Longev 2015, 2015, 392169. https://doi.org/10.1155/2015/392169.
(86) de Oliveira, M. R.; Nabavi, S. F.; Manayi, A.; Daglia, M.; Hajheydari, Z.; Nabavi, S. M. Resveratrol and the Mitochondria: From Triggering the Intrinsic Apoptotic Pathway to Inducing Mitochondrial Biogenesis, a Mechanistic View. Biochim. Biophys. Acta 2016, 1860 (4), 727–745. https://doi.org/10.1016/j.bbagen.2016.01.017.
(87) Kairisalo, M.; Bonomo, A.; Hyrskyluoto, A.; Mudò, G.; Belluardo, N.; Korhonen, L.; Lindholm, D. Resveratrol Reduces Oxidative Stress and Cell Death and Increases Mitochondrial Antioxidants and XIAP in PC6.3-Cells. Neurosci. Lett. 2011, 488 (3), 263–266. https://doi.org/10.1016/j.neulet.2010.11.042.
(88) Zhao, H.; Niu, Q.; Li, X.; Liu, T.; Xu, Y.; Han, H.; Wang, W.; Fan, N.; Tian, Q.; Zhang, H.; Wang, Z. Long-Term Resveratrol Consumption Protects Ovariectomized Rats Chronically Treated with D-Galactose from Developing Memory Decline without Effects on the Uterus. Brain Res. 2012, 1467, 67–80. https://doi.org/10.1016/j.brainres.2012.05.040.
(89) Wu, Y.; Li, X.; Zhu, J. X.; Xie, W.; Le, W.; Fan, Z.; Jankovic, J.; Pan, T. Resveratrol-Activated AMPK/SIRT1/Autophagy in Cellular Models of Parkinson’s Disease. Neurosignals 2011, 19 (3), 163–174. https://doi.org/10.1159/000328516.
(90) Lin, T.-K.; Chen, S.-D.; Chuang, Y.-C.; Lin, H.-Y.; Huang, C.-R.; Chuang, J.-H.; Wang, P.-W.; Huang, S.-T.; Tiao, M.-M.; Chen, J.-B.; Liou, C.-W. Resveratrol Partially Prevents Rotenone-Induced Neurotoxicity in Dopaminergic SH-SY5Y Cells through Induction of Heme Oxygenase-1 Dependent Autophagy. Int J Mol Sci 2014, 15 (1), 1625–1646. https://doi.org/10.3390/ijms15011625.
(91) De Paepe, B.; Van Coster, R. A Critical Assessment of the Therapeutic Potential of Resveratrol Supplements for Treating Mitochondrial Disorders. Nutrients 2017, 9 (9). https://doi.org/10.3390/nu9091017.
(92) Jardim, F. R.; de Rossi, F. T.; Nascimento, M. X.; da Silva Barros, R. G.; Borges, P. A.; Prescilio, I. C.; de Oliveira, M. R. Resveratrol and Brain Mitochondria: A Review. Mol. Neurobiol. 2018, 55 (3), 2085–2101. https://doi.org/10.1007/s12035-017-0448-z.
(93) Ahmed, T.; Javed, S.; Javed, S.; Tariq, A.; Šamec, D.; Tejada, S.; Nabavi, S. F.; Braidy, N.; Nabavi, S. M. Resveratrol and Alzheimer’s Disease: Mechanistic Insights. Mol. Neurobiol. 2017, 54 (4), 2622–2635. https://doi.org/10.1007/s12035-016-9839-9.
(94) Schweiger, S.; Matthes, F.; Posey, K.; Kickstein, E.; Weber, S.; Hettich, M. M.; Pfurtscheller, S.; Ehninger, D.; Schneider, R.; Krauß, S. Resveratrol Induces Dephosphorylation of Tau by Interfering with the MID1-PP2A Complex. Scientific Reports 2017, 7 (1), 1–13. https://doi.org/10.1038/s41598-017-12974-4.
(95) Kou, X.; Chen, N. Resveratrol as a Natural Autophagy Regulator for Prevention and Treatment of Alzheimer’s Disease. Nutrients 2017, 9 (9). https://doi.org/10.3390/nu9090927.
(96) Gomes, B. A. Q.; Silva, J. P. B.; Romeiro, C. F. R.; dos Santos, S. M.; Rodrigues, C. A.; Gonçalves, P. R.; Sakai, J. T.; Mendes, P. F. S.; Varela, E. L. P.; Monteiro, M. C. Neuroprotective Mechanisms of Resveratrol in Alzheimer’s Disease: Role of SIRT1. Oxid Med Cell Longev 2018, 2018. https://doi.org/10.1155/2018/8152373.
(97) Ferretta, A.; Gaballo, A.; Tanzarella, P.; Piccoli, C.; Capitanio, N.; Nico, B.; Annese, T.; Di Paola, M.; Dell’aquila, C.; De Mari, M.; Ferranini, E.; Bonifati, V.; Pacelli, C.; Cocco, T. Effect of Resveratrol on Mitochondrial Function: Implications in Parkin-Associated Familiar Parkinson’s Disease. Biochim. Biophys. Acta 2014, 1842 (7), 902–915. https://doi.org/10.1016/j.bbadis.2014.02.010.
(98) Peng, K.; Tao, Y.; Zhang, J.; Wang, J.; Ye, F.; Dan, G.; Zhao, Y.; Cai, Y.; Zhao, J.; Wu, Q.; Zou, Z.; Cao, J.; Sai, Y. Resveratrol Regulates Mitochondrial Biogenesis and Fission/Fusion to Attenuate Rotenone-Induced Neurotoxicity. Oxid Med Cell Longev 2016, 2016, 6705621. https://doi.org/10.1155/2016/6705621.
(99) Palle, S.; Neerati, P. Improved Neuroprotective Effect of Resveratrol Nanoparticles as Evinced by Abrogation of Rotenone-Induced Behavioral Deficits and Oxidative and Mitochondrial Dysfunctions in Rat Model of Parkinson’s Disease. Naunyn Schmiedebergs Arch. Pharmacol. 2018, 391 (4), 445–453. https://doi.org/10.1007/s00210-018-1474-8.
(100) Naia, L.; Rosenstock, T. R.; Oliveira, A. M.; Oliveira-Sousa, S. I.; Caldeira, G. L.; Carmo, C.; Laço, M. N.; Hayden, M. R.; Oliveira, C. R.; Rego, A. C. Comparative Mitochondrial-Based Protective Effects of Resveratrol and Nicotinamide in Huntington’s Disease Models. Mol. Neurobiol. 2017, 54 (7), 5385–5399. https://doi.org/10.1007/s12035-016-0048-3.
(101) Mancuso, R.; del Valle, J.; Modol, L.; Martinez, A.; Granado-Serrano, A. B.; Ramirez-Núñez, O.; Pallás, M.; Portero-Otin, M.; Osta, R.; Navarro, X. Resveratrol Improves Motoneuron Function and Extends Survival in SOD1(G93A) ALS Mice. Neurotherapeutics 2014, 11 (2), 419–432. https://doi.org/10.1007/s13311-013-0253-y.
(102) Pollack, R. M.; Barzilai, N.; Anghel, V.; Kulkarni, A. S.; Golden, A.; O’Broin, P.; Sinclair, D. A.; Bonkowski, M. S.; Coleville, A. J.; Powell, D.; Kim, S.; Moaddel, R.; Stein, D.; Zhang, K.; Hawkins, M.; Crandall, J. P. Resveratrol Improves Vascular Function and Mitochondrial Number but Not Glucose Metabolism in Older Adults. J. Gerontol. A Biol. Sci. Med. Sci. 2017, 72 (12), 1703–1709. https://doi.org/10.1093/gerona/glx041.
(103) de Ligt, M.; Bruls, Y. M. H.; Hansen, J.; Habets, M.-F.; Havekes, B.; Nascimento, E. B. M.; Moonen-Kornips, E.; Schaart, G.; Schrauwen-Hinderling, V. B.; van Marken Lichtenbelt, W.; Schrauwen, P. Resveratrol Improves Ex Vivo Mitochondrial Function but Does Not Affect Insulin Sensitivity or Brown Adipose Tissue in First Degree Relatives of Patients with Type 2 Diabetes. Mol Metab 2018, 12, 39–47. https://doi.org/10.1016/j.molmet.2018.04.004.
(104) Barrea, L.; Tarantino, G.; Somma, C. D.; Muscogiuri, G.; Macchia, P. E.; Falco, A.; Colao, A.; Savastano, S. Adherence to the Mediterranean Diet and Circulating Levels of Sirtuin 4 in Obese Patients: A Novel Association. Oxid Med Cell Longev 2017, 2017. https://doi.org/10.1155/2017/6101254.
(105) Caplliure-Llopis, J.; Peralta-Chamba, T.; Carrera-Juliá, S.; Cuerda-Ballester, M.; Drehmer-Rieger, E.; López-Rodriguez, M. M.; de la Rubia Ortí, J. E. Therapeutic Alternative of the Ketogenic Mediterranean Diet to Improve Mitochondrial Activity in Amyotrophic Lateral Sclerosis (ALS): A Comprehensive Review. Food Sci Nutr 2020, 8 (1), 23–35. https://doi.org/10.1002/fsn3.1324.
(106) Lonn, E.; Bosch, J.; Yusuf, S.; Sheridan, P.; Pogue, J.; Arnold, J. M. O.; Ross, C.; Arnold, A.; Sleight, P.; Probstfield, J.; Dagenais, G. R.; HOPE and HOPE-TOO Trial Investigators. Effects of Long-Term Vitamin E Supplementation on Cardiovascular Events and Cancer: A Randomized Controlled Trial. JAMA 2005, 293 (11), 1338–1347. https://doi.org/10.1001/jama.293.11.1338.
(107) Bjelakovic, G.; Nikolova, D.; Gluud, L. L.; Simonetti, R. G.; Gluud, C. Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention: Systematic Review and Meta-Analysis. JAMA 2007, 297 (8), 842–857. https://doi.org/10.1001/jama.297.8.842.
(108) Lippman, S. M.; Klein, E. A.; Goodman, P. J.; Lucia, M. S.; Thompson, I. M.; Ford, L. G.; Parnes, H. L.; Minasian, L. M.; Gaziano, J. M.; Hartline, J. A.; Parsons, J. K.; Bearden, J. D.; Crawford, E. D.; Goodman, G. E.; Claudio, J.; Winquist, E.; Cook, E. D.; Karp, D. D.; Walther, P.; Lieber, M. M.; Kristal, A. R.; Darke, A. K.; Arnold, K. B.; Ganz, P. A.; Santella, R. M.; Albanes, D.; Taylor, P. R.; Probstfield, J. L.; Jagpal, T. J.; Crowley, J. J.; Meyskens, F. L.; Baker, L. H.; Coltman, C. A. Effect of Selenium and Vitamin E on Risk of Prostate Cancer and Other Cancers: The Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA 2009, 301 (1), 39–51. https://doi.org/10.1001/jama.2008.864.
(109) Lin, J.; Cook, N.; Albert, C.; Zaharris, E.; Gaziano, J.; Van Denburgh, M.; Buring, J.; Manson, J. Vitamins C and E and Beta Carotene Supplementation and Cancer Risk: A Randomized Controlled Trial. Journal of the National Cancer Institute 2009, 101, 14–23. https://doi.org/10.1093/jnci/djn438.
(110) Wang, X. H.; Souders, C. L.; Zhao, Y. H.; Martyniuk, C. J. Paraquat Affects Mitochondrial Bioenergetics, Dopamine System Expression, and Locomotor Activity in Zebrafish (Danio Rerio). Chemosphere 2018, 191, 106–117. https://doi.org/10.1016/j.chemosphere.2017.10.032.
(111) Castello, P. R.; Drechsel, D. A.; Patel, M. Mitochondria Are a Major Source of Paraquat-Induced Reactive Oxygen Species Production in the Brain. J. Biol. Chem. 2007, 282 (19), 14186–14193. https://doi.org/10.1074/jbc.M700827200.
(112) Cochemé, H. M.; Murphy, M. P. Complex I Is the Major Site of Mitochondrial Superoxide Production by Paraquat. J. Biol. Chem. 2008, 283 (4), 1786–1798. https://doi.org/10.1074/jbc.M708597200.
(113) Blanco-Ayala, T.; Andérica-Romero, A. C.; Pedraza-Chaverri, J. New Insights into Antioxidant Strategies against Paraquat Toxicity. Free Radic. Res. 2014, 48 (6), 623–640. https://doi.org/10.3109/10715762.2014.899694.
(114) Jang, Y. J.; Won, J. H.; Back, M. J.; Fu, Z.; Jang, J. M.; Ha, H. C.; Hong, S.; Chang, M.; Kim, D. K. Paraquat Induces Apoptosis through a Mitochondria-Dependent Pathway in RAW264.7 Cells. Biomol Ther (Seoul) 2015, 23 (5), 407–413. https://doi.org/10.4062/biomolther.2015.075.
(115) Huang, C.-L.; Chao, C.-C.; Lee, Y.-C.; Lu, M.-K.; Cheng, J.-J.; Yang, Y.-C.; Wang, V.-C.; Chang, W.-C.; Huang, N.-K. Paraquat Induces Cell Death Through Impairing Mitochondrial Membrane Permeability. Mol. Neurobiol. 2016, 53 (4), 2169–2188. https://doi.org/10.1007/s12035-015-9198-y.
(116) Samsel, A.; Seneff, S. Glyphosate, Pathways to Modern Diseases III: Manganese, Neurological Diseases, and Associated Pathologies. Surg Neurol Int 2015, 6, 45. https://doi.org/10.4103/2152-7806.153876.
(117) Bailey, D. C.; Todt, C. E.; Burchfield, S. L.; Pressley, A. S.; Denney, R. D.; Snapp, I. B.; Negga, R.; Traynor, W. L.; Fitsanakis, V. A. Chronic Exposure to a Glyphosate-Containing Pesticide Leads to Mitochondrial Dysfunction and Increased Reactive Oxygen Species Production in Caenorhabditis Elegans. Environ. Toxicol. Pharmacol. 2018, 57, 46–52. https://doi.org/10.1016/j.etap.2017.11.005.
(118) Kronberg, M. F.; Clavijo, A.; Moya, A.; Rossen, A.; Calvo, D.; Pagano, E.; Munarriz, E. Glyphosate-Based Herbicides Modulate Oxidative Stress Response in the Nematode Caenorhabditis Elegans. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 2018, 214, 1–8. https://doi.org/10.1016/j.cbpc.2018.08.002.
(119) Pereira, A. G.; Jaramillo, M. L.; Remor, A. P.; Latini, A.; Davico, C. E.; da Silva, M. L.; Müller, Y. M. R.; Ammar, D.; Nazari, E. M. Low-Concentration Exposure to Glyphosate-Based Herbicide Modulates the Complexes of the Mitochondrial Respiratory Chain and Induces Mitochondrial Hyperpolarization in the Danio Rerio Brain. Chemosphere 2018, 209, 353–362. https://doi.org/10.1016/j.chemosphere.2018.06.075.
(120) Burchfield, S. L.; Bailey, D. C.; Todt, C. E.; Denney, R. D.; Negga, R.; Fitsanakis, V. A. Acute Exposure to a Glyphosate-Containing Herbicide Formulation Inhibits Complex II and Increases Hydrogen Peroxide in the Model Organism Caenorhabditis Elegans. Environ. Toxicol. Pharmacol. 2019, 66, 36–42. https://doi.org/10.1016/j.etap.2018.12.019.
(121) Hao, Y.; Chen, H.; Xu, W.; Gao, J.; Yang, Y.; Zhang, Y.; Tao, L. Roundup® Confers Cytotoxicity through DNA Damage and Mitochondria-Associated Apoptosis Induction. Environ. Pollut. 2019, 252 (Pt A), 917–923. https://doi.org/10.1016/j.envpol.2019.05.128.
(122) Zhang, J.-W.; Xu, D.-Q.; Feng, X.-Z. The Toxic Effects and Possible Mechanisms of Glyphosate on Mouse Oocytes. Chemosphere 2019, 237, 124435. https://doi.org/10.1016/j.chemosphere.2019.124435.
(123) Cavieres, M. F.; Jaeger, J.; Porter, W. Developmental Toxicity of a Commercial Herbicide Mixture in Mice: I. Effects on Embryo Implantation and Litter Size. Environ Health Perspect 2002, 110 (11), 1081–1085.
(124) Peixoto, F.; Vicente, J. A. F.; Madeira, V. M. C. Comparative Effects of Herbicide Dicamba and Related Compound on Plant Mitochondrial Bioenergetics. J. Biochem. Mol. Toxicol. 2003, 17 (3), 185–192. https://doi.org/10.1002/jbt.10077.
(125) Peixoto, F.; Vicente, J. A. F.; Madeira, V. M. C. The Herbicide Dicamba (2-Methoxy-3,6-Dichlorobenzoic Acid) Interacts with Mitochondrial Bioenergetic Functions. Arch. Toxicol. 2003, 77 (7), 403–409. https://doi.org/10.1007/s00204-003-0456-9.
(126) Middlemore-Risher, M.-L.; Adam, B.-L.; Lambert, N. A.; Terry, A. V. Effects of Chlorpyrifos and Chlorpyrifos-Oxon on the Dynamics and Movement of Mitochondria in Rat Cortical Neurons. J. Pharmacol. Exp. Ther. 2011, 339 (2), 341–349. https://doi.org/10.1124/jpet.111.184762.
(127) Yamada, S.; Kubo, Y.; Yamazaki, D.; Sekino, Y.; Kanda, Y. Chlorpyrifos Inhibits Neural Induction via Mfn1-Mediated Mitochondrial Dysfunction in Human Induced Pluripotent Stem Cells. Sci Rep 2017, 7, 40925. https://doi.org/10.1038/srep40925.
(128) Donley, N. The USA Lags behind Other Agricultural Nations in Banning Harmful Pesticides. Environ Health 2019, 18 (1), 44. https://doi.org/10.1186/s12940-019-0488-0.
(129) Lim, S.; Ahn, S. Y.; Song, I. C.; Chung, M. H.; Jang, H. C.; Park, K. S.; Lee, K.-U.; Pak, Y. K.; Lee, H. K. Chronic Exposure to the Herbicide, Atrazine, Causes Mitochondrial Dysfunction and Insulin Resistance. PLoS ONE 2009, 4 (4), e5186. https://doi.org/10.1371/journal.pone.0005186.
(130) Sagarkar, S.; Gandhi, D.; Devi, S. S.; Sakharkar, A.; Kapley, A. Atrazine Exposure Causes Mitochondrial Toxicity in Liver and Muscle Cell Lines. Indian J Pharmacol 2016, 48 (2), 200–207. https://doi.org/10.4103/0253-7613.178842.
(131) Lin, J.; Zhao, H.-S.; Qin, L.; Li, X.-N.; Zhang, C.; Xia, J.; Li, J.-L. Atrazine Triggers Mitochondrial Dysfunction and Oxidative Stress in Quail ( Coturnix C. Coturnix) Cerebrum via Activating Xenobiotic-Sensing Nuclear Receptors and Modulating Cytochrome P450 Systems. J. Agric. Food Chem. 2018, 66 (25), 6402–6413. https://doi.org/10.1021/acs.jafc.8b01413.
(132) Zhang, C.; Qin, L.; Dou, D.-C.; Li, X.-N.; Ge, J.; Li, J.-L. Atrazine Induced Oxidative Stress and Mitochondrial Dysfunction in Quail (Coturnix C. Coturnix) Kidney via Modulating Nrf2 Signaling Pathway. Chemosphere 2018, 212, 974–982. https://doi.org/10.1016/j.chemosphere.2018.08.138.
(133) Yang, M.; Wang, B.; Gao, J.; Zhang, Y.; Xu, W.; Tao, L. Spinosad Induces Programmed Cell Death Involves Mitochondrial Dysfunction and Cytochrome C Release in Spodoptera Frugiperda Sf9 Cells. Chemosphere 2017, 169, 155–161. https://doi.org/10.1016/j.chemosphere.2016.11.065.
(134) Zhang, Y.; Chen, H.; Fan, Y.; Yang, Y.; Gao, J.; Xu, W.; Xu, Z.; Li, Z.; Tao, L. Cytotoxic Effects of Bio-Pesticide Spinosad on Human Lung A549 cells. Chemosphere 2019, 230, 182–189. https://doi.org/10.1016/j.chemosphere.2019.05.042.
(135) Brazeau, M. 4 Things That Led to the Myth That Organic Farmers Use More Pesticides than Conventional Farmers. Genetic Literacy Project. May 22, 2018.
(136) Navarro, A.; Bández, M. J.; Gómez, C.; Repetto, M. G.; Boveris, A. Effects of Rotenone and Pyridaben on Complex I Electron Transfer and on Mitochondrial Nitric Oxide Synthase Functional Activity. J. Bioenerg. Biomembr. 2010, 42 (5), 405–412. https://doi.org/10.1007/s10863-010-9309-4.
(137) Heinz, S.; Freyberger, A.; Lawrenz, B.; Schladt, L.; Schmuck, G.; Ellinger-Ziegelbauer, H. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Sci Rep 2017, 7, 45465. https://doi.org/10.1038/srep45465.
(138) Xu, W.; Liu, W.; Shao, X.; Jiang, G.; Li, X. Effect of Trichlorfon on Hepatic Lipid Accumulation in Crucian Carp Carassius Auratus Gibelio. J. Aquat. Anim. Health 2012, 24 (3), 185–194. https://doi.org/10.1080/08997659.2012.675937.
(139) Lu, J.; Zhang, M.; Lu, L. Tissue Metabolism, Hematotoxicity, and Hepatotoxicity of Trichlorfon in Carassius Auratus Gibelio After a Single Oral Administration. Front Physiol 2018, 9, 551. https://doi.org/10.3389/fphys.2018.00551.
(140) EPA. Trichlorfon – Regulatory Actions https://iaspub.epa.gov/apex/pesticides/f?p=CHEMICALSEARCH:31:::NO:1,3,31,7,12,25:P3_XCHEMICAL_ID:4102 (accessed May 3, 2020).
(141) Nakamaru-Ogiso, E.; Sakamoto, K.; Matsuno-Yagi, A.; Miyoshi, H.; Yagi, T. The ND5 Subunit Was Labeled by a Photoaffinity Analogue of Fenpyroximate in Bovine Mitochondrial Complex I. Biochemistry 2003, 42 (3), 746–754. https://doi.org/10.1021/bi0269660.
(142) Sherer, T. B.; Richardson, J. R.; Testa, C. M.; Seo, B. B.; Panov, A. V.; Yagi, T.; Matsuno-Yagi, A.; Miller, G. W.; Greenamyre, J. T. Mechanism of Toxicity of Pesticides Acting at Complex I: Relevance to Environmental Etiologies of Parkinson’s Disease. J. Neurochem. 2007, 100 (6), 1469–1479. https://doi.org/10.1111/j.1471-4159.2006.04333.x.
(143) Lee, H. Y.; Lee, B. K.; Jeung, K. W.; Lee, G. S.; Jung, Y. H.; Jeong, I. S. A Case of Near-Fatal Fenpyroximate Intoxication: The Role of Percutaneous Cardiopulmonary Support and Therapeutic Hypothermia. Clin Toxicol (Phila) 2012, 50 (9), 858–861. https://doi.org/10.3109/15563650.2012.720987.
(144) Chen, T.; Tan, J.; Wan, Z.; Zou, Y.; Afewerky, H. K.; Zhang, Z.; Zhang, T. Effects of Commonly Used Pesticides in China on the Mitochondria and Ubiquitin-Proteasome System in Parkinson’s Disease. Int J Mol Sci 2017, 18 (12). https://doi.org/10.3390/ijms18122507.
(145) Bailey, D. C.; Todt, C. E.; Orfield, S. E.; Denney, R. D.; Snapp, I. B.; Negga, R.; Montgomery, K. M.; Bailey, A. C.; Pressley, A. S.; Traynor, W. L.; Fitsanakis, V. A. Caenorhabditis Elegans Chronically Exposed to a Mn/Zn Ethylene-Bis-Dithiocarbamate Fungicide Show Mitochondrial Complex I Inhibition and Increased Reactive Oxygen Species. Neurotoxicology 2016, 56, 170–179. https://doi.org/10.1016/j.neuro.2016.07.011.
(146) Todt, C. E.; Bailey, D. C.; Pressley, A. S.; Orfield, S. E.; Denney, R. D.; Snapp, I. B.; Negga, R.; Bailey, A. C.; Montgomery, K. M.; Traynor, W. L.; Fitsanakis, V. A. Acute Exposure to a Mn/Zn Ethylene-Bis-Dithiocarbamate Fungicide Leads to Mitochondrial Dysfunction and Increased Reactive Oxygen Species Production in Caenorhabditis Elegans. Neurotoxicology 2016, 57, 112–120. https://doi.org/10.1016/j.neuro.2016.09.011.
(147) Briquet, M.; Sabadie-Pialoux, N.; Goffeau, A. Ziram, a Sulfhydryl Reagent and Specific Inhibitor of Yeast Mitochondrial Dehydrogenases. Arch. Biochem. Biophys. 1976, 174 (2), 684–694. https://doi.org/10.1016/0003-9861(76)90399-4.
(148) Li, Q.; Kobayashi, M.; Kawada, T. Ziram Induces Apoptosis and Necrosis in Human Immune Cells. Arch. Toxicol. 2011, 85 (4), 355–361. https://doi.org/10.1007/s00204-010-0586-9.
(149) Li, Q.; Kobayashi, M.; Kawada, T. Mechanism of Ziram-Induced Apoptosis in Human Natural Killer Cells. Int J Immunopathol Pharmacol 2012, 25 (4), 883–891. https://doi.org/10.1177/039463201202500406.
(150) Martin, C. A.; Myers, K. M.; Chen, A.; Martin, N. T.; Barajas, A.; Schweizer, F. E.; Krantz, D. E. Ziram, a Pesticide Associated with Increased Risk for Parkinson’s Disease, Differentially Affects the Presynaptic Function of Aminergic and Glutamatergic Nerve Terminals at the Drosophila Neuromuscular Junction. Exp Neurol 2016, 275 (0 1), 232–241. https://doi.org/10.1016/j.expneurol.2015.09.017.
(151) Béranger, R.; Billoir, E.; Nuckols, J. R.; Blain, J.; Millet, M.; Bayle, M.-L.; Combourieu, B.; Philip, T.; Schüz, J.; Fervers, B. Agricultural and Domestic Pesticides in House Dust from Different Agricultural Areas in France. Environ Sci Pollut Res Int 2019, 26 (19), 19632–19645. https://doi.org/10.1007/s11356-019-05313-9.
(152) Butenhoff, J. L.; Ehresman, D. J.; Chang, S.-C.; Parker, G. A.; Stump, D. G. Gestational and Lactational Exposure to Potassium Perfluorooctanesulfonate (K+PFOS) in Rats: Developmental Neurotoxicity. Reprod. Toxicol. 2009, 27 (3–4), 319–330. https://doi.org/10.1016/j.reprotox.2008.12.010.
(153) Butenhoff, J. L.; Bjork, J. A.; Chang, S.-C.; Ehresman, D. J.; Parker, G. A.; Das, K.; Lau, C.; Lieder, P. H.; van Otterdijk, F. M.; Wallace, K. B. Toxicological Evaluation of Ammonium Perfluorobutyrate in Rats: Twenty-Eight-Day and Ninety-Day Oral Gavage Studies. Reprod. Toxicol. 2012, 33 (4), 513–530. https://doi.org/10.1016/j.reprotox.2011.08.004.
(154) Belyaeva, E. A.; Sokolova, T. V.; Emelyanova, L. V.; Zakharova, I. O. Mitochondrial Electron Transport Chain in Heavy Metal-Induced Neurotoxicity: Effects of Cadmium, Mercury, and Copper. ScientificWorldJournal 2012, 2012. https://doi.org/10.1100/2012/136063.
(155) Belyaeva, E. A.; Dymkowska, D.; Wieckowski, M. R.; Wojtczak, L. Mitochondria as an Important Target in Heavy Metal Toxicity in Rat Hepatoma AS-30D Cells. Toxicol. Appl. Pharmacol. 2008, 231 (1), 34–42. https://doi.org/10.1016/j.taap.2008.03.017.
(156) Borchard, S.; Bork, F.; Rieder, T.; Eberhagen, C.; Popper, B.; Lichtmannegger, J.; Schmitt, S.; Adamski, J.; Klingenspor, M.; Weiss, K.-H.; Zischka, H. The Exceptional Sensitivity of Brain Mitochondria to Copper. Toxicol In Vitro 2018, 51, 11–22. https://doi.org/10.1016/j.tiv.2018.04.012.
(157) Isei, M. O.; Kamunde, C. Effects of Copper and Temperature on Heart Mitochondrial Hydrogen Peroxide Production. Free Radic. Biol. Med. 2020, 147, 114–128. https://doi.org/10.1016/j.freeradbiomed.2019.12.006.
(158) Zischka, H.; Lichtmannegger, J.; Schmitt, S.; Jägemann, N.; Schulz, S.; Wartini, D.; Jennen, L.; Rust, C.; Larochette, N.; Galluzzi, L.; Chajes, V.; Bandow, N.; Gilles, V. S.; DiSpirito, A. A.; Esposito, I.; Goettlicher, M.; Summer, K. H.; Kroemer, G. Liver Mitochondrial Membrane Crosslinking and Destruction in a Rat Model of Wilson Disease. J. Clin. Invest. 2011, 121 (4), 1508–1518. https://doi.org/10.1172/JCI45401.
(159) Zischka, H.; Lichtmannegger, J. Pathological Mitochondrial Copper Overload in Livers of Wilson’s Disease Patients and Related Animal Models. Ann. N. Y. Acad. Sci. 2014, 1315, 6–15. https://doi.org/10.1111/nyas.12347.
(160) Spiller, H. A. Rethinking Mercury: The Role of Selenium in the Pathophysiology of Mercury Toxicity. Clin Toxicol (Phila) 2018, 56 (5), 313–326. https://doi.org/10.1080/15563650.2017.1400555.
(161) Lund, B. O.; Miller, D. M.; Woods, J. S. Mercury-Induced H2O2 Production and Lipid Peroxidation in Vitro in Rat Kidney Mitochondria. Biochem. Pharmacol. 1991, 42 Suppl, S181-187. https://doi.org/10.1016/0006-2952(91)90408-w.
(162) Lund, B. O.; Miller, D. M.; Woods, J. S. Studies on Hg(II)-Induced H2O2 Formation and Oxidative Stress in Vivo and in Vitro in Rat Kidney Mitochondria. Biochem. Pharmacol. 1993, 45 (10), 2017–2024. https://doi.org/10.1016/0006-2952(93)90012-l.
(163) Dua, R.; Sunkaria, A.; Kumar, V.; Gill, K. D. Impaired Mitochondrial Energy Metabolism and Kinetic Properties of Cytochrome Oxidase Following Acute Aluminium Phosphide Exposure in Rat Liver. Food Chem. Toxicol. 2010, 48 (1), 53–60. https://doi.org/10.1016/j.fct.2009.09.014.
(164) Ohlsson, L.; Exley, C.; Darabi, A.; Sandén, E.; Siesjö, P.; Eriksson, H. Aluminium Based Adjuvants and Their Effects on Mitochondria and Lysosomes of Phagocytosing Cells. J. Inorg. Biochem. 2013, 128, 229–236. https://doi.org/10.1016/j.jinorgbio.2013.08.003.
(165) Iglesias-González, J.; Sánchez-Iglesias, S.; Beiras-Iglesias, A.; Méndez-Álvarez, E.; Soto-Otero, R. Effects of Aluminium on Rat Brain Mitochondria Bioenergetics: An In Vitro and In Vivo Study. Mol. Neurobiol. 2017, 54 (1), 563–570. https://doi.org/10.1007/s12035-015-9650-z.
(166) Arab-Nozari, M.; Zamani, E.; Latifi, A.; Shaki, F. Mitochondrial Toxicity of Aluminium Nanoparticles in Comparison to Its Ionic Form on Isolated Rat Brain Mitochondria. Bratisl Lek Listy 2019, 120 (7), 516–522. https://doi.org/10.4149/BLL_2019_083.
(167) Swegert, C. V.; Dave, K. R.; Katyare, S. S. Effect of Aluminium-Induced Alzheimer like Condition on Oxidative Energy Metabolism in Rat Liver, Brain and Heart Mitochondria. Mech. Ageing Dev. 1999, 112 (1), 27–42. https://doi.org/10.1016/s0047-6374(99)00051-2.
(168) Larsen, P. A.; Lutz, M. W.; Hunnicutt, K. E.; Mihovilovic, M.; Saunders, A. M.; Yoder, A. D.; Roses, A. D. The Alu Neurodegeneration Hypothesis: A Primate-Specific Mechanism for Neuronal Transcription Noise, Mitochondrial Dysfunction, and Manifestation of Neurodegenerative Disease. Alzheimers Dement 2017, 13 (7), 828–838. https://doi.org/10.1016/j.jalz.2017.01.017.
(169) Suzuki, S.; Arnold, L. L.; Muirhead, D.; Lu, X.; Le, X. C.; Bjork, J. A.; Wallace, K. B.; Ohnishi, T.; Kakiuchi-Kiyota, S.; Pennington, K. L.; Cohen, S. M. Inorganic Arsenic-Induced Intramitochondrial Granules in Mouse Urothelium. Toxicol Pathol 2008, 36 (7), 999–1005. https://doi.org/10.1177/0192623308327408.
(170) Gobe, G.; Crane, D. Mitochondria, Reactive Oxygen Species and Cadmium Toxicity in the Kidney. Toxicol. Lett. 2010, 198 (1), 49–55. https://doi.org/10.1016/j.toxlet.2010.04.013.
(171) Mao, W. P.; Zhang, N. N.; Zhou, F. Y.; Li, W. X.; Liu, H. Y.; Feng, J.; Zhou, L.; Wei, C. J.; Pan, Y. B.; He, Z. J. Cadmium Directly Induced Mitochondrial Dysfunction of Human Embryonic Kidney Cells. Hum Exp Toxicol 2011, 30 (8), 920–929. https://doi.org/10.1177/0960327110384286.
(172) Okoye, C. N.; MacDonald-Jay, N.; Kamunde, C. Effects of Bioenergetics, Temperature and Cadmium on Liver Mitochondria Reactive Oxygen Species Production and Consumption. Aquat. Toxicol. 2019, 214, 105264. https://doi.org/10.1016/j.aquatox.2019.105264.
(173) Ashok, I.; Sheeladevi, R. Biochemical Responses and Mitochondrial Mediated Activation of Apoptosis on Long-Term Effect of Aspartame in Rat Brain. Redox Biol 2014, 2, 820–831. https://doi.org/10.1016/j.redox.2014.04.011.
(174) Qu, D.; Jiang, M.; Huang, D.; Zhang, H.; Feng, L.; Chen, Y.; Zhu, X.; Wang, S.; Han, J. Synergistic Effects of The Enhancements to Mitochondrial ROS, P53 Activation and Apoptosis Generated by Aspartame and Potassium Sorbate in HepG2 Cells. Molecules 2019, 24 (3). https://doi.org/10.3390/molecules24030457.
(175) Singh, R. K.; Ishikawa, S. Food Additive P-80 Impacts Mouse Gut Microbiota Promoting Intestinal Inflammation, Obesity and Liver Dysfunction. SOJ Microbiol Infect Dis 2016, 4 (1).
(176) Melnick, R. L.; Schiller, C. M. Mitochondrial Toxicity of Phthalate Esters. Environ. Health Perspect. 1982, 45, 51–56. https://doi.org/10.1289/ehp.824551.
(177) Lu, Y.; Wang, Y.-Y.; Yang, N.; Zhang, D.; Zhang, F.-Y.; Gao, H.-T.; Rong, W.-T.; Yu, S.-Q.; Xu, Q. Food Emulsifier Polysorbate 80 Increases Intestinal Absorption of Di-(2-Ethylhexyl) Phthalate in Rats. Toxicol. Sci. 2014, 139 (2), 317–327. https://doi.org/10.1093/toxsci/kfu055.
(178) Moon, M. K.; Kim, M. J.; Jung, I. K.; Koo, Y. D.; Ann, H. Y.; Lee, K. J.; Kim, S. H.; Yoon, Y. C.; Cho, B.-J.; Park, K. S.; Jang, H. C.; Park, Y. J. Bisphenol A Impairs Mitochondrial Function in the Liver at Doses below the No Observed Adverse Effect Level. J. Korean Med. Sci. 2012, 27 (6), 644–652. https://doi.org/10.3346/jkms.2012.27.6.644.
(179) Qu, W.; Zhao, Z.; Chen, S.; Zhang, L.; Wu, D.; Chen, Z. Bisphenol A Suppresses Proliferation and Induces Apoptosis in Colonic Epithelial Cells through Mitochondrial and MAPK/AKT Pathways. Life Sci. 2018, 208, 167–174. https://doi.org/10.1016/j.lfs.2018.07.040.
(180) Wang, K.; Zhao, Z.; Ji, W. Bisphenol A Induces Apoptosis, Oxidative Stress and Inflammatory Response in Colon and Liver of Mice in a Mitochondria-Dependent Manner. Biomed. Pharmacother. 2019, 117, 109182. https://doi.org/10.1016/j.biopha.2019.109182.
(181) Zhao, Z.; Qu, W.; Wang, K.; Chen, S.; Zhang, L.; Wu, D.; Chen, Z. Bisphenol A Inhibits Mucin 2 Secretion in Intestinal Goblet Cells through Mitochondrial Dysfunction and Oxidative Stress. Biomed. Pharmacother. 2019, 111, 901–908. https://doi.org/10.1016/j.biopha.2019.01.007.
(182) Xu, J.; Huang, G.; Guo, T. L. Developmental Bisphenol A Exposure Modulates Immune-Related Diseases. Toxics 2016, 4 (4). https://doi.org/10.3390/toxics4040023.
(183) Biswas, G.; Srinivasan, S.; Anandatheerthavarada, H. K.; Avadhani, N. G. Dioxin-Mediated Tumor Progression through Activation of Mitochondria-to-Nucleus Stress Signaling. Proc Natl Acad Sci U S A 2008, 105 (1), 186–191. https://doi.org/10.1073/pnas.0706183104.
(184) Hwang, H. J.; Dornbos, P.; Steidemann, M.; Dunivin, T. K.; Rizzo, M.; LaPres, J. J. Mitochondrial-Targeted Aryl Hydrocarbon Receptor and the Impact of 2,3,7,8-Tetrachlorodibenzo-p-Dioxin on Cellular Respiration and the Mitochondrial Proteome. Toxicology and Applied Pharmacology 2016, 304, 121–132. https://doi.org/10.1016/j.taap.2016.04.005.
(185) Shen, K.; Shen, C.; Yu, J.; Yu, C.; Chen, L.; Shi, D.; Chen, Y. PCB Congeners Induced Mitochondrial Dysfunction in Vero Cells. J. Hazard. Mater. 2011, 185 (1), 24–28. https://doi.org/10.1016/j.jhazmat.2010.08.061.
(186) Cocco, S.; Secondo, A.; Del Viscovo, A.; Procaccini, C.; Formisano, L.; Franco, C.; Esposito, A.; Scorziello, A.; Matarese, G.; Di Renzo, G.; Canzoniero, L. M. T. Polychlorinated Biphenyls Induce Mitochondrial Dysfunction in SH-SY5Y Neuroblastoma Cells. PLoS One 2015, 10 (6). https://doi.org/10.1371/journal.pone.0129481.
(187) Hoek, J. B.; Cahill, A.; Pastorino, J. G. Alcohol and Mitochondria: A Dysfunctional Relationship. Gastroenterology 2002, 122 (7), 2049–2063. https://doi.org/10.1053/gast.2002.33613.
(188) Manzo-Avalos, S.; Saavedra-Molina, A. Cellular and Mitochondrial Effects of Alcohol Consumption. Int J Environ Res Public Health 2010, 7 (12), 4281–4304. https://doi.org/10.3390/ijerph7124281.
(189) Agarwal, D. P. Genetic Polymorphisms of Alcohol Metabolizing Enzymes. Pathol. Biol. 2001, 49 (9), 703–709. https://doi.org/10.1016/s0369-8114(01)00242-5.
(190) George, A.; Figueredo, V. M. Alcohol and Arrhythmias: A Comprehensive Review. J Cardiovasc Med (Hagerstown) 2010, 11 (4), 221–228. https://doi.org/10.2459/JCM.0b013e328334b42d.
(191) Mansouri, A.; Demeilliers, C.; Amsellem, S.; Pessayre, D.; Fromenty, B. Acute Ethanol Administration Oxidatively Damages and Depletes Mitochondrial Dna in Mouse Liver, Brain, Heart, and Skeletal Muscles: Protective Effects of Antioxidants. J. Pharmacol. Exp. Ther. 2001, 298 (2), 737–743.
(192) Piano, M. R. Alcohol’s Effects on the Cardiovascular System. Alcohol Res 2017, 38 (2), 219–241.
(193) Bukiya, A. N. Fetal Cerebral Artery Mitochondrion as Target of Prenatal Alcohol Exposure. Int J Environ Res Public Health 2019, 16 (9). https://doi.org/10.3390/ijerph16091586.
(194) Tapia-Rojas, C.; Mira, R. G.; Torres, A. K.; Jara, C.; Pérez, M. J.; Vergara, E. H.; Cerpa, W.; Quintanilla, R. A. Alcohol Consumption during Adolescence: A Link between Mitochondrial Damage and Ethanol Brain Intoxication. Birth Defects Res 2017, 109 (20), 1623–1639. https://doi.org/10.1002/bdr2.1172.
(195) Lanza, I. R.; Short, D. K.; Short, K. R.; Raghavakaimal, S.; Basu, R.; Joyner, M. J.; McConnell, J. P.; Nair, K. S. Endurance Exercise as a Countermeasure for Aging. Diabetes 2008, 57 (11), 2933–2942. https://doi.org/10.2337/db08-0349.
(196) Joseph, A.-M.; Adhihetty, P. J.; Buford, T. W.; Wohlgemuth, S. E.; Lees, H. A.; Nguyen, L. M.-D.; Aranda, J. M.; Sandesara, B. D.; Pahor, M.; Manini, T. M.; Marzetti, E.; Leeuwenburgh, C. The Impact of Aging on Mitochondrial Function and Biogenesis Pathways in Skeletal Muscle of Sedentary High- and Low-Functioning Elderly Individuals. Aging Cell 2012, 11 (5), 801–809. https://doi.org/10.1111/j.1474-9726.2012.00844.x.
(197) Macinnis, M.; Gibala, M. Physiological Adaptations to Interval Training and the Role of Exercise Intensity. The Journal of Physiology 2016, 595. https://doi.org/10.1113/JP273196.
(198) Memme, J. M.; Erlich, A. T.; Phukan, G.; Hood, D. A. Exercise and Mitochondrial Health. J. Physiol. (Lond.) 2019. https://doi.org/10.1113/JP278853.
(199) Gradari, S.; Pallé, A.; McGreevy, K. R.; Fontán-Lozano, Á.; Trejo, J. L. Can Exercise Make You Smarter, Happier, and Have More Neurons? A Hormetic Perspective. Front Neurosci 2016, 10, 93. https://doi.org/10.3389/fnins.2016.00093.
(200) Chomentowski, P.; Dubé, J. J.; Amati, F.; Stefanovic-Racic, M.; Zhu, S.; Toledo, F. G. S.; Goodpaster, B. H. Moderate Exercise Attenuates the Loss of Skeletal Muscle Mass That Occurs with Intentional Caloric Restriction-Induced Weight Loss in Older, Overweight to Obese Adults. J. Gerontol. A Biol. Sci. Med. Sci. 2009, 64 (5), 575–580. https://doi.org/10.1093/gerona/glp007.
(201) Zhang, J.; Ma, J.; Wang, G.-F. Effects of long-term sleep deprivation on mitochondria stress in locus coeruleus and the tyrosine hydroxylasic projection in mice. Zhongguo Ying Yong Sheng Li Xue Za Zhi 2014, 30 (2), 153–156.
(202) Weir, H. J. M.; Murray, T. K.; Kehoe, P. G.; Love, S.; Verdin, E. M.; O’Neill, M. J.; Lane, J. D.; Balthasar, N. CNS SIRT3 Expression Is Altered by Reactive Oxygen Species and in Alzheimer’s Disease. PLoS One 2012, 7 (11). https://doi.org/10.1371/journal.pone.0048225.
(203) Nogueiras, R.; Habegger, K. M.; Chaudhary, N.; Finan, B.; Banks, A. S.; Dietrich, M. O.; Horvath, T. L.; Sinclair, D. A.; Pfluger, P. T.; Tschöop, M. H. Sirtuin 1 and Sirtuin 3: Physiological Modulators of Metabolism. Physiol Rev 2012, 92 (3), 1479–1514. https://doi.org/10.1152/physrev.00022.2011.
(204) Lucas, R. J.; Lall, G. S.; Allen, A. E.; Brown, T. M. How Rod, Cone, and Melanopsin Photoreceptors Come Together to Enlighten the Mammalian Circadian Clock. Prog. Brain Res. 2012, 199, 1–18. https://doi.org/10.1016/B978-0-444-59427-3.00001-0.
(205) Peres, M. F. P.; Zukerman, E.; da Cunha Tanuri, F.; Moreira, F. R.; Cipolla-Neto, J. Melatonin, 3 Mg, Is Effective for Migraine Prevention. Neurology 2004, 63 (4), 757. https://doi.org/10.1212/01.wnl.0000134653.35587.24.
(206) Ulugol, A.; Dokmeci, D.; Guray, G.; Sapolyo, N.; Ozyigit, F.; Tamer, M. Antihyperalgesic, but Not Antiallodynic, Effect of Melatonin in Nerve-Injured Neuropathic Mice: Possible Involvements of the L-Arginine-NO Pathway and Opioid System. Life Sci. 2006, 78 (14), 1592–1597. https://doi.org/10.1016/j.lfs.2005.07.002.
(207) Pringsheim, T.; Magnoux, E.; Dobson, C. F.; Hamel, E.; Aubé, M. Melatonin as Adjunctive Therapy in the Prophylaxis of Cluster Headache: A Pilot Study. Headache 2002, 42 (8), 787–792. https://doi.org/10.1046/j.1526-4610.2002.02181.x.
(208) Medrano-Campillo, P.; Sarmiento-Soto, H.; Álvarez-Sánchez, N.; Álvarez-Ríos, A. I.; Guerrero, J. M.; Rodríguez-Prieto, I.; Castillo-Palma, M. J.; Lardone, P. J.; Carrillo-Vico, A. Evaluation of the Immunomodulatory Effect of Melatonin on the T-Cell Response in Peripheral Blood from Systemic Lupus Erythematosus Patients. J. Pineal Res. 2015, 58 (2), 219–226. https://doi.org/10.1111/jpi.12208.
(209) Sanchez-Barcelo, E. J.; Rueda, N.; Mediavilla, M. D.; Martinez-Cue, C.; Reiter, R. J. Clinical Uses of Melatonin in Neurological Diseases and Mental and Behavioural Disorders. Curr. Med. Chem. 2017, 24 (35), 3851–3878. https://doi.org/10.2174/0929867324666170718105557.
(210) Weishaupt, J. H.; Bartels, C.; Pölking, E.; Dietrich, J.; Rohde, G.; Poeggeler, B.; Mertens, N.; Sperling, S.; Bohn, M.; Hüther, G.; Schneider, A.; Bach, A.; Sirén, A.-L.; Hardeland, R.; Bähr, M.; Nave, K.-A.; Ehrenreich, H. Reduced Oxidative Damage in ALS by High-Dose Enteral Melatonin Treatment. J. Pineal Res. 2006, 41 (4), 313–323. https://doi.org/10.1111/j.1600-079X.2006.00377.x.
(211) English, J.; Bojkowski, C. J.; Poulton, A. L.; Symons, A. M.; Arendt, J. Metabolism and Pharmacokinetics of Melatonin in the Ewe. J. Pineal Res. 1987, 4 (4), 351–358. https://doi.org/10.1111/j.1600-079x.1987.tb00874.x.
(212) Iguchi, H.; Kato, K. I.; Ibayashi, H. Melatonin Serum Levels and Metabolic Clearance Rate in Patients with Liver Cirrhosis. J. Clin. Endocrinol. Metab. 1982, 54 (5), 1025–1027. https://doi.org/10.1210/jcem-54-5-1025.
(213) Wade, A. G.; Ford, I.; Crawford, G.; McMahon, A. D.; Nir, T.; Laudon, M.; Zisapel, N. Efficacy of Prolonged Release Melatonin in Insomnia Patients Aged 55-80 Years: Quality of Sleep and next-Day Alertness Outcomes. Curr Med Res Opin 2007, 23 (10), 2597–2605. https://doi.org/10.1185/030079907X233098.
(214) Luthringer, R.; Muzet, M.; Zisapel, N.; Staner, L. The Effect of Prolonged-Release Melatonin on Sleep Measures and Psychomotor Performance in Elderly Patients with Insomnia. Int Clin Psychopharmacol 2009, 24 (5), 239–249. https://doi.org/10.1097/YIC.0b013e32832e9b08.
(215) Claustrat, B.; Brun, J.; Chazot, G. The Basic Physiology and Pathophysiology of Melatonin. Sleep Med Rev 2005, 9 (1), 11–24. https://doi.org/10.1016/j.smrv.2004.08.001.
(216) Lemoine, P.; Nir, T.; Laudon, M.; Zisapel, N. Prolonged-Release Melatonin Improves Sleep Quality and Morning Alertness in Insomnia Patients Aged 55 Years and Older and Has No Withdrawal Effects. J Sleep Res 2007, 16 (4), 372–380. https://doi.org/10.1111/j.1365-2869.2007.00613.x.
(217) Picard, M.; McEwen, B. S. Psychological Stress and Mitochondria: A Systematic Review. Psychosom Med 2018, 80 (2), 141–153. https://doi.org/10.1097/PSY.0000000000000545.
(218) Picard, M.; McEwen, B. S. Psychological Stress and Mitochondria: A Conceptual Framework. Psychosom Med 2018, 80 (2), 126–140. https://doi.org/10.1097/PSY.0000000000000544.
(219) Picard, M.; Juster, R.-P.; McEwen, B. S. Mitochondrial Allostatic Load Puts the “gluc” Back in Glucocorticoids. Nat Rev Endocrinol 2014, 10 (5), 303–310. https://doi.org/10.1038/nrendo.2014.22.
(220) Markham, A.; Bains, R.; Franklin, P.; Spedding, M. Changes in Mitochondrial Function Are Pivotal in Neurodegenerative and Psychiatric Disorders: How Important Is BDNF? Br. J. Pharmacol. 2014, 171 (8), 2206–2229. https://doi.org/10.1111/bph.12531.
(221) Bose, H. S.; Lingappa, V. R.; Miller, W. L. Rapid Regulation of Steroidogenesis by Mitochondrial Protein Import. Nature 2002, 417 (6884), 87–91. https://doi.org/10.1038/417087a.
(222) Midzak, A.; Papadopoulos, V. Adrenal Mitochondria and Steroidogenesis: From Individual Proteins to Functional Protein Assemblies. Front Endocrinol (Lausanne) 2016, 7, 106. https://doi.org/10.3389/fendo.2016.00106.
(223) Inczedy-Farkas, G.; Remenyi, V.; Gal, A.; Varga, Z.; Balla, P.; Udvardy-Meszaros, A.; Bereznai, B.; Molnar, M. J. Psychiatric Symptoms of Patients with Primary Mitochondrial DNA Disorders. Behav Brain Funct 2012, 8, 9. https://doi.org/10.1186/1744-9081-8-9.
(224) Toker, L.; Agam, G. Mitochondrial Dysfunction in Psychiatric Morbidity: Current Evidence and Therapeutic Prospects. Neuropsychiatr Dis Treat 2015, 11, 2441–2447. https://doi.org/10.2147/NDT.S70346.
(225) Manji, H.; Kato, T.; Di Prospero, N. A.; Ness, S.; Beal, M. F.; Krams, M.; Chen, G. Impaired Mitochondrial Function in Psychiatric Disorders. Nat. Rev. Neurosci. 2012, 13 (5), 293–307. https://doi.org/10.1038/nrn3229.
(226) Gardner, A.; Boles, R. G. Beyond the Serotonin Hypothesis: Mitochondria, Inflammation and Neurodegeneration in Major Depression and Affective Spectrum Disorders. Prog. Neuropsychopharmacol. Biol. Psychiatry 2011, 35 (3), 730–743. https://doi.org/10.1016/j.pnpbp.2010.07.030.
(227) Kaplan, B. The Emerging Field of Nutritional Mental Health: Inflammation, the Microbiome, Oxidative Stress, and Mitochondrial Function. Clnical Psychological Science 2015. https://doi.org/10.1177/2167702614555413.
(228) Morris, G.; Berk, M. The Many Roads to Mitochondrial Dysfunction in Neuroimmune and Neuropsychiatric Disorders. BMC Med 2015, 13, 68. https://doi.org/10.1186/s12916-015-0310-y.
(229) Picard, M.; McManus, M. J.; Gray, J. D.; Nasca, C.; Moffat, C.; Kopinski, P. K.; Seifert, E. L.; McEwen, B. S.; Wallace, D. C. Mitochondrial Functions Modulate Neuroendocrine, Metabolic, Inflammatory, and Transcriptional Responses to Acute Psychological Stress. Proc. Natl. Acad. Sci. U.S.A. 2015, 112 (48), E6614-6623. https://doi.org/10.1073/pnas.1515733112.
(230) Valenti, D.; de Bari, L.; De Filippis, B.; Henrion-Caude, A.; Vacca, R. A. Mitochondrial Dysfunction as a Central Actor in Intellectual Disability-Related Diseases: An Overview of Down Syndrome, Autism, Fragile X and Rett Syndrome. Neurosci Biobehav Rev 2014, 46 Pt 2, 202–217. https://doi.org/10.1016/j.neubiorev.2014.01.012.
(231) Bhasin, M. K.; Dusek, J. A.; Chang, B.-H.; Joseph, M. G.; Denninger, J. W.; Fricchione, G. L.; Benson, H.; Libermann, T. A. Relaxation Response Induces Temporal Transcriptome Changes in Energy Metabolism, Insulin Secretion and Inflammatory Pathways. PLoS ONE 2013, 8 (5), e62817. https://doi.org/10.1371/journal.pone.0062817.
(232) Kim, J.-H.; Kim, H. K.; Ko, J.-H.; Bang, H.; Lee, D.-C. The Relationship between Leukocyte Mitochondrial DNA Copy Number and Telomere Length in Community-Dwelling Elderly Women. PLoS ONE 2013, 8 (6), e67227. https://doi.org/10.1371/journal.pone.0067227.
(233) Wang, H.; Olivero, W.; Wang, D.; Lanzino, G. Cold as a Therapeutic Agent. Acta Neurochir (Wien) 2006, 148 (5), 565–570; discussion 569-570. https://doi.org/10.1007/s00701-006-0747-z.
(234) Auer, R. N. Non-Pharmacologic (Physiologic) Neuroprotection in the Treatment of Brain Ischemia. Ann. N. Y. Acad. Sci. 2001, 939, 271–282. https://doi.org/10.1111/j.1749-6632.2001.tb03635.x.
(235) Hayashi, N.; Dietrich, D. W. Brain Hypothermia Treatment; Springer Japan, 2004. https://doi.org/10.1007/978-4-431-53953-7.
(236) Weglinski, M. R. Therapeutic Hypothermia. Anesthesiology 2005, 103 (3), 673–674.
(237) Polderman, K. H. Induced Hypothermia and Fever Control for Prevention and Treatment of Neurological Injuries. Lancet 2008, 371 (9628), 1955–1969. https://doi.org/10.1016/S0140-6736(08)60837-5.
(238) Polderman, K. H.; Herold, I. Therapeutic Hypothermia and Controlled Normothermia in the Intensive Care Unit: Practical Considerations, Side Effects, and Cooling Methods. Crit. Care Med. 2009, 37 (3), 1101–1120. https://doi.org/10.1097/CCM.0b013e3181962ad5.
(239) Polderman, K. Mechanisms of Action, Physiological Effects, and Complications of Hypothermia. Critical care medicine 2009, 37, S186-202. https://doi.org/10.1097/CCM.0b013e3181aa5241.
(240) Bernard, S. A.; Gray, T. W.; Buist, M. D.; Jones, B. M.; Silvester, W.; Gutteridge, G.; Smith, K. Treatment of Comatose Survivors of Out-of-Hospital Cardiac Arrest with Induced Hypothermia. N. Engl. J. Med. 2002, 346 (8), 557–563. https://doi.org/10.1056/NEJMoa003289.
(241) Hypothermia after Cardiac Arrest Study Group. Mild Therapeutic Hypothermia to Improve the Neurologic Outcome after Cardiac Arrest. N. Engl. J. Med. 2002, 346 (8), 549–556. https://doi.org/10.1056/NEJMoa012689.
(242) Eicher, D. J.; Wagner, C. L.; Katikaneni, L. P.; Hulsey, T. C.; Bass, W. T.; Kaufman, D. A.; Horgan, M. J.; Languani, S.; Bhatia, J. J.; Givelichian, L. M.; Sankaran, K.; Yager, J. Y. Moderate Hypothermia in Neonatal Encephalopathy: Efficacy Outcomes. Pediatr. Neurol. 2005, 32 (1), 11–17. https://doi.org/10.1016/j.pediatrneurol.2004.06.014.
(243) Gluckman, P. D.; Wyatt, J. S.; Azzopardi, D.; Ballard, R.; Edwards, A. D.; Ferriero, D. M.; Polin, R. A.; Robertson, C. M.; Thoresen, M.; Whitelaw, A.; Gunn, A. J. Selective Head Cooling with Mild Systemic Hypothermia after Neonatal Encephalopathy: Multicentre Randomised Trial. Lancet 2005, 365 (9460), 663–670. https://doi.org/10.1016/S0140-6736(05)17946-X.
(244) Shankaran, S.; Laptook, A. R.; Ehrenkranz, R. A.; Tyson, J. E.; McDonald, S. A.; Donovan, E. F.; Fanaroff, A. A.; Poole, W. K.; Wright, L. L.; Higgins, R. D.; Finer, N. N.; Carlo, W. A.; Duara, S.; Oh, W.; Cotten, C. M.; Stevenson, D. K.; Stoll, B. J.; Lemons, J. A.; Guillet, R.; Jobe, A. H.; National Institute of Child Health and Human Development Neonatal Research Network. Whole-Body Hypothermia for Neonates with Hypoxic-Ischemic Encephalopathy. N. Engl. J. Med. 2005, 353 (15), 1574–1584. https://doi.org/10.1056/NEJMcps050929.
(245) Shiozaki, T.; Hayakata, T.; Taneda, M.; Nakajima, Y.; Hashiguchi, N.; Fujimi, S.; Nakamori, Y.; Tanaka, H.; Shimazu, T.; Sugimoto, H. A Multicenter Prospective Randomized Controlled Trial of the Efficacy of Mild Hypothermia for Severely Head Injured Patients with Low Intracranial Pressure. Mild Hypothermia Study Group in Japan. J. Neurosurg. 2001, 94 (1), 50–54. https://doi.org/10.3171/jns.2001.94.1.0050.
(246) McIntyre, L. A.; Fergusson, D. A.; Hébert, P. C.; Moher, D.; Hutchison, J. S. Prolonged Therapeutic Hypothermia after Traumatic Brain Injury in Adults: A Systematic Review. JAMA 2003, 289 (22), 2992–2999. https://doi.org/10.1001/jama.289.22.2992.
(247) Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons; Joint Section on Neurotrauma and Critical Care, AANS/CNS; Bratton, S. L.; Chestnut, R. M.; Ghajar, J.; McConnell Hammond, F. F.; Harris, O. A.; Hartl, R.; Manley, G. T.; Nemecek, A.; Newell, D. W.; Rosenthal, G.; Schouten, J.; Shutter, L.; Timmons, S. D.; Ullman, J. S.; Videtta, W.; Wilberger, J. E.; Wright, D. W. Guidelines for the Management of Severe Traumatic Brain Injury. XIV. Hyperventilation. J. Neurotrauma 2007, 24 Suppl 1, S87-90. https://doi.org/10.1089/neu.2007.9982.
(248) Tong, G.; Krauss, A.; Mochner, J.; Wollersheim, S.; Soltani, P.; Berger, F.; Schmitt, K. R. L. Deep Hypothermia Therapy Attenuates LPS-Induced Microglia Neuroinflammation via the STAT3 Pathway. Neuroscience 2017, 358, 201–210. https://doi.org/10.1016/j.neuroscience.2017.06.055.
(249) Kuter, N.; Aysit-Altuncu, N.; Ozturk, G.; Ozek, E. The Neuroprotective Effects of Hypothermia on Bilirubin-Induced Neurotoxicity in Vitro. Neonatology 2018, 113 (4), 360–365. https://doi.org/10.1159/000487221.
(250) Barnes, B. M. Freeze Avoidance in a Mammal: Body Temperatures below 0 Degree C in an Arctic Hibernator. Science 1989, 244 (4912), 1593–1595. https://doi.org/10.1126/science.2740905.
(251) Bickler, P. E.; Buck, L. T. Hypoxia Tolerance in Reptiles, Amphibians, and Fishes: Life with Variable Oxygen Availability. Annu. Rev. Physiol. 2007, 69, 145–170. https://doi.org/10.1146/annurev.physiol.69.031905.162529.
(252) Peterson, B. L.; Larson, J.; Buffenstein, R.; Park, T. J.; Fall, C. P. Blunted Neuronal Calcium Response to Hypoxia in Naked Mole-Rat Hippocampus. PLoS ONE 2012, 7 (2), e31568. https://doi.org/10.1371/journal.pone.0031568.
(253) Larson, J.; Drew, K. L.; Folkow, L. P.; Milton, S. L.; Park, T. J. No Oxygen? No Problem! Intrinsic Brain Tolerance to Hypoxia in Vertebrates. J. Exp. Biol. 2014, 217 (Pt 7), 1024–1039. https://doi.org/10.1242/jeb.085381.
(254) Ali, S. S.; Hsiao, M.; Zhao, H. W.; Dugan, L. L.; Haddad, G. G.; Zhou, D. Hypoxia-Adaptation Involves Mitochondrial Metabolic Depression and Decreased ROS Leakage. PLoS ONE 2012, 7 (5), e36801. https://doi.org/10.1371/journal.pone.0036801.
(255) Hogg, D. W.; Pamenter, M. E.; Dukoff, D. J.; Buck, L. T. Decreases in Mitochondrial Reactive Oxygen Species Initiate GABA(A) Receptor-Mediated Electrical Suppression in Anoxia-Tolerant Turtle Neurons. J. Physiol. (Lond.) 2015, 593 (10), 2311–2326. https://doi.org/10.1113/JP270474.
(256) Pamenter, M. E.; Gomez, C. R.; Richards, J. G.; Milsom, W. K. Mitochondrial Responses to Prolonged Anoxia in Brain of Red-Eared Slider Turtles. Biol Lett 2016, 12 (1). https://doi.org/10.1098/rsbl.2015.0797.
(257) Prabhakar, N. R.; Semenza, G. L. Adaptive and Maladaptive Cardiorespiratory Responses to Continuous and Intermittent Hypoxia Mediated by Hypoxia-Inducible Factors 1 and 2. Physiol. Rev. 2012, 92 (3), 967–1003. https://doi.org/10.1152/physrev.00030.2011.
(258) Beall, C. M.; Brittenham, G. M.; Strohl, K. P.; Blangero, J.; Williams-Blangero, S.; Goldstein, M. C.; Decker, M. J.; Vargas, E.; Villena, M.; Soria, R.; Alarcon, A. M.; Gonzales, C. Hemoglobin Concentration of High-Altitude Tibetans and Bolivian Aymara. Am. J. Phys. Anthropol. 1998, 106 (3), 385–400. https://doi.org/10.1002/(SICI)1096-8644(199807)106:3<385::AID-AJPA10>3.0.CO;2-X.
(259) Beall, C. M.; Decker, M. J.; Brittenham, G. M.; Kushner, I.; Gebremedhin, A.; Strohl, K. P. An Ethiopian Pattern of Human Adaptation to High-Altitude Hypoxia. Proc. Natl. Acad. Sci. U.S.A. 2002, 99 (26), 17215–17218. https://doi.org/10.1073/pnas.252649199.
(260) Yin, H.; Blanchard, K. L. DNA Methylation Represses the Expression of the Human Erythropoietin Gene by Two Different Mechanisms. Blood 2000, 95 (1), 111–119.
(261) Ouellet, V.; Labbé, S. M.; Blondin, D. P.; Phoenix, S.; Guérin, B.; Haman, F.; Turcotte, E. E.; Richard, D.; Carpentier, A. C. Brown Adipose Tissue Oxidative Metabolism Contributes to Energy Expenditure during Acute Cold Exposure in Humans. J Clin Invest 2012, 122 (2), 545–552. https://doi.org/10.1172/JCI60433.
(262) Cypess, A. M.; Chen, Y.-C.; Sze, C.; Wang, K.; English, J.; Chan, O.; Holman, A. R.; Tal, I.; Palmer, M. R.; Kolodny, G. M.; Kahn, C. R. Cold but Not Sympathomimetics Activates Human Brown Adipose Tissue in Vivo. PNAS 2012, 109 (25), 10001–10005. https://doi.org/10.1073/pnas.1207911109.
(263) Lichtenbelt, W. van M.; Kingma, B.; van der Lans, A.; Schellen, L. Cold Exposure–an Approach to Increasing Energy Expenditure in Humans. Trends Endocrinol. Metab. 2014, 25 (4), 165–167. https://doi.org/10.1016/j.tem.2014.01.001.
(264) Koska, J.; Ksinantova, L.; Seböková, E.; Kvetnansky, R.; Klimes, I.; Chrousos, G.; Pacak, K. Endocrine Regulation of Subcutaneous Fat Metabolism during Cold Exposure in Humans. Ann. N. Y. Acad. Sci. 2002, 967, 500–505. https://doi.org/10.1111/j.1749-6632.2002.tb04308.x.
(265) Shibata, R.; Ouchi, N.; Murohara, T. Adiponectin and Cardiovascular Disease. Circ. J. 2009, 73 (4), 608–614. https://doi.org/10.1253/circj.cj-09-0057.
(266) Imbeault, P.; Dépault, I.; Haman, F. Cold Exposure Increases Adiponectin Levels in Men. Metab. Clin. Exp. 2009, 58 (4), 552–559. https://doi.org/10.1016/j.metabol.2008.11.017.
(267) Janský, L.; Pospísilová, D.; Honzová, S.; Ulicný, B.; Srámek, P.; Zeman, V.; Kamínková, J. Immune System of Cold-Exposed and Cold-Adapted Humans. Eur J Appl Physiol Occup Physiol 1996, 72 (5–6), 445–450. https://doi.org/10.1007/BF00242274.
(268) Girotti, M.; Donegan, J. J.; Morilak, D. A. Chronic Intermittent Cold Stress Sensitizes Neuro-Immune Reactivity in the Rat Brain. Psychoneuroendocrinology 2011, 36 (8), 1164–1174. https://doi.org/10.1016/j.psyneuen.2011.02.008.
(269) Girotti, M.; Donegan, J. J.; Morilak, D. A. Influence of Hypothalamic IL-6/Gp130 Receptor Signaling on the HPA Axis Response to Chronic Stress. Psychoneuroendocrinology 2013, 38 (7), 1158–1169. https://doi.org/10.1016/j.psyneuen.2012.11.004.
(270) Gagnon, D. D.; Gagnon, S. S.; Rintamäki, H.; Törmäkangas, T.; Puukka, K.; Herzig, K.-H.; Kyröläinen, H. The Effects of Cold Exposure on Leukocytes, Hormones and Cytokines during Acute Exercise in Humans. PLOS ONE 2014, 9 (10), e110774. https://doi.org/10.1371/journal.pone.0110774.
(271) Black, D. S.; Slavich, G. M. Mindfulness Meditation and the Immune System: A Systematic Review of Randomized Controlled Trials. Ann N Y Acad Sci 2016, 1373 (1), 13–24. https://doi.org/10.1111/nyas.12998.
(272) Thieringer, H. A.; Jones, P. G.; Inouye, M. Cold Shock and Adaptation. Bioessays 1998, 20 (1), 49–57. https://doi.org/10.1002/(SICI)1521-1878(199801)20:1<49::AID-BIES8>3.0.CO;2-N.
(273) Eglin, C. M.; Butt, G.; Howden, S.; Nash, T.; Costello, J. Rapid Habituation of the Cold Shock Response. Extrem Physiol Med 2015, 4 (Suppl 1), A38. https://doi.org/10.1186/2046-7648-4-S1-A38.
(274) Dorfman, M.; Ramirez, V. D.; Stener-Victorin, E.; Lara, H. E. Chronic-Intermittent Cold Stress in Rats Induces Selective Ovarian Insulin Resistance. Biol. Reprod. 2009, 80 (2), 264–271. https://doi.org/10.1095/biolreprod.108.070904.
(275) Wang, X.; Che, H.; Zhang, W.; Wang, J.; Ke, T.; Cao, R.; Meng, S.; Li, D.; Weiming, O.; Chen, J.; Luo, W. Effects of Mild Chronic Intermittent Cold Exposure on Rat Organs. Int J Biol Sci 2015, 11 (10), 1171–1180. https://doi.org/10.7150/ijbs.12161.
(276) Young, S.; Bolton, P.; Dyson, M.; Harvey, W.; Diamantopoulos, C. Macrophage Responsiveness to Light Therapy. Lasers Surg Med 1989, 9 (5), 497–505. https://doi.org/10.1002/lsm.1900090513.
(277) Lubart, R.; Friedmann, H.; Sinyakov, M.; Cohen, N.; Breitbart, H. Changes in Calcium Transport in Mammalian Sperm Mitochondria and Plasma Membranes Caused by 780 Nm Irradiation. Lasers Surg Med 1997, 21 (5), 493–499. https://doi.org/10.1002/(sici)1096-9101(1997)21:5<493::aid-lsm12>3.0.co;2-a.
(278) Agaiby, A. D.; Ghali, L. R.; Wilson, R.; Dyson, M. Laser Modulation of Angiogenic Factor Production by T-Lymphocytes. Lasers Surg Med 2000, 26 (4), 357–363. https://doi.org/10.1002/(sici)1096-9101(2000)26:4<357::aid-lsm3>3.0.co;2-o.
(279) Duan, R.; Liu, T. C.; Li, Y.; Guo, H.; Yao, L. B. Signal Transduction Pathways Involved in Low Intensity He-Ne Laser-Induced Respiratory Burst in Bovine Neutrophils: A Potential Mechanism of Low Intensity Laser Biostimulation. Lasers Surg Med 2001, 29 (2), 174–178. https://doi.org/10.1002/lsm.1106.
(280) Nussbaum, E. L.; Lilge, L.; Mazzulli, T. Effects of 810 Nm Laser Irradiation on in Vitro Growth of Bacteria: Comparison of Continuous Wave and Frequency Modulated Light. Lasers Surg Med 2002, 31 (5), 343–351. https://doi.org/10.1002/lsm.10121.
(281) Schindl, A.; Heinze, G.; Schindl, M.; Pernerstorfer-Schön, H.; Schindl, L. Systemic Effects of Low-Intensity Laser Irradiation on Skin Microcirculation in Patients with Diabetic Microangiopathy. Microvasc. Res. 2002, 64 (2), 240–246. https://doi.org/10.1006/mvre.2002.2429.
(282) Schindl, A.; Merwald, H.; Schindl, L.; Kaun, C.; Wojta, J. Direct Stimulatory Effect of Low-Intensity 670 Nm Laser Irradiation on Human Endothelial Cell Proliferation. Br. J. Dermatol. 2003, 148 (2), 334–336. https://doi.org/10.1046/j.1365-2133.2003.05070.x.
(283) Borzabadi-Farahani, A. Effect of Low-Level Laser Irradiation on Proliferation of Human Dental Mesenchymal Stem Cells; a Systemic Review. J. Photochem. Photobiol. B, Biol. 2016, 162, 577–582. https://doi.org/10.1016/j.jphotobiol.2016.07.022.
(284) Karu, T.; Pyatibrat, L.; Kalendo, G. Irradiation with He-Ne Laser Increases ATP Level in Cells Cultivated in Vitro. J. Photochem. Photobiol. B, Biol. 1995, 27 (3), 219–223. https://doi.org/10.1016/1011-1344(94)07078-3.
(285) Pastore, D.; Di Martino, C.; Bosco, G.; Passarella, S. Stimulation of ATP Synthesis via Oxidative Phosphorylation in Wheat Mitochondria Irradiated with Helium-Neon Laser. Biochem. Mol. Biol. Int. 1996, 39 (1), 149–157. https://doi.org/10.1080/15216549600201151.
(286) Karu, T. Primary and Secondary Mechanisms of Action of Visible to Near-IR Radiation on Cells. J. Photochem. Photobiol. B, Biol. 1999, 49 (1), 1–17. https://doi.org/10.1016/S1011-1344(98)00219-X.
(287) Karu, T. I.; Pyatibrat, L. V.; Kalendo, G. S. Cell Attachment to Extracellular Matrices Is Modulated by Pulsed Radiation at 820 Nm and Chemicals That Modify the Activity of Enzymes in the Plasma Membrane. Lasers Surg Med 2001, 29 (3), 274–281. https://doi.org/10.1002/lsm.1119.
(288) Hamblin, M. R. Mechanisms and Mitochondrial Redox Signaling in Photobiomodulation. Photochem. Photobiol. 2018, 94 (2), 199–212. https://doi.org/10.1111/php.12864.
(289) Lima, P. L. V.; Pereira, C. V.; Nissanka, N.; Arguello, T.; Gavini, G.; Maranduba, C. M. da C.; Diaz, F.; Moraes, C. T. Photobiomodulation Enhancement of Cell Proliferation at 660 nm Does Not Require Cytochrome c Oxidase. J. Photochem. Photobiol. B, Biol. 2019, 194, 71–75. https://doi.org/10.1016/j.jphotobiol.2019.03.015.
(290) Slominski, A.; Pawelek, J. Animals under the Sun: Effects of Ultraviolet Radiation on Mammalian Skin. Clin. Dermatol. 1998, 16 (4), 503–515. https://doi.org/10.1016/s0738-081x(98)00023-6.
(291) Karu, T. I.; Pyatibrat, L. V.; Kolyakov, S. F.; Afanasyeva, N. I. Absorption Measurements of a Cell Monolayer Relevant to Phototherapy: Reduction of Cytochrome c Oxidase under near IR Radiation. J. Photochem. Photobiol. B, Biol. 2005, 81 (2), 98–106. https://doi.org/10.1016/j.jphotobiol.2005.07.002.
(292) Tiphlova, O.; Karu, T. Action of Low-Intensity Laser Radiation on Escherichia Coli. Crit Rev Biomed Eng 1991, 18 (6), 387–412.
(293) Morimoto, Y.; Arai, T.; Kikuchi, M.; Nakajima, S.; Nakamura, H. Effect of Low-Intensity Argon Laser Irradiation on Mitochondrial Respiration. Lasers Surg Med 1994, 15 (2), 191–199. https://doi.org/10.1002/lsm.1900150207.
(294) Pastore, D.; Greco, M.; Passarella, S. Specific Helium-Neon Laser Sensitivity of the Purified Cytochrome c Oxidase. Int. J. Radiat. Biol. 2000, 76 (6), 863–870. https://doi.org/10.1080/09553000050029020.
(295) Eells, J. T.; Henry, M. M.; Summerfelt, P.; Wong-Riley, M. T. T.; Buchmann, E. V.; Kane, M.; Whelan, N. T.; Whelan, H. T. Therapeutic Photobiomodulation for Methanol-Induced Retinal Toxicity. Proc. Natl. Acad. Sci. U.S.A. 2003, 100 (6), 3439–3444. https://doi.org/10.1073/pnas.0534746100.
(296) Karu, T. I.; Pyatibrat, L. V.; Ryabykh, T. P. Melatonin Modulates the Action of near Infrared Radiation on Cell Adhesion. J. Pineal Res. 2003, 34 (3), 167–172. https://doi.org/10.1034/j.1600-079x.2003.00023.x.
(297) Karu, T. I.; Pyatibrat, L. V.; Kalendo, G. S. Photobiological Modulation of Cell Attachment via Cytochrome c Oxidase. Photochem. Photobiol. Sci. 2004, 3 (2), 211–216. https://doi.org/10.1039/b306126d.
(298) Eells, J. T.; Wong-Riley, M. T. T.; VerHoeve, J.; Henry, M.; Buchman, E. V.; Kane, M. P.; Gould, L. J.; Das, R.; Jett, M.; Hodgson, B. D.; Margolis, D.; Whelan, H. T. Mitochondrial Signal Transduction in Accelerated Wound and Retinal Healing by Near-Infrared Light Therapy. Mitochondrion 2004, 4 (5–6), 559–567. https://doi.org/10.1016/j.mito.2004.07.033.
(299) Wong-Riley, M. T. T.; Liang, H. L.; Eells, J. T.; Chance, B.; Henry, M. M.; Buchmann, E.; Kane, M.; Whelan, H. T. Photobiomodulation Directly Benefits Primary Neurons Functionally Inactivated by Toxins: Role of Cytochrome c Oxidase. J. Biol. Chem. 2005, 280 (6), 4761–4771. https://doi.org/10.1074/jbc.M409650200.
(300) Karu, T. I. Mitochondrial Signaling in Mammalian Cells Activated by Red and Near-IR Radiation. Photochem. Photobiol. 2008, 84 (5), 1091–1099. https://doi.org/10.1111/j.1751-1097.2008.00394.x.
(301) Karu, T.; Pyatibrat, L.; Kalendo, G. Irradiation with He–Ne Laser Can Influence the Cytotoxic Response of HeLa Cells to Ionizing Radiation. Int. J. Radiat. Biol. 1994, 65 (6), 691–697. https://doi.org/10.1080/09553009414550811.
(302) Zhang, Y.; Song, S.; Fong, C.-C.; Tsang, C.-H.; Yang, Z.; Yang, M. CDNA Microarray Analysis of Gene Expression Profiles in Human Fibroblast Cells Irradiated with Red Light. J. Invest. Dermatol. 2003, 120 (5), 849–857. https://doi.org/10.1046/j.1523-1747.2003.12133.x.
(303) Maiya, G. A.; Kumar, P.; Rao, L. Effect of Low Intensity Helium-Neon (He-Ne) Laser Irradiation on Diabetic Wound Healing Dynamics. Photomed Laser Surg 2005, 23 (2), 187–190. https://doi.org/10.1089/pho.2005.23.187.
(304) Alves, A. N.; Fernandes, K. P. S.; Deana, A. M.; Bussadori, S. K.; Mesquita-Ferrari, R. A. Effects of Low-Level Laser Therapy on Skeletal Muscle Repair: A Systematic Review. Am J Phys Med Rehabil 2014, 93 (12), 1073–1085. https://doi.org/10.1097/PHM.0000000000000158.
(305) Yu, S.; Lan, C.-C. E.; Yu, H.-S. Mechanisms of Repigmentation Induced by Photobiomodulation Therapy in Vitiligo. Exp. Dermatol. 2019, 28 Suppl 1, 10–14. https://doi.org/10.1111/exd.13823.
(306) Salehpour, F.; Mahmoudi, J.; Kamari, F.; Sadigh-Eteghad, S.; Rasta, S. H.; Hamblin, M. R. Brain Photobiomodulation Therapy: A Narrative Review. Mol. Neurobiol. 2018, 55 (8), 6601–6636. https://doi.org/10.1007/s12035-017-0852-4.
(307) Hamblin, M. R. Photobiomodulation for Alzheimer’s Disease: Has the Light Dawned? Photonics 2019, 6 (3). https://doi.org/10.3390/photonics6030077.
(308) Huang, Y.-Y.; Gupta, A.; Vecchio, D.; de Arce, V. J. B.; Huang, S.-F.; Xuan, W.; Hamblin, M. R. Transcranial Low Level Laser (Light) Therapy for Traumatic Brain Injury. J Biophotonics 2012, 5 (11–12), 827–837. https://doi.org/10.1002/jbio.201200077.
(309) Hamblin, M. R. Photobiomodulation for Traumatic Brain Injury and Stroke. J. Neurosci. Res. 2018, 96 (4), 731–743. https://doi.org/10.1002/jnr.24190.
(310) Caldieraro, M. A.; Cassano, P. Transcranial and Systemic Photobiomodulation for Major Depressive Disorder: A Systematic Review of Efficacy, Tolerability and Biological Mechanisms. J Affect Disord 2019, 243, 262–273. https://doi.org/10.1016/j.jad.2018.09.048.
(311) Bashardoust Tajali, S.; Macdermid, J. C.; Houghton, P.; Grewal, R. Effects of Low Power Laser Irradiation on Bone Healing in Animals: A Meta-Analysis. J Orthop Surg Res 2010, 5, 1. https://doi.org/10.1186/1749-799X-5-1.
(312) Zein, R.; Selting, W.; Benedicenti, S. Effect of Low-Level Laser Therapy on Bone Regeneration During Osseointegration and Bone Graft. Photomed Laser Surg 2017, 35 (12), 649–658. https://doi.org/10.1089/pho.2017.4275.
(313) Hosseinpour, S.; Fekrazad, R.; Arany, P. R.; Ye, Q. Molecular Impacts of Photobiomodulation on Bone Regeneration: A Systematic Review. Prog. Biophys. Mol. Biol. 2019, 149, 147–159. https://doi.org/10.1016/j.pbiomolbio.2019.04.005.
(314) al-Awami, M.; Schillinger, M.; Maca, T.; Pollanz, S.; Minar, E. Low Level Laser Therapy for Treatment of Primary and Secondary Raynaud’s Phenomenon. VASA 2004, 33 (1), 25–29. https://doi.org/10.1024/0301-1526.33.1.25.
(315) Höfling, D. B.; Chavantes, M. C.; Juliano, A. G.; Cerri, G. G.; Knobel, M.; Yoshimura, E. M.; Chammas, M. C. Low-Level Laser in the Treatment of Patients with Hypothyroidism Induced by Chronic Autoimmune Thyroiditis: A Randomized, Placebo-Controlled Clinical Trial. Lasers Med Sci 2013, 28 (3), 743–753. https://doi.org/10.1007/s10103-012-1129-9.
(316) Morcos, N.; Omran, M.; Ghanem, H.; Elahdal, M.; Kamel, N.; Attia, E. Phototherapeutic Effect of Low-Level Laser on Thyroid Gland of Gamma-Irradiated Rats. Photochem. Photobiol. 2015, 91 (4), 942–951. https://doi.org/10.1111/php.12465.
(317) Höfling, D. B.; Chavantes, M. C.; Buchpiguel, C. A.; Cerri, G. G.; Marui, S.; Carneiro, P. C.; Chammas, M. C. Safety and Efficacy of Low-Level Laser Therapy in Autoimmune Thyroiditis: Long-Term Follow-Up Study. Int J Endocrinol 2018, 2018, 8387530. https://doi.org/10.1155/2018/8387530.
(318) Huang, Z.; Ma, J.; Chen, J.; Shen, B.; Pei, F.; Kraus, V. B. The Effectiveness of Low-Level Laser Therapy for Nonspecific Chronic Low Back Pain: A Systematic Review and Meta-Analysis. Arthritis Res. Ther. 2015, 17, 360. https://doi.org/10.1186/s13075-015-0882-0.
(319) Kisselev, S. B.; Moskvin, S. V. The Use of Laser Therapy for Patients with Fibromyalgia: A Critical Literary Review. J Lasers Med Sci 2019, 10 (1), 12–20. https://doi.org/10.15171/jlms.2019.02.
(320) Bjordal, J. M.; Lopes-Martins, R. A.; Joensen, J.; Couppe, C.; Ljunggren, A. E.; Stergioulas, A.; Johnson, M. I. A Systematic Review with Procedural Assessments and Meta-Analysis of Low Level Laser Therapy in Lateral Elbow Tendinopathy (Tennis Elbow). BMC Musculoskelet Disord 2008, 9, 75. https://doi.org/10.1186/1471-2474-9-75.
(321) Moskvin, S.; Ivanovich Apolikhin, O. Effectiveness of Low Level Laser Therapy for Treating Male Infertility. Biomedicine (Taipei) 2018, 8 (2), 7. https://doi.org/10.1051/bmdcn/2018080207.
(322) Yeste, M.; Castillo-Martín, M.; Bonet, S.; Rodríguez-Gil, J. E. Impact of Light Irradiation on Preservation and Function of Mammalian Spermatozoa. Animal Reproduction Science 2018, 194, 19–32. https://doi.org/10.1016/j.anireprosci.2018.02.004.
(323) Aziz-Jalali, M. H.; Tabaie, S. M.; Djavid, G. E. Comparison of Red and Infrared Low-Level Laser Therapy in the Treatment of Acne Vulgaris. Indian J Dermatol 2012, 57 (2), 128–130. https://doi.org/10.4103/0019-5154.94283.
(324) Darvin, M. E.; Gersonde, I.; Albrecht, H.; Zastrow, L.; Sterry, W.; Lademann, J. In Vivo Raman Spectroscopic Analysis of the Influence of IR Radiation on the Carotenoid Antioxidant Substances Beta-Carotene and Lycopene in the Human Skin. Formation of Free Radicals. Laser Physics Letters 2007, 4 (4), 318–321. https://doi.org/10.1002/lapl.200610113.
(325) Darvin, M.; Zastrov, L.; Gonchukov, S.; Lademann, J. Influence of IR Radiation on the Carotenoid Content in Human Skin. Optics and Spectroscopy 2009, 107, 917–920. https://doi.org/10.1134/S0030400X09120133.
(326) Barolet, D.; Christiaens, F.; Hamblin, M. R. Infrared and Skin: Friend or Foe. J. Photochem. Photobiol. B, Biol. 2016, 155, 78–85. https://doi.org/10.1016/j.jphotobiol.2015.12.014.
(327) Flowers, N.; Hartley, L.; Todkill, D.; Stranges, S.; Rees, K. Co-Enzyme Q10 Supplementation for the Primary Prevention of Cardiovascular Disease. Cochrane Database Syst Rev 2014, No. 12, CD010405. https://doi.org/10.1002/14651858.CD010405.pub2.
(328) Singh, U.; Devaraj, S.; Jialal, I. Coenzyme Q10 Supplementation and Heart Failure. Nutr. Rev. 2007, 65 (6 Pt 1), 286–293. https://doi.org/10.1301/nr.2007.jun.286-293.
(329) Gao, L.; Mao, Q.; Cao, J.; Wang, Y.; Zhou, X.; Fan, L. Effects of Coenzyme Q10 on Vascular Endothelial Function in Humans: A Meta-Analysis of Randomized Controlled Trials. Atherosclerosis 2012, 221 (2), 311–316. https://doi.org/10.1016/j.atherosclerosis.2011.10.027.
(330) DiNicolantonio, J. J.; Bhutani, J.; McCarty, M. F.; O’Keefe, J. H. Coenzyme Q10 for the Treatment of Heart Failure: A Review of the Literature. Open Heart 2015, 2 (1), e000326. https://doi.org/10.1136/openhrt-2015-000326.
(331) Ayers, J.; Cook, J.; Koenig, R. A.; Sisson, E. M.; Dixon, D. L. Recent Developments in the Role of Coenzyme Q10 for Coronary Heart Disease: A Systematic Review. Curr Atheroscler Rep 2018, 20 (6), 29. https://doi.org/10.1007/s11883-018-0730-1.
(332) Mortensen, A. L.; Rosenfeldt, F.; Filipiak, K. J. Effect of Coenzyme Q10 in Europeans with Chronic Heart Failure: A Sub-Group Analysis of the Q-SYMBIO Randomized Double-Blind Trial. Cardiol J 2019, 26 (2), 147–156. https://doi.org/10.5603/CJ.a2019.0022.
(333) Fabre, L. F.; Banks, R. C.; Mcisaac, W. M.; Farrell, G. Effects of Ubiquinone and Related Substances on Secretion of Aldosterone and Cortisol. Am. J. Physiol. 1965, 208, 1275–1280. https://doi.org/10.1152/ajplegacy.1965.208.6.1275.
(334) Langsjoen, P.; Langsjoen, P.; Willis, R.; Folkers, K. Treatment of Essential Hypertension with Coenzyme Q10. Mol. Aspects Med. 1994, 15 Suppl, S265-272. https://doi.org/10.1016/0098-2997(94)90037-x.
(335) Digiesi, V.; Cantini, F.; Oradei, A.; Bisi, G.; Guarino, G. C.; Brocchi, A.; Bellandi, F.; Mancini, M.; Littarru, G. P. Coenzyme Q10 in Essential Hypertension. Mol. Aspects Med. 1994, 15 Suppl, s257-263. https://doi.org/10.1016/0098-2997(94)90036-1.
(336) Grunfeld, S.; Hamilton, C. A.; Mesaros, S.; McClain, S. W.; Dominiczak, A. F.; Bohr, D. F.; Malinski, T. Role of Superoxide in the Depressed Nitric Oxide Production by the Endothelium of Genetically Hypertensive Rats. Hypertension 1995, 26 (6 Pt 1), 854–857. https://doi.org/10.1161/01.hyp.26.6.854.
(337) Burke, B. E.; Neuenschwander, R.; Olson, R. D. Randomized, Double-Blind, Placebo-Controlled Trial of Coenzyme Q10 in Isolated Systolic Hypertension. South. Med. J. 2001, 94 (11), 1112–1117. https://doi.org/10.1097/00007611-200111000-00015.
(338) Rosenfeldt, F. L.; Haas, S. J.; Krum, H.; Hadj, A.; Ng, K.; Leong, J.-Y.; Watts, G. F. Coenzyme Q10 in the Treatment of Hypertension: A Meta-Analysis of the Clinical Trials. J Hum Hypertens 2007, 21 (4), 297–306. https://doi.org/10.1038/sj.jhh.1002138.
(339) Ho, M. J.; Li, E. C. K.; Wright, J. M. Blood Pressure Lowering Efficacy of Coenzyme Q10 for Primary Hypertension. Cochrane Database Syst Rev 2016, 3, CD007435. https://doi.org/10.1002/14651858.CD007435.pub3.
(340) Shao, L.; Ma, A.; Figtree, G.; Zhang, P. Combination Therapy With Coenzyme Q10 and Trimetazidine in Patients With Acute Viral Myocarditis. J. Cardiovasc. Pharmacol. 2016, 68 (2), 150–154. https://doi.org/10.1097/FJC.0000000000000396.
(341) Tiano, L.; Belardinelli, R.; Carnevali, P.; Principi, F.; Seddaiu, G.; Littarru, G. P. Effect of Coenzyme Q10 Administration on Endothelial Function and Extracellular Superoxide Dismutase in Patients with Ischaemic Heart Disease: A Double-Blind, Randomized Controlled Study. Eur. Heart J. 2007, 28 (18), 2249–2255. https://doi.org/10.1093/eurheartj/ehm267.
(342) Dai, Y.-L.; Luk, T.-H.; Yiu, K.-H.; Wang, M.; Yip, P. M. C.; Lee, S. W. L.; Li, S.-W.; Tam, S.; Fong, B.; Lau, C.-P.; Siu, C.-W.; Tse, H.-F. Reversal of Mitochondrial Dysfunction by Coenzyme Q10 Supplement Improves Endothelial Function in Patients with Ischaemic Left Ventricular Systolic Dysfunction: A Randomized Controlled Trial. Atherosclerosis 2011, 216 (2), 395–401. https://doi.org/10.1016/j.atherosclerosis.2011.02.013.
(343) Lee, B.-J.; Huang, Y.-C.; Chen, S.-J.; Lin, P.-T. Effects of Coenzyme Q10 Supplementation on Inflammatory Markers (High-Sensitivity C-Reactive Protein, Interleukin-6, and Homocysteine) in Patients with Coronary Artery Disease. Nutrition 2012, 28 (7–8), 767–772. https://doi.org/10.1016/j.nut.2011.11.008.
(344) Lee, B.-J.; Tseng, Y.-F.; Yen, C.-H.; Lin, P.-T. Effects of Coenzyme Q10 Supplementation (300 Mg/Day) on Antioxidation and Anti-Inflammation in Coronary Artery Disease Patients during Statins Therapy: A Randomized, Placebo-Controlled Trial. Nutr J 2013, 12 (1), 142. https://doi.org/10.1186/1475-2891-12-142.
(345) Büyükkaya, E.; Evliyaoğlu, O.; Islamoğlu, Y.; Cil, H.; Karakaş, M. F.; Akçay, A. B.; Bilen, P.; Kurt, M.; Şen, N.; Ertas, F.; Mete, N. The Relationship between Coenzyme Q10 and Severity of Coronary Artery Disease. Med Glas (Zenica) 2013, 10 (2), 229–233.
(346) Folkers, K.; Langsjoen, P.; Willis, R.; Richardson, P.; Xia, L. J.; Ye, C. Q.; Tamagawa, H. Lovastatin Decreases Coenzyme Q Levels in Humans. Proc Natl Acad Sci U S A 1990, 87 (22), 8931–8934.
(347) Ghirlanda, G.; Oradei, A.; Manto, A.; Lippa, S.; Uccioli, L.; Caputo, S.; Greco, A. V.; Littarru, G. P. Evidence of Plasma CoQ10-Lowering Effect by HMG-CoA Reductase Inhibitors: A Double-Blind, Placebo-Controlled Study. J Clin Pharmacol 1993, 33 (3), 226–229. https://doi.org/10.1002/j.1552-4604.1993.tb03948.x.
(348) Langsjoen, P. H.; Langsjoen, A. M. The Clinical Use of HMG CoA-Reductase Inhibitors and the Associated Depletion of Coenzyme Q10. A Review of Animal and Human Publications. Biofactors 2003, 18 (1–4), 101–111. https://doi.org/10.1002/biof.5520180212.
(349) Silver, M. A.; Langsjoen, P. H.; Szabo, S.; Patil, H.; Zelinger, A. Statin Cardiomyopathy? A Potential Role for Co-Enzyme Q10 Therapy for Statin-Induced Changes in Diastolic LV Performance: Description of a Clinical Protocol. Biofactors 2003, 18 (1–4), 125–127. https://doi.org/10.1002/biof.5520180214.
(350) Silver, M. A.; Langsjoen, P. H.; Szabo, S.; Patil, H.; Zelinger, A. Effect of Atorvastatin on Left Ventricular Diastolic Function and Ability of Coenzyme Q10 to Reverse That Dysfunction. Am. J. Cardiol. 2004, 94 (10), 1306–1310. https://doi.org/10.1016/j.amjcard.2004.07.121.
(351) Hargreaves, I. P.; Duncan, A. J.; Heales, S. J. R.; Land, J. M. The Effect of HMG-CoA Reductase Inhibitors on Coenzyme Q10: Possible Biochemical/Clinical Implications. Drug Saf 2005, 28 (8), 659–676. https://doi.org/10.2165/00002018-200528080-00002.
(352) Stocker, R.; Pollicino, C.; Gay, C. A.; Nestel, P.; Colquhoun, D.; Whiting, M.; Tonkin, A.; Sullivan, D.; Simes, J. Neither Plasma Coenzyme Q10 Concentration, nor Its Decline during Pravastatin Therapy, Is Linked to Recurrent Cardiovascular Disease Events: A Prospective Case-Control Study from the LIPID Study. Atherosclerosis 2006, 187 (1), 198–204. https://doi.org/10.1016/j.atherosclerosis.2005.09.004.
(353) Mortensen, S. A.; Rosenfeldt, F.; Kumar, A.; Dolliner, P.; Filipiak, K. J.; Pella, D.; Alehagen, U.; Steurer, G.; Littarru, G. P.; Q-SYMBIO Study Investigators. The Effect of Coenzyme Q10 on Morbidity and Mortality in Chronic Heart Failure: Results from Q-SYMBIO: A Randomized Double-Blind Trial. JACC Heart Fail 2014, 2 (6), 641–649. https://doi.org/10.1016/j.jchf.2014.06.008.
(354) Engelsen, J.; Nielsen, J. D.; Winther, K. Effect of Coenzyme Q10 and Ginkgo Biloba on Warfarin Dosage in Stable, Long-Term Warfarin Treated Outpatients. A Randomised, Double Blind, Placebo-Crossover Trial. Thromb. Haemost. 2002, 87 (6), 1075–1076.
(355) Engelsen, J.; Nielsen, J. D.; Hansen, K. F. W. [Effect of Coenzyme Q10 and Ginkgo biloba on warfarin dosage in patients on long-term warfarin treatment. A randomized, double-blind, placebo-controlled cross-over trial]. Ugeskr. Laeg. 2003, 165 (18), 1868–1871.
(356) El-ghoroury, E. A.; Raslan, H. M.; Badawy, E. A.; El-Saaid, G. S.; Agybi, M. H.; Siam, I.; Salem, S. I. Malondialdehyde and Coenzyme Q10 in Platelets and Serum in Type 2 Diabetes Mellitus: Correlation with Glycemic Control. Blood Coagul. Fibrinolysis 2009, 20 (4), 248–251. https://doi.org/10.1097/mbc.0b013e3283254549.
(357) Sourris, K. C.; Harcourt, B. E.; Tang, P. H.; Morley, A. L.; Huynh, K.; Penfold, S. A.; Coughlan, M. T.; Cooper, M. E.; Nguyen, T.-V.; Ritchie, R. H.; Forbes, J. M. Ubiquinone (Coenzyme Q10) Prevents Renal Mitochondrial Dysfunction in an Experimental Model of Type 2 Diabetes. Free Radic. Biol. Med. 2012, 52 (3), 716–723. https://doi.org/10.1016/j.freeradbiomed.2011.11.017.
(358) Ates, O.; Bilen, H.; Keles, S.; Alp, H. H.; Keleş, M. S.; Yıldırım, K.; Ondaş, O.; Pınar, L. C.; Civelekler, M.; Baykal, O. Plasma Coenzyme Q10 Levels in Type 2 Diabetic Patients with Retinopathy. Int J Ophthalmol 2013, 6 (5), 675–679. https://doi.org/10.3980/j.issn.2222-3959.2013.05.24.
(359) Zozina, V. I.; Covantev, S.; Goroshko, O. A.; Krasnykh, L. M.; Kukes, V. G. Coenzyme Q10 in Cardiovascular and Metabolic Diseases: Current State of the Problem. Curr Cardiol Rev 2018, 14 (3), 164–174. https://doi.org/10.2174/1573403X14666180416115428.
(360) Parkinson Study Group QE3 Investigators; Beal, M. F.; Oakes, D.; Shoulson, I.; Henchcliffe, C.; Galpern, W. R.; Haas, R.; Juncos, J. L.; Nutt, J. G.; Voss, T. S.; Ravina, B.; Shults, C. M.; Helles, K.; Snively, V.; Lew, M. F.; Griebner, B.; Watts, A.; Gao, S.; Pourcher, E.; Bond, L.; Kompoliti, K.; Agarwal, P.; Sia, C.; Jog, M.; Cole, L.; Sultana, M.; Kurlan, R.; Richard, I.; Deeley, C.; Waters, C. H.; Figueroa, A.; Arkun, A.; Brodsky, M.; Ondo, W. G.; Hunter, C. B.; Jimenez-Shahed, J.; Palao, A.; Miyasaki, J. M.; So, J.; Tetrud, J.; Reys, L.; Smith, K.; Singer, C.; Blenke, A.; Russell, D. S.; Cotto, C.; Friedman, J. H.; Lannon, M.; Zhang, L.; Drasby, E.; Kumar, R.; Subramanian, T.; Ford, D. S.; Grimes, D. A.; Cote, D.; Conway, J.; Siderowf, A. D.; Evatt, M. L.; Sommerfeld, B.; Lieberman, A. N.; Okun, M. S.; Rodriguez, R. L.; Merritt, S.; Swartz, C. L.; Martin, W. R. W.; King, P.; Stover, N.; Guthrie, S.; Watts, R. L.; Ahmed, A.; Fernandez, H. H.; Winters, A.; Mari, Z.; Dawson, T. M.; Dunlop, B.; Feigin, A. S.; Shannon, B.; Nirenberg, M. J.; Ogg, M.; Ellias, S. A.; Thomas, C.-A.; Frei, K.; Bodis-Wollner, I.; Glazman, S.; Mayer, T.; Hauser, R. A.; Pahwa, R.; Langhammer, A.; Ranawaya, R.; Derwent, L.; Sethi, K. D.; Farrow, B.; Prakash, R.; Litvan, I.; Robinson, A.; Sahay, A.; Gartner, M.; Hinson, V. K.; Markind, S.; Pelikan, M.; Perlmutter, J. S.; Hartlein, J.; Molho, E.; Evans, S.; Adler, C. H.; Duffy, A.; Lind, M.; Elmer, L.; Davis, K.; Spears, J.; Wilson, S.; Leehey, M. A.; Hermanowicz, N.; Niswonger, S.; Shill, H. A.; Obradov, S.; Rajput, A.; Cowper, M.; Lessig, S.; Song, D.; Fontaine, D.; Zadikoff, C.; Williams, K.; Blindauer, K. A.; Bergholte, J.; Propsom, C. S.; Stacy, M. A.; Field, J.; Mihaila, D.; Chilton, M.; Uc, E. Y.; Sieren, J.; Simon, D. K.; Kraics, L.; Silver, A.; Boyd, J. T.; Hamill, R. W.; Ingvoldstad, C.; Young, J.; Thomas, K.; Kostyk, S. K.; Wojcieszek, J.; Pfeiffer, R. F.; Panisset, M.; Beland, M.; Reich, S. G.; Cines, M.; Zappala, N.; Rivest, J.; Zweig, R.; Lumina, L. P.; Hilliard, C. L.; Grill, S.; Kellermann, M.; Tuite, P.; Rolandelli, S.; Kang, U. J.; Young, J.; Rao, J.; Cook, M. M.; Severt, L.; Boyar, K. A Randomized Clinical Trial of High-Dosage Coenzyme Q10 in Early Parkinson Disease: No Evidence of Benefit. JAMA Neurol 2014, 71 (5), 543–552. https://doi.org/10.1001/jamaneurol.2014.131.
(361) Yoritaka, A.; Kawajiri, S.; Yamamoto, Y.; Nakahara, T.; Ando, M.; Hashimoto, K.; Nagase, M.; Saito, Y.; Hattori, N. Randomized, Double-Blind, Placebo-Controlled Pilot Trial of Reduced Coenzyme Q10 for Parkinson’s Disease. Parkinsonism Relat. Disord. 2015, 21 (8), 911–916. https://doi.org/10.1016/j.parkreldis.2015.05.022.
(362) Negida, A.; Menshawy, A.; El Ashal, G.; Elfouly, Y.; Hani, Y.; Hegazy, Y.; El Ghonimy, S.; Fouda, S.; Rashad, Y. Coenzyme Q10 for Patients with Parkinson’s Disease: A Systematic Review and Meta-Analysis. CNS Neurol Disord Drug Targets 2016, 15 (1), 45–53. https://doi.org/10.2174/1871527314666150821103306.
(363) Galasko, D. R.; Peskind, E.; Clark, C. M.; Quinn, J. F.; Ringman, J. M.; Jicha, G. A.; Cotman, C.; Cottrell, B.; Montine, T. J.; Thomas, R. G.; Aisen, P.; Alzheimer’s Disease Cooperative Study. Antioxidants for Alzheimer Disease: A Randomized Clinical Trial with Cerebrospinal Fluid Biomarker Measures. Arch. Neurol. 2012, 69 (7), 836–841. https://doi.org/10.1001/archneurol.2012.85.
(364) McGarry, A.; McDermott, M.; Kieburtz, K.; de Blieck, E. A.; Beal, F.; Marder, K.; Ross, C.; Shoulson, I.; Gilbert, P.; Mallonee, W. M.; Guttman, M.; Wojcieszek, J.; Kumar, R.; LeDoux, M. S.; Jenkins, M.; Rosas, H. D.; Nance, M.; Biglan, K.; Como, P.; Dubinsky, R. M.; Shannon, K. M.; O’Suilleabhain, P.; Chou, K.; Walker, F.; Martin, W.; Wheelock, V. L.; McCusker, E.; Jankovic, J.; Singer, C.; Sanchez-Ramos, J.; Scott, B.; Suchowersky, O.; Factor, S. A.; Higgins, D. S.; Molho, E.; Revilla, F.; Caviness, J. N.; Friedman, J. H.; Perlmutter, J. S.; Feigin, A.; Anderson, K.; Rodriguez, R.; McFarland, N. R.; Margolis, R. L.; Farbman, E. S.; Raymond, L. A.; Suski, V.; Kostyk, S.; Colcher, A.; Seeberger, L.; Epping, E.; Esmail, S.; Diaz, N.; Fung, W. L. A.; Diamond, A.; Frank, S.; Hanna, P.; Hermanowicz, N.; Dure, L. S.; Cudkowicz, M.; Huntington Study Group 2CARE Investigators and Coordinators. A Randomized, Double-Blind, Placebo-Controlled Trial of Coenzyme Q10 in Huntington Disease. Neurology 2017, 88 (2), 152–159. https://doi.org/10.1212/WNL.0000000000003478.
(365) Cooper, J. M.; Schapira, A. H. V. Friedreich’s Ataxia: Disease Mechanisms, Antioxidant and Coenzyme Q10 Therapy. Biofactors 2003, 18 (1–4), 163–171. https://doi.org/10.1002/biof.5520180219.
(366) Hart, P. E.; Lodi, R.; Rajagopalan, B.; Bradley, J. L.; Crilley, J. G.; Turner, C.; Blamire, A. M.; Manners, D.; Styles, P.; Schapira, A. H. V.; Cooper, J. M. Antioxidant Treatment of Patients with Friedreich Ataxia: Four-Year Follow-Up. Arch. Neurol. 2005, 62 (4), 621–626. https://doi.org/10.1001/archneur.62.4.621.
(367) Cooper, J. M.; Korlipara, L. V. P.; Hart, P. E.; Bradley, J. L.; Schapira, A. H. V. Coenzyme Q10 and Vitamin E Deficiency in Friedreich’s Ataxia: Predictor of Efficacy of Vitamin E and Coenzyme Q10 Therapy. Eur. J. Neurol. 2008, 15 (12), 1371–1379. https://doi.org/10.1111/j.1468-1331.2008.02318.x.
(368) Sanoobar, M.; Eghtesadi, S.; Azimi, A.; Khalili, M.; Khodadadi, B.; Jazayeri, S.; Gohari, M. R.; Aryaeian, N. Coenzyme Q10 Supplementation Ameliorates Inflammatory Markers in Patients with Multiple Sclerosis: A Double Blind, Placebo, Controlled Randomized Clinical Trial. Nutr Neurosci 2015, 18 (4), 169–176. https://doi.org/10.1179/1476830513Y.0000000106.
(369) Sanoobar, M.; Dehghan, P.; Khalili, M.; Azimi, A.; Seifar, F. Coenzyme Q10 as a Treatment for Fatigue and Depression in Multiple Sclerosis Patients: A Double Blind Randomized Clinical Trial. Nutr Neurosci 2016, 19 (3), 138–143. https://doi.org/10.1179/1476830515Y.0000000002.
(370) Moccia, M.; Capacchione, A.; Lanzillo, R.; Carbone, F.; Micillo, T.; Matarese, G.; Palladino, R.; Brescia Morra, V. Sample Size for Oxidative Stress and Inflammation When Treating Multiple Sclerosis with Interferon-Β1a and Coenzyme Q10. Brain Sci 2019, 9 (10). https://doi.org/10.3390/brainsci9100259.
(371) Moccia, M.; Capacchione, A.; Lanzillo, R.; Carbone, F.; Micillo, T.; Perna, F.; De Rosa, A.; Carotenuto, A.; Albero, R.; Matarese, G.; Palladino, R.; Brescia Morra, V. Coenzyme Q10 Supplementation Reduces Peripheral Oxidative Stress and Inflammation in Interferon-Β1a-Treated Multiple Sclerosis. Ther Adv Neurol Disord 2019, 12. https://doi.org/10.1177/1756286418819074.
(372) Cordero, M. D.; Alcocer-Gómez, E.; de Miguel, M.; Culic, O.; Carrión, A. M.; Alvarez-Suarez, J. M.; Bullón, P.; Battino, M.; Fernández-Rodríguez, A.; Sánchez-Alcazar, J. A. Can Coenzyme Q10 Improve Clinical and Molecular Parameters in Fibromyalgia? Antioxid. Redox Signal. 2013, 19 (12), 1356–1361. https://doi.org/10.1089/ars.2013.5260.
(373) Alcocer-Gómez, E.; Culic, O.; Navarro-Pando, J. M.; Sánchez-Alcázar, J. A.; Bullón, P. Effect of Coenzyme Q10 on Psychopathological Symptoms in Fibromyalgia Patients. CNS Neurosci Ther 2017, 23 (2), 188–189. https://doi.org/10.1111/cns.12668.
(374) Safarinejad, M. R. Safety and Efficacy of Coenzyme Q10 Supplementation in Early Chronic Peyronie’s Disease: A Double-Blind, Placebo-Controlled Randomized Study. Int. J. Impot. Res. 2010, 22 (5), 298–309. https://doi.org/10.1038/ijir.2010.20.
(375) Kuehhas, F. E.; Weibl, P.; Georgi, T.; Djakovic, N.; Herwig, R. Peyronie’s Disease: Nonsurgical Therapy Options. Rev Urol 2011, 13 (3), 139–146.
(376) Safarinejad, M. R.; Safarinejad, S.; Shafiei, N.; Safarinejad, S. Effects of the Reduced Form of Coenzyme Q10 (Ubiquinol) on Semen Parameters in Men with Idiopathic Infertility: A Double-Blind, Placebo Controlled, Randomized Study. J. Urol. 2012, 188 (2), 526–531. https://doi.org/10.1016/j.juro.2012.03.131.
(377) Lafuente, R.; González-Comadrán, M.; Solà, I.; López, G.; Brassesco, M.; Carreras, R.; Checa, M. A. Coenzyme Q10 and Male Infertility: A Meta-Analysis. J. Assist. Reprod. Genet. 2013, 30 (9), 1147–1156. https://doi.org/10.1007/s10815-013-0047-5.
(378) Arcaniolo, D.; Favilla, V.; Tiscione, D.; Pisano, F.; Bozzini, G.; Creta, M.; Gentile, G.; Menchini Fabris, F.; Pavan, N.; Veneziano, I. A.; Cai, T. Is There a Place for Nutritional Supplements in the Treatment of Idiopathic Male Infertility? Arch Ital Urol Androl 2014, 86 (3), 164–170. https://doi.org/10.4081/aiua.2014.3.164.
(379) Gvozdjáková, A.; Kucharská, J.; Dubravicky, J.; Mojto, V.; Singh, R. B. Coenzyme Q₁₀, α-Tocopherol, and Oxidative Stress Could Be Important Metabolic Biomarkers of Male Infertility. Dis. Markers 2015, 2015, 827941. https://doi.org/10.1155/2015/827941.
(380) Al-Rasheed, N. M.; Al-Rasheed, N. M.; Bassiouni, Y. A.; Hasan, I. H.; Al-Amin, M. A.; Al-Ajmi, H. N.; Mohamad, R. A. Vitamin D Attenuates Pro-Inflammatory TNF-α Cytokine Expression by Inhibiting NF-КB/P65 Signaling in Hypertrophied Rat Hearts. J. Physiol. Biochem. 2015, 71 (2), 289–299. https://doi.org/10.1007/s13105-015-0412-1.
(381) Silvagno, F.; Pescarmona, G. Spotlight on Vitamin D Receptor, Lipid Metabolism and Mitochondria: Some Preliminary Emerging Issues. Mol. Cell. Endocrinol. 2017, 450, 24–31. https://doi.org/10.1016/j.mce.2017.04.013.
(382) Ryan, Z. C.; Craig, T. A.; Folmes, C. D.; Wang, X.; Lanza, I. R.; Schaible, N. S.; Salisbury, J. L.; Nair, K. S.; Terzic, A.; Sieck, G. C.; Kumar, R. 1α,25-Dihydroxyvitamin D3 Regulates Mitochondrial Oxygen Consumption and Dynamics in Human Skeletal Muscle Cells. J. Biol. Chem. 2016, 291 (3), 1514–1528. https://doi.org/10.1074/jbc.M115.684399.
(383) Dzik, K. P.; Kaczor, J. J. Mechanisms of Vitamin D on Skeletal Muscle Function: Oxidative Stress, Energy Metabolism and Anabolic State. Eur. J. Appl. Physiol. 2019, 119 (4), 825–839. https://doi.org/10.1007/s00421-019-04104-x.
(384) Dzik, K. P.; Skrobot, W.; Kaczor, K. B.; Flis, D. J.; Karnia, M. J.; Libionka, W.; Antosiewicz, J.; Kloc, W.; Kaczor, J. J. Vitamin D Deficiency Is Associated with Muscle Atrophy and Reduced Mitochondrial Function in Patients with Chronic Low Back Pain https://www.hindawi.com/journals/omcl/2019/6835341/ (accessed May 5, 2020). https://doi.org/10.1155/2019/6835341.
(385) Schnell, D. M.; Walton, R. G.; Vekaria, H. J.; Sullivan, P. G.; Bollinger, L. M.; Peterson, C. A.; Thomas, D. T. Vitamin D Produces a Perilipin 2-Dependent Increase in Mitochondrial Function in C2C12 Myotubes. J. Nutr. Biochem. 2019, 65, 83–92. https://doi.org/10.1016/j.jnutbio.2018.11.002.
(386) Consiglio, M.; Destefanis, M.; Morena, D.; Foglizzo, V.; Forneris, M.; Pescarmona, G.; Silvagno, F. The Vitamin D Receptor Inhibits the Respiratory Chain, Contributing to the Metabolic Switch That Is Essential for Cancer Cell Proliferation. PLOS ONE 2014, 9 (12), e115816. https://doi.org/10.1371/journal.pone.0115816.
(387) Consiglio, M.; Viano, M.; Casarin, S.; Castagnoli, C.; Pescarmona, G.; Silvagno, F. Mitochondrial and Lipogenic Effects of Vitamin D on Differentiating and Proliferating Human Keratinocytes. Experimental Dermatology 2015, 24 (10), 748–753. https://doi.org/10.1111/exd.12761.
(388) Al-Hendy, A.; Diamond, M. P.; Boyer, T. G.; Halder, S. K. Vitamin D3 Inhibits Wnt/β-Catenin and MTOR Signaling Pathways in Human Uterine Fibroid Cells. J. Clin. Endocrinol. Metab. 2016, 101 (4), 1542–1551. https://doi.org/10.1210/jc.2015-3555.
(389) Hoepner, R.; Bagnoud, M.; Pistor, M.; Salmen, A.; Briner, M.; Synn, H.; Schrewe, L.; Guse, K.; Ahmadi, F.; Demir, S.; Laverick, L.; Gresle, M.; Worley, P.; Reichardt, H. M.; Butzkueven, H.; Gold, R.; Metz, I.; Lühder, F.; Chan, A. Vitamin D Increases Glucocorticoid Efficacy via Inhibition of MTORC1 in Experimental Models of Multiple Sclerosis. Acta Neuropathol. 2019, 138 (3), 443–456. https://doi.org/10.1007/s00401-019-02018-8.
(390) Rauen, U.; Springer, A.; Weisheit, D.; Petrat, F.; Korth, H.-G.; de Groot, H.; Sustmann, R. Assessment of Chelatable Mitochondrial Iron by Using Mitochondrion-Selective Fluorescent Iron Indicators with Different Iron-Binding Affinities. Chembiochem 2007, 8 (3), 341–352. https://doi.org/10.1002/cbic.200600311.
(391) Paul, B. T.; Manz, D. H.; Torti, F. M.; Torti, S. V. Mitochondria and Iron: Current Questions. Expert Rev Hematol 2017, 10 (1), 65–79. https://doi.org/10.1080/17474086.2016.1268047.
(392) Favaro, E.; Ramachandran, A.; McCormick, R.; Gee, H.; Blancher, C.; Crosby, M.; Devlin, C.; Blick, C.; Buffa, F.; Li, J.-L.; Vojnovic, B.; Pires das Neves, R.; Glazer, P.; Iborra, F.; Ivan, M.; Ragoussis, J.; Harris, A. L. MicroRNA-210 Regulates Mitochondrial Free Radical Response to Hypoxia and Krebs Cycle in Cancer Cells by Targeting Iron Sulfur Cluster Protein ISCU. PLoS ONE 2010, 5 (4), e10345. https://doi.org/10.1371/journal.pone.0010345.
(393) Sullivan, L. B.; Chandel, N. S. Mitochondrial Reactive Oxygen Species and Cancer. Cancer Metab 2014, 2. https://doi.org/10.1186/2049-3002-2-17.
(394) Nie, G.; Sheftel, A. D.; Kim, S. F.; Ponka, P. Overexpression of Mitochondrial Ferritin Causes Cytosolic Iron Depletion and Changes Cellular Iron Homeostasis. Blood 2005, 105 (5), 2161–2167. https://doi.org/10.1182/blood-2004-07-2722.
(395) Jarvis, J. H.; Jacobs, A. Morphological Abnormalities in Lymphocyte Mitochondria Associated with Iron-Deficiency Anaemia. J. Clin. Pathol. 1974, 27 (12), 973–979. https://doi.org/10.1136/jcp.27.12.973.
(396) Masini, A.; Salvioli, G.; Cremonesi, P.; Botti, B.; Gallesi, D.; Ceccarelli, D. Dietary Iron Deficiency in the Rat. I. Abnormalities in Energy Metabolism of the Hepatic Tissue. Biochim. Biophys. Acta 1994, 1188 (1–2), 46–52. https://doi.org/10.1016/0005-2728(94)90020-5.
(397) Bacon, B. R.; O’Neill, R.; Britton, R. S. Hepatic Mitochondrial Energy Production in Rats with Chronic Iron Overload. Gastroenterology 1993, 105 (4), 1134–1140. https://doi.org/10.1016/0016-5085(93)90959-g.
(398) Gao, X.; Campian, J. L.; Qian, M.; Sun, X.-F.; Eaton, J. W. Mitochondrial DNA Damage in Iron Overload. J. Biol. Chem. 2009, 284 (8), 4767–4775. https://doi.org/10.1074/jbc.M806235200.
(399) Blanchette, N. L.; Manz, D. H.; Torti, F. M.; Torti, S. V. Modulation of Hepcidin to Treat Iron Deregulation: Potential Clinical Applications. Expert Rev Hematol 2016, 9 (2), 169–186. https://doi.org/10.1586/17474086.2016.1124757.
(400) Barbiroli, B.; Medori, R.; Tritschler, H. J.; Klopstock, T.; Seibel, P.; Reichmann, H.; Iotti, S.; Lodi, R.; Zaniol, P. Lipoic (Thioctic) Acid Increases Brain Energy Availability and Skeletal Muscle Performance as Shown by in Vivo 31P-MRS in a Patient with Mitochondrial Cytopathy. J. Neurol. 1995, 242 (7), 472–477. https://doi.org/10.1007/BF00873552.
(401) Mayr, J. A.; Zimmermann, F. A.; Fauth, C.; Bergheim, C.; Meierhofer, D.; Radmayr, D.; Zschocke, J.; Koch, J.; Sperl, W. Lipoic Acid Synthetase Deficiency Causes Neonatal-Onset Epilepsy, Defective Mitochondrial Energy Metabolism, and Glycine Elevation. Am. J. Hum. Genet. 2011, 89 (6), 792–797. https://doi.org/10.1016/j.ajhg.2011.11.011.
(402) Khanna, S.; Roy, S.; Packer, L.; Sen, C. K. Cytokine-Induced Glucose Uptake in Skeletal Muscle: Redox Regulation and the Role of Alpha-Lipoic Acid. Am. J. Physiol. 1999, 276 (5), R1327-1333. https://doi.org/10.1152/ajpregu.1999.276.5.R1327.
(403) Konrad, D.; Somwar, R.; Sweeney, G.; Yaworsky, K.; Hayashi, M.; Ramlal, T.; Klip, A. The Antihyperglycemic Drug Alpha-Lipoic Acid Stimulates Glucose Uptake via Both GLUT4 Translocation and GLUT4 Activation: Potential Role of P38 Mitogen-Activated Protein Kinase in GLUT4 Activation. Diabetes 2001, 50 (6), 1464–1471. https://doi.org/10.2337/diabetes.50.6.1464.
(404) Moini, H.; Tirosh, O.; Park, Y. C.; Cho, K.-J.; Packer, L. R-Alpha-Lipoic Acid Action on Cell Redox Status, the Insulin Receptor, and Glucose Uptake in 3T3-L1 Adipocytes. Arch. Biochem. Biophys. 2002, 397 (2), 384–391. https://doi.org/10.1006/abbi.2001.2680.
(405) Lee, W. J.; Song, K.-H.; Koh, E. H.; Won, J. C.; Kim, H. S.; Park, H.-S.; Kim, M.-S.; Kim, S.-W.; Lee, K.-U.; Park, J.-Y. Alpha-Lipoic Acid Increases Insulin Sensitivity by Activating AMPK in Skeletal Muscle. Biochem. Biophys. Res. Commun. 2005, 332 (3), 885–891. https://doi.org/10.1016/j.bbrc.2005.05.035.
(406) Ziegler, D. Thioctic Acid for Patients with Symptomatic Diabetic Polyneuropathy: A Critical Review. Treat Endocrinol 2004, 3 (3), 173–189. https://doi.org/10.2165/00024677-200403030-00005.
(407) Rochette, L.; Ghibu, S.; Muresan, A.; Vergely, C. Alpha-Lipoic Acid: Molecular Mechanisms and Therapeutic Potential in Diabetes. Can. J. Physiol. Pharmacol. 2015, 93 (12), 1021–1027. https://doi.org/10.1139/cjpp-2014-0353.
(408) Ziegler, D.; Low, P. A.; Freeman, R.; Tritschler, H.; Vinik, A. I. Predictors of Improvement and Progression of Diabetic Polyneuropathy Following Treatment with α-Lipoic Acid for 4 Years in the NATHAN 1 Trial. J. Diabetes Complicat. 2016, 30 (2), 350–356. https://doi.org/10.1016/j.jdiacomp.2015.10.018.
(409) Grassi, D.; Desideri, G.; Croce, G.; Tiberti, S.; Aggio, A.; Ferri, C. Flavonoids, Vascular Function and Cardiovascular Protection. Curr. Pharm. Des. 2009, 15 (10), 1072–1084. https://doi.org/10.2174/138161209787846982.
(410) Haritoglou, C.; Gerss, J.; Hammes, H. P.; Kampik, A.; Ulbig, M. W.; RETIPON Study Group. Alpha-Lipoic Acid for the Prevention of Diabetic Macular Edema. Ophthalmologica 2011, 226 (3), 127–137. https://doi.org/10.1159/000329470.
(411) Koufaki, M. Therapeutic Applications of Lipoic Acid: A Patent Review (2011 – 2014). Expert Opin Ther Pat 2014, 24 (9), 993–1005. https://doi.org/10.1517/13543776.2014.937425.
(412) Ghibu, S.; Craciun, C. E.; Rusu, R.; Morgovan, C.; Mogosan, C.; Rochette, L.; Gal, A. F.; Dronca, M. Impact of Alpha-Lipoic Acid Chronic Discontinuous Treatment in Cardiometabolic Disorders and Oxidative Stress Induced by Fructose Intake in Rats. Antioxidants (Basel) 2019, 8 (12). https://doi.org/10.3390/antiox8120636.
(413) Seifar, F.; Khalili, M.; Khaledyan, H.; Amiri Moghadam, S.; Izadi, A.; Azimi, A.; Shakouri, S. K. α-Lipoic Acid, Functional Fatty Acid, as a Novel Therapeutic Alternative for Central Nervous System Diseases: A Review. Nutr Neurosci 2019, 22 (5), 306–316. https://doi.org/10.1080/1028415X.2017.1386755.
(414) dos Santos, S. M.; Romeiro, C. F. R.; Rodrigues, C. A.; Cerqueira, A. R. L.; Monteiro, M. C. Mitochondrial Dysfunction and Alpha-Lipoic Acid: Beneficial or Harmful in Alzheimer’s Disease? Oxid Med Cell Longev 2019, 2019. https://doi.org/10.1155/2019/8409329.
(415) Loy, B. D.; Fling, B. W.; Horak, F. B.; Bourdette, D. N.; Spain, R. I. Effects of Lipoic Acid on Walking Performance, Gait, and Balance in Secondary Progressive Multiple Sclerosis. Complement Ther Med 2018, 41, 169–174. https://doi.org/10.1016/j.ctim.2018.09.006.
(416) Shinto, L.; Quinn, J.; Montine, T.; Dodge, H. H.; Woodward, W.; Baldauf-Wagner, S.; Waichunas, D.; Bumgarner, L.; Bourdette, D.; Silbert, L.; Kaye, J. A Randomized Placebo-Controlled Pilot Trial of Omega-3 Fatty Acids and Alpha Lipoic Acid in Alzheimer’s Disease. J. Alzheimers Dis. 2014, 38 (1), 111–120. https://doi.org/10.3233/JAD-130722.
(417) Zhang, H.; Jia, H.; Liu, J.; Ao, N.; Yan, B.; Shen, W.; Wang, X.; Li, X.; Luo, C.; Liu, J. Combined R-Alpha-Lipoic Acid and Acetyl-L-Carnitine Exerts Efficient Preventative Effects in a Cellular Model of Parkinson’s Disease. J. Cell. Mol. Med. 2010, 14 (1–2), 215–225. https://doi.org/10.1111/j.1582-4934.2008.00390.x.
(418) De Araújo, D. P.; Lobato, R. D. F. G.; Cavalcanti, J. R. L. D. P.; Sampaio, L. R. L.; Araújo, P. V. P.; Silva, M. C. C.; Neves, K. R. T.; Fonteles, M. M. D. F.; Sousa, F. C. F. D.; Vasconcelos, S. M. M. The Contributions of Antioxidant Activity of Lipoic Acid in Reducing Neurogenerative Progression of Parkinson’s Disease: A Review. Int. J. Neurosci. 2011, 121 (2), 51–57. https://doi.org/10.3109/00207454.2010.535934.
(419) Porcaro, G.; Brillo, E.; Giardina, I.; Di Iorio, R. Alpha Lipoic Acid (ALA) Effects on Subchorionic Hematoma: Preliminary Clinical Results. Eur Rev Med Pharmacol Sci 2015, 19 (18), 3426–3432.
(420) Costantino, M.; Guaraldi, C.; Costantino, D. Resolution of Subchorionic Hematoma and Symptoms of Threatened Miscarriage Using Vaginal Alpha Lipoic Acid or Progesterone: Clinical Evidences. Eur Rev Med Pharmacol Sci 2016, 20 (8), 1656–1663.
(421) Grandi, G.; Pignatti, L.; Ferrari, F.; Dante, G.; Neri, I.; Facchinetti, F. Vaginal Alpha-Lipoic Acid Shows an Anti-Inflammatory Effect on the Cervix, Preventing Its Shortening after Primary Tocolysis. A Pilot, Randomized, Placebo-Controlled Study. J. Matern. Fetal. Neonatal. Med. 2017, 30 (18), 2243–2249. https://doi.org/10.1080/14767058.2016.1245282.
(422) Eser Faki, H.; Tras, B.; Uney, K. Alpha Lipoic Acid and Vitamin E Improve Atorvastatin-Induced Mitochondrial Dysfunctions in Rats. Mitochondrion 2020, 52, 83–88. https://doi.org/10.1016/j.mito.2020.02.011.
(423) El Midaoui, A.; de Champlain, J. Prevention of Hypertension, Insulin Resistance, and Oxidative Stress by Alpha-Lipoic Acid. Hypertension 2002, 39 (2), 303–307. https://doi.org/10.1161/hy0202.104345.
(424) Vasdev, S.; Gill, V.; Parai, S.; Gadag, V. Dietary Lipoic Acid Supplementation Attenuates Hypertension in Dahl Salt Sensitive Rats. Mol. Cell. Biochem. 2005, 275 (1–2), 135–141. https://doi.org/10.1007/s11010-005-1095-7.
(425) Zanelli, S. A.; Solenski, N. J.; Rosenthal, R. E.; Fiskum, G. Mechanisms of Ischemic Neuroprotection by Acetyl-L-Carnitine. Ann N Y Acad Sci 2005, 1053, 153–161. https://doi.org/10.1196/annals.1344.013.
(426) Traina, G. The Neurobiology of Acetyl-L-Carnitine. Front Biosci (Landmark Ed) 2016, 21, 1314–1329.
(427) Ferreira, G. C.; McKenna, M. C. L-Carnitine and Acetyl-L-Carnitine Roles and Neuroprotection in Developing Brain. Neurochem. Res. 2017, 42 (6), 1661–1675. https://doi.org/10.1007/s11064-017-2288-7.
(428) Maldonado, C.; Vázquez, M.; Fagiolino, P. Potential Therapeutic Role of Carnitine and Acetylcarnitine in Neurological Disorders. Curr. Pharm. Des. 2020. https://doi.org/10.2174/1381612826666200212114038.
(429) Tomassini, V.; Pozzilli, C.; Onesti, E.; Pasqualetti, P.; Marinelli, F.; Pisani, A.; Fieschi, C. Comparison of the Effects of Acetyl L-Carnitine and Amantadine for the Treatment of Fatigue in Multiple Sclerosis: Results of a Pilot, Randomised, Double-Blind, Crossover Trial. J. Neurol. Sci. 2004, 218 (1–2), 103–108. https://doi.org/10.1016/j.jns.2003.11.005.
(430) Ledinek, A. H.; Sajko, M. C.; Rot, U. Evaluating the Effects of Amantadin, Modafinil and Acetyl-L-Carnitine on Fatigue in Multiple Sclerosis–Result of a Pilot Randomized, Blind Study. Clin Neurol Neurosurg 2013, 115 Suppl 1, S86-89. https://doi.org/10.1016/j.clineuro.2013.09.029.
(431) Evans, E.; Piccio, L.; Cross, A. H. Use of Vitamins and Dietary Supplements by Patients With Multiple Sclerosis: A Review. JAMA Neurol 2018, 75 (8), 1013–1021. https://doi.org/10.1001/jamaneurol.2018.0611.
(432) Zhang, H.; Jia, H.; Liu, J.; Ao, N.; Yan, B.; Shen, W.; Wang, X.; Li, X.; Luo, C.; Liu, J. Combined R-α–Lipoic Acid and Acetyl-L-Carnitine Exerts Efficient Preventative Effects in a Cellular Model of Parkinson’s Disease. J Cell Mol Med 2010, 14 (1–2), 215–225. https://doi.org/10.1111/j.1582-4934.2008.00390.x.
(433) Zaitone, S. A.; Abo-Elmatty, D. M.; Shaalan, A. A. Acetyl-L-Carnitine and α-Lipoic Acid Affect Rotenone-Induced Damage in Nigral Dopaminergic Neurons of Rat Brain, Implication for Parkinson’s Disease Therapy. Pharmacol. Biochem. Behav. 2012, 100 (3), 347–360. https://doi.org/10.1016/j.pbb.2011.09.002.
(434) Mehrotra, A.; Sandhir, R. Mitochondrial Cofactors in Experimental Huntington’s Disease: Behavioral, Biochemical and Histological Evaluation. Behav. Brain Res. 2014, 261, 345–355. https://doi.org/10.1016/j.bbr.2013.12.035.
(435) Saiki, S.; Hatano, T.; Fujimaki, M.; Ishikawa, K.-I.; Mori, A.; Oji, Y.; Okuzumi, A.; Fukuhara, T.; Koinuma, T.; Imamichi, Y.; Nagumo, M.; Furuya, N.; Nojiri, S.; Amo, T.; Yamashiro, K.; Hattori, N. Decreased Long-Chain Acylcarnitines from Insufficient β-Oxidation as Potential Early Diagnostic Markers for Parkinson’s Disease. Sci Rep 2017, 7 (1), 7328. https://doi.org/10.1038/s41598-017-06767-y.
(436) Afshin-Majd, S.; Bashiri, K.; Kiasalari, Z.; Baluchnejadmojarad, T.; Sedaghat, R.; Roghani, M. Acetyl-l-Carnitine Protects Dopaminergic Nigrostriatal Pathway in 6-Hydroxydopamine-Induced Model of Parkinson’s Disease in the Rat. Biomed. Pharmacother. 2017, 89, 1–9. https://doi.org/10.1016/j.biopha.2017.02.007.
(437) Burks, S.; Raymick, J.; Robinson, B.; Hanig, J.; Sarkar, S. Neuroprotective Effects of Acetyl-l-Carnitine (ALC) in a Chronic MPTP-Induced Parkinson’s Disease Mouse Model: Endothelial and Microglial Effects. Neurosci. Lett. 2019, 703, 86–95. https://doi.org/10.1016/j.neulet.2019.03.015.
(438) Spagnoli, A.; Lucca, U.; Menasce, G.; Bandera, L.; Cizza, G.; Forloni, G.; Tettamanti, M.; Frattura, L.; Tiraboschi, P.; Comelli, M. Long-Term Acetyl-L-Carnitine Treatment in Alzheimer’s Disease. Neurology 1991, 41 (11), 1726–1732. https://doi.org/10.1212/wnl.41.11.1726.
(439) Cristofano, A.; Sapere, N.; La Marca, G.; Angiolillo, A.; Vitale, M.; Corbi, G.; Scapagnini, G.; Intrieri, M.; Russo, C.; Corso, G.; Di Costanzo, A. Serum Levels of Acyl-Carnitines along the Continuum from Normal to Alzheimer’s Dementia. PLoS ONE 2016, 11 (5), e0155694. https://doi.org/10.1371/journal.pone.0155694.
(440) Bachmann, H. U.; Hoffmann, A. Interaction of Food Supplement L-Carnitine with Oral Anticoagulant Acenocoumarol. Swiss Med Wkly 2004, 134 (25–26), 385. https://doi.org/2004/25/smw-10631.
(441) Drugs.com. Coumadin and L-Carnitine Drug Interactions https://www.drugs.com/drug-interactions/coumadin-with-l-carnitine-2311-1529-1454-13156.html (accessed May 7, 2020).
(442) Koeth, R. A.; Wang, Z.; Levison, B. S.; Buffa, J. A.; Org, E.; Sheehy, B. T.; Britt, E. B.; Fu, X.; Wu, Y.; Li, L.; Smith, J. D.; DiDonato, J. A.; Chen, J.; Li, H.; Wu, G. D.; Lewis, J. D.; Warrier, M.; Brown, J. M.; Krauss, R. M.; Tang, W. H. W.; Bushman, F. D.; Lusis, A. J.; Hazen, S. L. Intestinal Microbiota Metabolism of L-Carnitine, a Nutrient in Red Meat, Promotes Atherosclerosis. Nature Medicine 2013, 19 (5), 576–585. https://doi.org/10.1038/nm.3145.
(443) Tarnopolsky, M.; Martin, J. Creatine Monohydrate Increases Strength in Patients with Neuromuscular Disease. Neurology 1999, 52 (4), 854–857. https://doi.org/10.1212/wnl.52.4.854.
(444) Louis, M.; Lebacq, J.; Poortmans, J. R.; Belpaire-Dethiou, M.-C.; Devogelaer, J.-P.; Van Hecke, P.; Goubel, F.; Francaux, M. Beneficial Effects of Creatine Supplementation in Dystrophic Patients. Muscle Nerve 2003, 27 (5), 604–610. https://doi.org/10.1002/mus.10355.
(445) Tarnopolsky, M. A. Clinical Use of Creatine in Neuromuscular and Neurometabolic Disorders. Subcell. Biochem. 2007, 46, 183–204. https://doi.org/10.1007/978-1-4020-6486-9_10.
(446) Pfeffer, G.; Majamaa, K.; Turnbull, D. M.; Thorburn, D.; Chinnery, P. F. Treatment for Mitochondrial Disorders. Cochrane Database Syst Rev 2012, No. 4, CD004426. https://doi.org/10.1002/14651858.CD004426.pub3.
(447) Berneburg, M.; Gremmel, T.; Kürten, V.; Schroeder, P.; Hertel, I.; von Mikecz, A.; Wild, S.; Chen, M.; Declercq, L.; Matsui, M.; Ruzicka, T.; Krutmann, J. Creatine Supplementation Normalizes Mutagenesis of Mitochondrial DNA as Well as Functional Consequences. J. Invest. Dermatol. 2005, 125 (2), 213–220. https://doi.org/10.1111/j.0022-202X.2005.23806.x.
(448) Guidi, C.; Potenza, L.; Sestili, P.; Martinelli, C.; Guescini, M.; Stocchi, L.; Zeppa, S.; Polidori, E.; Annibalini, G.; Stocchi, V. Differential Effect of Creatine on Oxidatively-Injured Mitochondrial and Nuclear DNA. Biochim. Biophys. Acta 2008, 1780 (1), 16–26. https://doi.org/10.1016/j.bbagen.2007.09.018.
(449) Sestili, P.; Barbieri, E.; Martinelli, C.; Battistelli, M.; Guescini, M.; Vallorani, L.; Casadei, L.; D’Emilio, A.; Falcieri, E.; Piccoli, G.; Agostini, D.; Annibalini, G.; Paolillo, M.; Gioacchini, A. M.; Stocchi, V. Creatine Supplementation Prevents the Inhibition of Myogenic Differentiation in Oxidatively Injured C2C12 Murine Myoblasts. Mol Nutr Food Res 2009, 53 (9), 1187–1204. https://doi.org/10.1002/mnfr.200800504.
(450) Barbieri, E.; Guescini, M.; Calcabrini, C.; Vallorani, L.; Diaz, A. R.; Fimognari, C.; Canonico, B.; Luchetti, F.; Papa, S.; Battistelli, M.; Falcieri, E.; Romanello, V.; Sandri, M.; Stocchi, V.; Ciacci, C.; Sestili, P. Creatine Prevents the Structural and Functional Damage to Mitochondria in Myogenic, Oxidatively Stressed C2C12 Cells and Restores Their Differentiation Capacity. Oxid Med Cell Longev 2016, 2016. https://doi.org/10.1155/2016/5152029.
(451) Adhihetty, P. J.; Beal, M. F. Creatine and Its Potential Therapeutic Value for Targeting Cellular Energy Impairment in Neurodegenerative Diseases. Neuromolecular Med 2008, 10 (4), 275–290. https://doi.org/10.1007/s12017-008-8053-y.
(452) Mo, J.-J.; Liu, L.-Y.; Peng, W.-B.; Rao, J.; Liu, Z.; Cui, L.-L. The Effectiveness of Creatine Treatment for Parkinson’s Disease: An Updated Meta-Analysis of Randomized Controlled Trials. BMC Neurol 2017, 17. https://doi.org/10.1186/s12883-017-0885-3.
(453) Stevens, M. J.; Li, F.; Drel, V. R.; Abatan, O. I.; Kim, H.; Burnett, D.; Larkin, D.; Obrosova, I. G. Nicotinamide Reverses Neurological and Neurovascular Deficits in Streptozotocin Diabetic Rats. J. Pharmacol. Exp. Ther. 2007, 320 (1), 458–464. https://doi.org/10.1124/jpet.106.109702.
(454) Negi, G.; Kumar, A.; Kaundal, R. K.; Gulati, A.; Sharma, S. S. Functional and Biochemical Evidence Indicating Beneficial Effect of Melatonin and Nicotinamide Alone and in Combination in Experimental Diabetic Neuropathy. Neuropharmacology 2010, 58 (3), 585–592. https://doi.org/10.1016/j.neuropharm.2009.11.018.
(455) Maiese, K.; Chong, Z. Z. Nicotinamide: Necessary Nutrient Emerges as a Novel Cytoprotectant for the Brain. Trends Pharmacol. Sci. 2003, 24 (5), 228–232. https://doi.org/10.1016/S0165-6147(03)00078-6.
(456) Fricker, R. A.; Green, E. L.; Jenkins, S. I.; Griffin, S. M. The Influence of Nicotinamide on Health and Disease in the Central Nervous System. Int J Tryptophan Res 2018, 11. https://doi.org/10.1177/1178646918776658.
(457) Kaneko, S.; Wang, J.; Kaneko, M.; Yiu, G.; Hurrell, J. M.; Chitnis, T.; Khoury, S. J.; He, Z. Protecting Axonal Degeneration by Increasing Nicotinamide Adenine Dinucleotide Levels in Experimental Autoimmune Encephalomyelitis Models. J. Neurosci. 2006, 26 (38), 9794–9804. https://doi.org/10.1523/JNEUROSCI.2116-06.2006.
(458) Morris, M. C.; Evans, D. A.; Bienias, J. L.; Scherr, P. A.; Tangney, C. C.; Hebert, L. E.; Bennett, D. A.; Wilson, R. S.; Aggarwal, N. Dietary Niacin and the Risk of Incident Alzheimer’s Disease and of Cognitive Decline. J. Neurol. Neurosurg. Psychiatry 2004, 75 (8), 1093–1099. https://doi.org/10.1136/jnnp.2003.025858.
(459) Green, K. N.; Steffan, J. S.; Martinez-Coria, H.; Sun, X.; Schreiber, S. S.; Thompson, L. M.; LaFerla, F. M. Nicotinamide Restores Cognition in Alzheimer’s Disease Transgenic Mice via a Mechanism Involving Sirtuin Inhibition and Selective Reduction of Thr231-Phosphotau. J Neurosci 2008, 28 (45), 11500–11510. https://doi.org/10.1523/JNEUROSCI.3203-08.2008.
(460) Bayrakdar, E. T.; Armagan, G.; Uyanikgil, Y.; Kanit, L.; Koylu, E.; Yalcin, A. Ex Vivo Protective Effects of Nicotinamide and 3-Aminobenzamide on Rat Synaptosomes Treated with Aβ(1-42). Cell Biochem. Funct. 2014, 32 (7), 557–564. https://doi.org/10.1002/cbf.3049.
(461) Lee, E.-J.; Wu, T.-S.; Chang, G.-L.; Li, C.-Y.; Chen, T.-Y.; Lee, M.-Y.; Chen, H.-Y.; Maynard, K. I. Delayed Treatment with Nicotinamide Inhibits Brain Energy Depletion, Improves Cerebral Microperfusion, Reduces Brain Infarct Volume, but Does Not Alter Neurobehavioral Outcome Following Permanent Focal Cerebral Ischemia in Sprague Dawley Rats. Curr Neurovasc Res 2006, 3 (3), 203–213. https://doi.org/10.2174/156720206778018749.
(462) Maiese, K.; Chong, Z. Z.; Hou, J.; Shang, Y. C. The Vitamin Nicotinamide: Translating Nutrition into Clinical Care. Molecules 2009, 14 (9), 3446–3485. https://doi.org/10.3390/molecules14093446.
(463) Martens, C. R.; Denman, B. A.; Mazzo, M. R.; Armstrong, M. L.; Reisdorph, N.; McQueen, M. B.; Chonchol, M.; Seals, D. R. Chronic Nicotinamide Riboside Supplementation Is Well-Tolerated and Elevates NAD+ in Healthy Middle-Aged and Older Adults. Nat Commun 2018, 9 (1), 1286. https://doi.org/10.1038/s41467-018-03421-7.
(464) Dollerup, O. L.; Christensen, B.; Svart, M.; Schmidt, M. S.; Sulek, K.; Ringgaard, S.; Stødkilde-Jørgensen, H.; Møller, N.; Brenner, C.; Treebak, J. T.; Jessen, N. A Randomized Placebo-Controlled Clinical Trial of Nicotinamide Riboside in Obese Men: Safety, Insulin-Sensitivity, and Lipid-Mobilizing Effects. Am. J. Clin. Nutr. 2018, 108 (2), 343–353. https://doi.org/10.1093/ajcn/nqy132.
(465) Elhassan, Y. S.; Kluckova, K.; Fletcher, R. S.; Schmidt, M. S.; Garten, A.; Doig, C. L.; Cartwright, D. M.; Oakey, L.; Burley, C. V.; Jenkinson, N.; Wilson, M.; Lucas, S. J. E.; Akerman, I.; Seabright, A.; Lai, Y.-C.; Tennant, D. A.; Nightingale, P.; Wallis, G. A.; Manolopoulos, K. N.; Brenner, C.; Philp, A.; Lavery, G. G. Nicotinamide Riboside Augments the Aged Human Skeletal Muscle NAD+ Metabolome and Induces Transcriptomic and Anti-Inflammatory Signatures. Cell Rep 2019, 28 (7), 1717-1728.e6. https://doi.org/10.1016/j.celrep.2019.07.043.
(466) Dollerup, O. L.; Chubanava, S.; Agerholm, M.; Søndergård, S. D.; Altıntaş, A.; Møller, A. B.; Høyer, K. F.; Ringgaard, S.; Stødkilde-Jørgensen, H.; Lavery, G. G.; Barrès, R.; Larsen, S.; Prats, C.; Jessen, N.; Treebak, J. T. Nicotinamide Riboside Does Not Alter Mitochondrial Respiration, Content or Morphology in Skeletal Muscle from Obese and Insulin-Resistant Men. J. Physiol. (Lond.) 2020, 598 (4), 731–754. https://doi.org/10.1113/JP278752.
(467) Remie, C. M. E.; Roumans, K. H. M.; Moonen, M. P. B.; Connell, N. J.; Havekes, B.; Mevenkamp, J.; Lindeboom, L.; de Wit, V. H. W.; van de Weijer, T.; Aarts, S. A. B. M.; Lutgens, E.; Schomakers, B. V.; Elfrink, H. L.; Zapata-Pérez, R.; Houtkooper, R. H.; Auwerx, J.; Hoeks, J.; Schrauwen-Hinderling, V. B.; Phielix, E.; Schrauwen, P. Nicotinamide Riboside Supplementation Alters Body Composition and Skeletal Muscle Acetylcarnitine Concentrations in Healthy Obese Humans. Am. J. Clin. Nutr. 2020. https://doi.org/10.1093/ajcn/nqaa072.
(468) Dellinger, R. W.; Santos, S. R.; Morris, M.; Evans, M.; Alminana, D.; Guarente, L.; Marcotulli, E. Repeat Dose NRPT (Nicotinamide Riboside and Pterostilbene) Increases NAD + Levels in Humans Safely and Sustainably: A Randomized, Double-Blind, Placebo-Controlled Study. npj Aging and Mechanisms of Disease 2017, 3 (1), 1–9. https://doi.org/10.1038/s41514-017-0016-9.
(469) Chou, Y.-F.; Huang, R.-F. S. Mitochondrial DNA Deletions of Blood Lymphocytes as Genetic Markers of Low Folate-Related Mitochondrial Genotoxicity in Peripheral Tissues. Eur J Nutr 2009, 48 (7), 429–436. https://doi.org/10.1007/s00394-009-0031-0.
(470) Ormazabal, A.; Casado, M.; Molero-Luis, M.; Montoya, J.; Rahman, S.; Aylett, S.-B.; Hargreaves, I.; Heales, S.; Artuch, R. Can Folic Acid Have a Role in Mitochondrial Disorders? Drug Discov. Today 2015, 20 (11), 1349–1354. https://doi.org/10.1016/j.drudis.2015.07.002.
(471) Sullivan, E. M.; Pennington, E. R.; Green, W. D.; Beck, M. A.; Brown, D. A.; Shaikh, S. R. Mechanisms by Which Dietary Fatty Acids Regulate Mitochondrial Structure-Function in Health and Disease. Adv Nutr 2018, 9 (3), 247–262. https://doi.org/10.1093/advances/nmy007.
(472) Sullivan, E. M.; Pennington, E. R.; Sparagna, G. C.; Torres, M. J.; Neufer, P. D.; Harris, M.; Washington, J.; Anderson, E. J.; Zeczycki, T. N.; Brown, D. A.; Shaikh, S. R. Docosahexaenoic Acid Lowers Cardiac Mitochondrial Enzyme Activity by Replacing Linoleic Acid in the Phospholipidome. J. Biol. Chem. 2018, 293 (2), 466–483. https://doi.org/10.1074/jbc.M117.812834.
(473) Herbst, E. a. F.; Paglialunga, S.; Gerling, C.; Whitfield, J.; Mukai, K.; Chabowski, A.; Heigenhauser, G. J. F.; Spriet, L. L.; Holloway, G. P. Omega-3 Supplementation Alters Mitochondrial Membrane Composition and Respiration Kinetics in Human Skeletal Muscle. J. Physiol. (Lond.) 2014, 592 (6), 1341–1352. https://doi.org/10.1113/jphysiol.2013.267336.
(474) Afshordel, S.; Hagl, S.; Werner, D.; Röhner, N.; Kögel, D.; Bazan, N. G.; Eckert, G. P. Omega-3 Polyunsaturated Fatty Acids Improve Mitochondrial Dysfunction in Brain Aging–Impact of Bcl-2 and NPD-1 like Metabolites. Prostaglandins Leukot. Essent. Fatty Acids 2015, 92, 23–31. https://doi.org/10.1016/j.plefa.2014.05.008.
(475) Sun, R.; Wang, X.; Liu, Y.; Xia, M. Dietary Supplementation with Fish Oil Alters the Expression Levels of Proteins Governing Mitochondrial Dynamics and Prevents High-Fat Diet-Induced Endothelial Dysfunction. Br. J. Nutr. 2014, 112 (2), 145–153. https://doi.org/10.1017/S0007114514000701.
(476) Lepretti, M.; Martucciello, S.; Burgos Aceves, M. A.; Putti, R.; Lionetti, L. Omega-3 Fatty Acids and Insulin Resistance: Focus on the Regulation of Mitochondria and Endoplasmic Reticulum Stress. Nutrients 2018, 10 (3). https://doi.org/10.3390/nu10030350.
(477) Aoun, M.; Feillet-Coudray, C.; Fouret, G.; Chabi, B.; Crouzier, D.; Ferreri, C.; Chatgilialoglu, C.; Wrutniak-Cabello, C.; Cristol, J. P.; Carbonneau, M.-A.; Coudray, C. Rat Liver Mitochondrial Membrane Characteristics and Mitochondrial Functions Are More Profoundly Altered by Dietary Lipid Quantity than by Dietary Lipid Quality: Effect of Different Nutritional Lipid Patterns. Br. J. Nutr. 2012, 107 (5), 647–659. https://doi.org/10.1017/S000711451100331X.
(478) Pliml, W.; von Arnim, T.; Stäblein, A.; Hofmann, H.; Zimmer, H. G.; Erdmann, E. Effects of Ribose on Exercise-Induced Ischaemia in Stable Coronary Artery Disease. Lancet 1992, 340 (8818), 507–510. https://doi.org/10.1016/0140-6736(92)91709-h.
(479) Hwang, P. S.; Machek, S. B.; Cardaci, T. D.; Wilburn, D. T.; Kim, C. S.; Suezaki, E. S.; Willoughby, D. S. Effects of Pyrroloquinoline Quinone (PQQ) Supplementation on Aerobic Exercise Performance and Indices of Mitochondrial Biogenesis in Untrained Men. J Am Coll Nutr 2019, 1–10. https://doi.org/10.1080/07315724.2019.1705203.
(480) Kumazawa, T.; Sato, K.; Seno, H.; Ishii, A.; Suzuki, O. Levels of Pyrroloquinoline Quinone in Various Foods. Biochem. J. 1995, 307 ( Pt 2), 331–333. https://doi.org/10.1042/bj3070331.