Pour aller à l’essentiel
- Le stress oxydatif est un processus indispensable à la vie mais générateur de radicaux libres ou espèces radicalaires oxygénées (ERO), des molécules instables, accélérant le vieillissement cellulaire. Tant que ce stress est contrôlé, notre organisme peut évoluer, s’adapter, se défendre voire même améliorer ses capacités. Par contre, un déséquilibre du stress oxydatif est à l’origine d’une altération des cellules et de leur fonctionnement, pouvant alors générer des pathologies notamment cancéreuses, des complications du diabète ou encore des maladies cardio-vasculaires.
- Les principaux facteurs de stress oxydant sont la sédentarité, l’activité physique intense, la pollution, le stress émotionnel, la dette de sommeil, le tabac, les pesticides, les polluants, les médicaments ou encore les UV du soleil.
- L’organisme dispose de deux systèmes de protection contre l’excès de stress oxydatif :
- Une protection endogène. Il peut s’agir de complexes enzymatiques dont deux principaux (SOD et GPX) sous la dépendance de minéraux (manganèse, zinc, cuivre et sélénium), mais aussi de composés spécifiques comme le glutathion, le coenzyme Q10 ou l’acide urique.
- Une protection alimentaire. Les aliments contiennent de nombreuses molécules aux propriétés antioxydantes, notamment les fruits, les légumes et de nombreux végétaux comme le cacao, le thé, les épices et les aromates. Il peut s’agir de vitamines (A, C ou E) mais aussi des composés dits phénoliques ou polyphénols. Ces molécules sont synthétisées par les aliments pour qu’ils puissent eux-mêmes se protéger contre les agents extérieurs. On comprend ainsi pourquoi les produits cultivés de manière industrielle (non bio) et donc trop protégés du milieu naturel extérieur sont pauvres en antioxydants. L’aliment n’ayant pas besoin de se protéger du fait de l’absence de situations stressantes, il fabrique moins d’antioxydants.
- En pratique, pour optimiser votre protection antioxydante au quotidien :
-
- Consommez au minium 2 portions de fruits et 3 de légumes par jour : des aliments frais, bio, colorés.
- Consommez des super-aliments tels que le gingembre, le curcuma, l’ail frais, l’oignon (les moins cuits possible), le jeune brocoli, le gingembre, les aromates et notamment le romarin, les baies, le thé (surtout vert et Pu’erh), le cacao.
- Cuisez vos aliments à la vapeur douce.
- Évitez les grillades et les hautes températures.
- Les compléments alimentaires peuvent être indiqués dans certaines indications comme l’arthrose, les troubles dégénératifs, les antécédents cardiovasculaires ou encore les troubles de la vision. Attention toutefois à l’excès d’antioxydants sous forme de compléments, qui à l’image des produits non bio, réduisent vos capacités naturelles à vous défendre, voire pour certains exerceront l’effet inverse de celui attendu.
Si vous souhaitez aller plus loin
Le stress oxydatif, un principe de vie et d’évolution
Le stress oxydant – ou oxydatif – est un processus physiologique indispensable à la vie1. Utilisée dans le monde de la biologie et de la médecine pour la première fois en 1985, cette expression définit plus précisément un état de déséquilibre entre les attaques issues d’espèces radicalaires oxygénées (ERO) et les capacités de défense dont dispose un organisme2. Les ERO, plus connues sous le terme de radicaux libres, sont des espèces chimiques possédant un électron non apparié (également qualifié de célibataire, ça ne s’invente pas !), leur conférant un caractère très instable vis-à-vis des molécules environnantes. C’est un peu comme le jeu de la patate chaude : l’oxygène devenu instable va piquer un électron à son voisin, qui devient instable à son tour et qui va donc faire de même à son autre voisin, et ainsi de suite jusqu’à provoquer un vieillissement accéléré des cellules. Toutefois, la nature ne fait jamais rien au hasard. Si ces molécules sont produites par l’organisme, c’est qu’elles exercent des rôles bénéfiques sur la santé et ce dès les première étapes de la vie3. Savez-vous que les spermatozoïdes percent la membrane de l’ovocyte en utilisant le stress oxydatif ? Prenons un autre exemple, les cellules souches. Celles-ci ont aussi besoin du stress oxydatif pour initier leur différenciation en cellules spécialisées tant au niveau musculaire, qu’adipocytaire, nerveux ou que des gamètes4-7. A l’inverse, les ERO en excès altèrent le processus de différenciation8. C’est également grâce au stress oxydatif que des situations comme le jeûne ou la restriction glucidique exercent leurs principaux effets bénéfiques9-11. Mais surtout, sans lui, ni vous ni moi ne vivrions bien longtemps. Face au moindre virus ou bactérie pathogène, nous ne résisterions pas. En effet, votre système immunitaire a besoin de produire des ERO pour détruire les microbes auxquels il est confronté. En cas d’infection, les cellules immunitaires phagocytent l’agent étranger et le bombarde de monoxyde d’azote (NO), de peroxyde d’hydrogène et d’ions hypochlorite12,13. Elles vont alors produire des radicaux superoxyde (O2•-) à l’origine d’une véritable explosion oxydative de l’agent infectieux phacocyté14-16. Il en est de même en cas de blessure. Certaines enzymes impliquées dans le processus de l’inflammation comme les cyclo-oxygénases (COX) ou les lipoxygénases (LOX) (qui représentent d’ailleurs les cibles des anti-inflammatoires non stéroïdiens) sont également pourvoyeuses d’ERO. Ces derniers sont indispensables à l’initiation du processus inflammatoire et à l’activation de ce que l’on nomme l’inflammasome NLRP3, afin de permettre la réparation tissulaire17-21.
Le stress oxydatif ainsi généré doit toutefois resté contrôlé afin d’éviter que les ERO n’exercent des effets délétères, notamment une atteinte mitochondriale trop importante22,23. A l’inverse, une stimulation insuffisante de ce stress oxydatif, par exemple en cas de supplémentation nutritionnelle inadaptée, peut altérer le processus d’activation et de prolifération de la réponse immunitaire24,25. Tout est donc encore une fois une question d’équilibre. Une personne en bonne santé, notamment au niveau immunitaire, n’aura aucun intérêt à se supplémenter en antioxydants, bien au contraire, à la différence d’une personne fragilisée pour qui un apport pourra se justifier afin de « calmer le jeu ». Ce mécanisme régulateur pose alors la question de l’intérêt d’apporter des antioxydants à un individu immunodéprimé, pouvant accroitre la difficulté pour celui-ci de se défendre efficacement en cas d’infections26. Pour autant, son état de dépression immunitaire peut s’expliquer en partie par un stress oxydatif chronique et un déficit en antioxydants. C’est pourquoi il est indispensable de définir une stratégie nutritionnelle personnalisée, en particulier en cas de supplémentation en composés spécifiques aux effets antioxydants.
Il existe une autre source majeure de radicaux libres au sein de votre organisme, vos centrales nucléaires. En transformant les nutriments en énergie, les mitochondries produisent en effet d’incroyables quantités de radicaux libres. D’autres molécules pro-oxydantes peuvent être produites, comme les radicaux peroxyle ou hydroxyperoxyle impliqués dans la peroxydation des acides gras et la déstabilisation des membranes cellulaires.
Autre pourvoyeur d’ERO, votre foie. Pour dénaturer les molécules xénobiotiques auxquelles vous êtes confronté(e) chaque jour, le foie s’appuie sur le principe du stress oxydatif. Il attaque en effet littéralement les molécules étrangères afin de les dénaturer et les rendre ainsi inactives, avant de les solubiliser pour les éliminer par les reins. Les cytochromes P450 (pour rappel les enzymes à l’origine de la dénaturation des molécules dans le foie, voir article dédié au pilier Xénobiotiques), assurent également l’oxydation de nombreux composés autres que les xénobiotiques comme les hormones stéroïdes, la vitamine D ou encore les acides gras insaturés.
Les peroxysomes sont des petits organiques ne contenant pas de matériel génétique et aux rôles multiples. Ils permettent notamment de dégrader les acides gras par oxydation (ce que l’on nomme la béta-oxydation), de fabriquer les acides biliaires ou encore de dégrader les protéines et tous les déchets présents dans le cytoplasme (on pourrait les considérer comme les éboueurs des cellules en quelque sorte). Or, pour assurer leurs rôles, ils génèrent un stress oxydatif important, notamment en produisant du peroxyde d’hydrogène (plus connu sous le terme d’eau oxygénée) qui va être utilisé par une enzyme clé, la catalase. Nous en reparlerons. Et je pourrais ainsi poursuivre la liste des pourvoyeurs de stress oxydatif dans l’organisme, à travers de nombreux autres exemples, à l’image de la xanthine oxydase éliminant les purines.
La dose fait le poison
Cette expression bien connue pourrait trouver son origine 120 ans avant Jésus-Christ. Cette année-là, le roi du pont (aujourd’hui la Turquie) Mithridate V organisa un somptueux banquet au cours duquel il fut empoisonné. Son fils ainé, craignant que sa mère lui préparât le même sort, s’exila pendant 7 ans pour ingérer régulièrement de petites doses de ce poison, convaincu qu’il deviendrait ainsi plus résistant à un empoisonnement potentiel. Il revint par la suite pour occuper le trône pendant les soixante années suivantes, tout en continuant de boire chaque jour un cocktail de 54 composés toxiques, nommé pour l’occasion Antidotum Mithridaticum. Son peuple et la famille royale firent de même pendant les 1900 années suivantes…
Une question d’équilibre
Comme vous l’avez certainement compris depuis le début de ce livre, la vie repose sur le principe d’équilibre cellulaire, l’homéostasie, à savoir le maintien d’une balance entre les sollicitations nécessaires à l’évolution des espèces, les stress cellulaires, et la capacité à se protéger des dommages collatéraux des ERO par des systèmes de protection efficients. Considéré dès 1956 par le Pr Harman comme à l’origine du veillissement27, le stress oxydatif apparait en réalité davantage comme un mécanisme régulateur complexe et vital bien plus que le simple responsable de l’altération des structures cellulaires28,29. D’ailleurs, une surexpression des enzymes antioxydantes n’apparait pas comme un facteur de protection supplémentaire contre le vieillissement30. Pour autant, lorsque les capacités de contrôle du stress oxydatif sont dépassées, soit parce les systèmes de défense sont insuffisants, soit car les agresseurs sont trop puissants ou trop nombreux, la situation peut rapidement se compliquer. Ces fameuses espèces radicalaires oxygénées, notamment le peroxyde d’hydrogène, s’attaquent en effet à l’ensemble des structures cellulaires. Il en résulte alors :
- Une attaque de l’ADN. Les ERO peuvent altérer l’ADN de nombreuses façons : en cassant le double brin qui caractérise cette molécule, en dégradant les bases ou en générant des mutations31. Il s’agit du mécanisme central à l’origine de la cancérogenèse mais aussi du vieillissement et des maladies neurodégénératives, cardiovasculaires ou encore auto-immunes1,32,33.
- Atteinte des protéines. Les espèces radicalaires peuvent dénaturer les protéines en les fragmentant. Il en résulte une perte de fonctions de ces protéines.
- Atteinte des lipides. Les ERO peuvent attaquer les acides gras et produire ce que l’on nomme une peroxydation lipidique. Les acides gras polyinsaturés y sont particulièrement sensibles, comme les oméga 3. Les lipoprotéines, en particulier les LDL, sont des molécules très sensibles à l’oxydation. Leur attaque par les ERO est d’ailleurs à l’origine de la formation des LDL oxydées.
- Glucose et stress oxydatif. Un terme est connu des personnes diabétiques : la glycation. Il s’agit d’un mécanisme à l’origine d’une altération des protéines lorsque le taux plasmatique de glucose est élevé. Les composés résultant de cette réaction sont nommés des produits avancés de la glycation (AGE)34 et sont aujourd’hui reconnus comme étant au cœur des complications vasculaires du diabète35. La réaction de Maillard est une réaction faisant appel à ce mécanisme de glycation et bien connue des cuisiniers car c’est elle qui permet de donner une saveur caractéristique à la viande grillée, à la croûte du pain ou encore au caramel (voir mon article sur les corps de Maillard).
Pour renforcer ses défenses en cas de stress oxydatif majeur, l’organisme va initier des modifications épigénétiques. En d’autres termes, les ERO peuvent agir comme de véritables messagers cellulaires intervenant sur différentes voies de régulation de l’expression des gènes36-39. Le stress oxydatif peut donc être considéré sous un angle positif, à savoir comme un moyen utilisé par les cellules pour s’adapter aux effets de l’environnement, à condition que ce stress demeure modéré. Nous retrouvons à nouveau le principe de l’hormèse évoqué dans l’article sur l’inflammation positive. Les ERO peuvent être considérés comme des messagers de la réponse inflammatoire.
Comment l’environnement vous expose-t-il au stress oxydatif ?
Ultra-violets et stress oxydatif. Les rayonnements du soleil, mais aussi les rayons X et gamma, sont de puissants initiateurs de stress oxydatif40. Ils provoquent d’ailleurs ce fameux teint halé, le bronzage, voire un coup de soleil si le stress oxydatif a été trop important du fait d’une exposition massive41.
La fumée de cigarette. Selon une revue systématique du Dr Pryor, chaque bouffée de cigarette équivaut à 1014 radicaux libres apportés par le goudron et 1015 par la fumée.
Les métaux lourds. Les ions métalliques à l’état libre comme le fer et le cuivre sont de très puissants pro-oxydants. On peut également citer le cadmium, le mercure, le nickel, le plomb, le chrome, le vanadium ou encore l’arsenic42.
L’alcool. Comme je l’ai évoqué dans le chapitre dédié au pilier mitochondrial, un des principaux mécanismes expliquant la toxicité de l’éthanol est justement son effet pro-oxydatif43, notamment envers les mitochondries neuronales44, hépatiques (expliquant la cirrhose) et cardiaques44,45.
Les médicaments. La toxicité de certains médicaments peut être provoquée par un stress oxydatif majeur, notamment au niveau du foie, des reins, du système cardiovasculaire et du système nerveux46. La doxorubicine (un antibiotique utilisé en chimiothérapie) est par exemple à l’origine d’une toxicité cardiaque47, l’azythromycine (un autre antibiotique) génère quant à lui une toxicité cardiaque, neuronale et musculaire48, le diclofenac (anti-inflammatoire) touche les reins et le foie49, la cysplatine (anticancéreux) les reins50, le paracétamol le foie51,52 et la chlorpromazine (antipsychotique) la peau53. Cette liste n’est malheureusement pas exhaustive.
Les biocides. Un des principes d’action des biocides est justement de générer un stress oxydatif majeur54, surtout pour altérer le fonctionnement des mitochondries. C’est par exemple le cas du diquat, du DDT et du paraquat55-59, mais aussi du pyrèthre (un insecticide naturel issu d’une plante vivace, le pyrèthre de Dalmatie, dont des traces peuvent être retrouvées dans le foie, les reins, le cerveau et les globules rouges)60-63, des composés organophosphorés64-67 ou encore du chloryrifos68,69. Une étude menée auprès d’agriculteurs de l’Oregon a mis en évidence un taux de 8-OHdG (un marqueur de dommage oxydatif de l’ADN) 8,5 fois plus élevé que dans la population contrôle70. C’est une des raisons expliquant les effets cancérogènes de certains biocides71-74.
Les polluants. De nombreux polluants autres que les biocides exercent leurs effets délétères par des dommages oxydatifs, à l’image des PCB75-77, dioxines78-80, bisphénols A, F et S81-87, mais aussi d’édulcorants (aspartam88,89, sucralose90,91), d’additifs comme le polysorbate 80,92,93, de nanoparticules94,95 et notamment du dioxyde de titane96-99.
La dette de sommeil. Une dette de sommeil, en particulier dans sa phase paradoxale, augmente le niveau de stress oxydatif dans l’hippocampe, le thalamus et l’hypothalamus100. Dès 1994, le Pr Reimund émit l’hypothèse qu’un des principaux rôles du sommeil consisterait à réparer les dommages oxydatifs générés au cours de la phase d’éveil101,100. Les études apparaissent toutefois contradictoires102-106. L’explication se trouverait dans la récurrence de dette de sommeil : alors que chez l’animal un manque de sommeil ponctuel a plutôt tendance à renforçer l’activité antioxydante de l’organisme dans un objectif adaptatif, une dette chronique quant à elle affaiblit progressivement la protection antioxydante107,108. Un niveau élevé de stress oxydatif semblerait même agir comme un inducteur du sommeil dans le but de lancer le processus de réparation des dommages cellulaires. A l’inverse, une quantité modérée d’ERO favoriserait l’état de veille109,110,26.
Les émotions. Des ERO sont ainsi produits en permanence par les quelques 86 billions (86 000 milliards) de neurones aux conséquences multiples sur le fonctionnement cérébral111,112. Ils jouent par exemple un rôle essentiel au développement et à la régénération neuronal113,114, mais aussi à la régulation des neuromédiateurs115,116. Un stress oxydatif chronique peut toutefois altérer la communication et l’intégrité de la membrane des neurones, voire leur mort117. Les mécanismes de certains antidépresseurs s’appuient d’ailleurs sur la réduction des dommages oxydatifs118-122.
L’activité physique. Elle permet d’améliorer, tant au niveau quantitatif que qualitatif, les systèmes de réparation induits par les dommages oxydatifs et le niveau de protection antioxydante. Cette adaptation positive est permise grâce à la stimulation de la biogénèse mitochondriale via des mécanismes épigénétiques. Lorsqu’ils demeurent contrôlés, les ERO peuvent donc être considérés comme des inducteurs de l’adaptation à l’effort123-125, y compris pour favoriser le développement de la force126 et ce de manière dose-dépendante. Une telle capacité d’adaptation aurait d’ailleurs contribué, selon de nombreux auteurs, à l’évolution de l’homme au cours des derniers millions d’années127-129. En clair, vous avez besoin de stress oxydatif pour améliorer vos performances.
Le stress oxydatif est étroitement lié à l’inflammation de bas-grade et je vous invite à en découvrir les mécanismes dédiés au chapitre dédié au pilier correspondant. Les principales conséquences d’un stress oxydatif majeur et chronique sont multiples : cancer130,131, maladies cardiovasculaires132-134, diabète de type 2135-137, maladies neurologiques138,139, polyarthrite rhumatoïde140-142, maladies auto-immunes143,144, DMLA (Dégénérescence Maculaire Liée à l’Age)145,146, cataracte147,148, arthrose149-151, ostéoporose152,153 ou encore vieillissement cutané154,155 (les fameuses rides mais aussi les taches brunes ou nævus).
Les LDL oxydés, les véritables coupables des risques cardiovasculaires ?
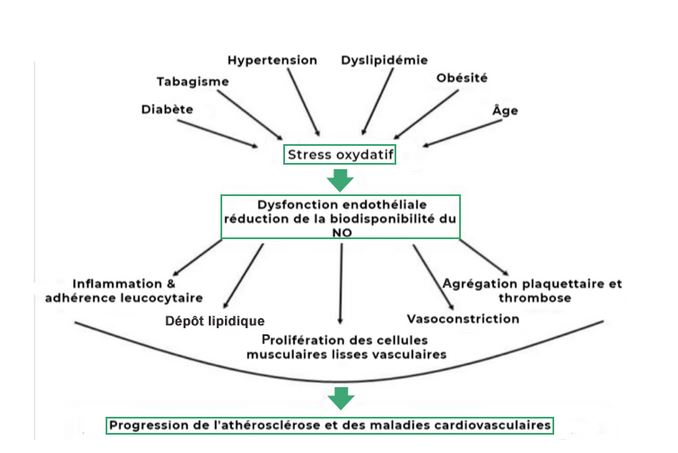
Davantage que l’accumulation de LDL dans le sang, c’est en effet leur oxydation qui est aujourd’hui considérée comme le facteur initiant les réactions pro-inflammatoires et conduisant à l’établissement, puis au développement de la plaque d’athérome133,156-159,160-163. Une fois oxydés, ces LDL augmentent l’expression de certains récepteurs à la surface des cellules endothéliales (les LOX-1157,162,164), ce qui engendre une mobilisation accrue des monocytes vers la paroi du vaisseau à l’origine d’une sécrétion importante de molécules inflammatoires (la vitamine E est un antioxydant particulièrement intéressant dans cette situation dans la mesure où elle réduit l’expression de ces molécules d’adhésion)165. Les monocytes infiltrés vont ensuite se différencier en macrophages se gorgeant des lipides oxydés pour devenir les fameuses cellules spumeuses et provoquer des stries lipidiques lorsqu’elles s’agrègent entre elles. En soi, un tel processus est bénéfique dans la mesure où il permet d’éliminer les LDL qui ne sont plus fonctionnels car oxydés. Toutefois, lorsque ces derniers sont présents en trop grande quantité, il en résulte des dommages de la paroi vasculaire à l’origine de la formation d’une chape fibreuse augmentant fortement le risque cardiovasculaire. Cette dernière est un amas de composés (collagène, fibronectine et glycosaminoglycanes) fabriqués par les cellules musculaires lisses et entourés de lymphocytes T renforçant encore davantage l’inflammation166. Dans un tel contexte, la précipitation de phosphate de calcium dans l’intima conduit à réduire l’élasticité artérielle et à une potentielle rupture de la plaque d’athérome sous l’effet du stress oxydatif158,167,168. Certains composés sont alors libérés, entraînant une thrombose, une occlusion de la lumière artérielle et une ischémie tissulaire. En d’autres termes, un infarctus du myocarde, un AVC ou une gangrène en fonction de la localisation. Même s’ils restent à confirmer chez des personnes en bonne santé, les effets bénéfiques des antioxydants sur l’oxydation des LDL est bien établie chez les individus à haut risque cardiovasculaire169,170.
Progression des facteurs de risque à l’athérosclérose et aux maladies cardiovasculaires médiées par le stress oxydatif et le dysfonctionnement endothélial. D’après Kyoung-Ha et al,. 2015171
Comment réguler le stress oxydatif ?
En introduction, il est important de comprendre qu’il existe deux moyens principaux pour vous protéger du stress oxydatif. Vous disposez nos seulement de vos propres systèmes de défense, ce sont en quelque sorte vos pompiers intérieurs, mais aussi de brigades extérieures, les antioxydants végétaux.
Les systèmes de protection endogène
Les cellules disposent de nombreux pompiers, valeureux et efficaces. Il peut s’agir d’enzymes, que l’on nomme catalase, SOD et GPX, ou de molécules spécifiques :
- La catalase
- Les glutathion peroxydases (GPx). La famille des GPx (il en existe cinq différentes) est la première des deux principales enzymes antioxydantes dépendantes du statut nutritionnel. Elle a en effet besoin de sélénium pour assurer ses fonctions et fait appel à un composé central dans la gestion du stress oxydatif, le glutathion.
- Les super oxydes dysmutases (SOD). Il s’agit de la première ligne de défense contre le stress oxydatif. Au nombre de trois, les SOD sont dépendant du zinc, du cuivre et du manganèse.
- Le glutathion.
- L’acide alpha-lipoïque.
- Le Coenzyme Q10.
- L’acide urique. Il est souvent considéré comme un composé néfaste pour la santé du fait de sa responsabilité dans l’apparition des crises de goutte, notamment car il est le produit terminal principal du métabolisme des purines chez l’homme. Il représente pourtant un allier particulièrement puissant pour se protéger du stress oxydatif dès lors que sa concentration sanguine reste physiologique172.
Lorsque le stress oxydatif est modéré et les mitochondries fonctionnelles, les enzymes endogènes sont en mesure d’accroitre leur activité, tant en termes d’efficacité que de nombre et ce afin d’assurer une protection optimisée. C’est le principe de l’hormèse si fréquemment évoqué et permettant à l’organisme d’améliorer son fonctionnement. Néanmoins, un tel mécanisme possède ses limites. Aussi efficient soit-il, il n’est pas à lui seul suffisant pour neutraliser les ERO auxquelles est soumis l’organisme au quotidien, d’autant plus si le stress oxydatif est important et/ou chronique, ou s’il existe des déficits dans les minéraux indispensables au bon fonctionnement des enzymes (zinc, cuivre, manganèse et/ou sélénium). C’est alors qu’entrent en scène les antioxydants végétaux173.
Je vous invite donc désormais à découvrir mon article Comment optimiser votre statut en antioxydants ?
Anthony Berthou
Sources :
- Dröge W. Free radicals in the physiological control of cell function. Physiol Rev. 2002;82(1):47-95. doi:10.1152/physrev.00018.2001
- Sies H. What is Oxidative Stress? In: Keaney JF, ed. Oxidative Stress and Vascular Disease. Developments in Cardiovascular Medicine. Springer US; 2000:1-8. doi:10.1007/978-1-4615-4649-8_1
- Beckman KB, Ames BN. The free radical theory of aging matures. Physiol Rev. 1998;78(2):547-581. doi:10.1152/physrev.1998.78.2.547
- Tormos KV, Anso E, Hamanaka RB, et al. Mitochondrial complex III ROS regulate adipocyte differentiation. Cell Metab. 2011;14(4):537-544. doi:10.1016/j.cmet.2011.08.007
- Le Belle JE, Orozco NM, Paucar AA, et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 2011;8(1):59-71. doi:10.1016/j.stem.2010.11.028
- Malinska D, Kudin AP, Bejtka M, Kunz WS. Changes in mitochondrial reactive oxygen species synthesis during differentiation of skeletal muscle cells. Mitochondrion. 2012;12(1):144-148. doi:10.1016/j.mito.2011.06.015
- Morimoto H, Iwata K, Ogonuki N, et al. ROS are required for mouse spermatogonial stem cell self-renewal. Cell Stem Cell. 2013;12(6):774-786. doi:10.1016/j.stem.2013.04.001
- Hom JR, Quintanilla RA, Hoffman DL, et al. The Permeability Transition Pore Controls Cardiac Mitochondrial Maturation and Myocyte Differentiation. Dev Cell. 2011;21(3):469-478. doi:10.1016/j.devcel.2011.08.008
- Schulz TJ, Zarse K, Voigt A, Urban N, Birringer M, Ristow M. Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress. Cell Metab. 2007;6(4):280-293. doi:10.1016/j.cmet.2007.08.011
- Lee S-J, Hwang AB, Kenyon C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity. Curr Biol. 2010;20(23):2131-2136. doi:10.1016/j.cub.2010.10.057
- Zarse K, Schmeisser S, Groth M, et al. Impaired insulin/IGF1 signaling extends life span by promoting mitochondrial L-proline catabolism to induce a transient ROS signal. Cell Metab. 2012;15(4):451-465. doi:10.1016/j.cmet.2012.02.013
- Förstermann U, Sessa WC. Nitric oxide synthases: regulation and function. Eur Heart J. 2012;33(7):829-837, 837a-837d. doi:10.1093/eurheartj/ehr304
- Winterbourn CC, Kettle AJ. Redox reactions and microbial killing in the neutrophil phagosome. Antioxid Redox Signal. 2013;18(6):642-660. doi:10.1089/ars.2012.4827
- Lambeth JD. NOX enzymes and the biology of reactive oxygen. Nat Rev Immunol. 2004;4(3):181-189. doi:10.1038/nri1312
- Bedard K, Krause K-H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol Rev. 2007;87(1):245-313. doi:10.1152/physrev.00044.2005
- Brewer TF, Garcia FJ, Onak CS, Carroll KS, Chang CJ. Chemical approaches to discovery and study of sources and targets of hydrogen peroxide redox signaling through NADPH oxidase proteins. Annu Rev Biochem. 2015;84:765-790. doi:10.1146/annurev-biochem-060614-034018
- Cruz CM, Rinna A, Forman HJ, Ventura ALM, Persechini PM, Ojcius DM. ATP activates a reactive oxygen species-dependent oxidative stress response and secretion of proinflammatory cytokines in macrophages. J Biol Chem. 2007;282(5):2871-2879. doi:10.1074/jbc.M608083200
- Dostert C, Pétrilli V, Van Bruggen R, Steele C, Mossman BT, Tschopp J. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science. 2008;320(5876):674-677. doi:10.1126/science.1156995
- Tschopp J, Schroder K. NLRP3 inflammasome activation: The convergence of multiple signalling pathways on ROS production? Nat Rev Immunol. 2010;10(3):210-215. doi:10.1038/nri2725
- Nakahira K, Haspel JA, Rathinam VAK, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome. Nat Immunol. 2011;12(3):222-230. doi:10.1038/ni.1980
- Bulua AC, Simon A, Maddipati R, et al. Mitochondrial reactive oxygen species promote production of proinflammatory cytokines and are elevated in TNFR1-associated periodic syndrome (TRAPS). J Exp Med. 2011;208(3):519-533. doi:10.1084/jem.20102049
- Wang D, Malo D, Hekimi S. Elevated mitochondrial reactive oxygen species generation affects the immune response via hypoxia-inducible factor-1alpha in long-lived Mclk1+/- mouse mutants. J Immunol. 2010;184(2):582-590. doi:10.4049/jimmunol.0902352
- Kong X, Thimmulappa R, Craciun F, et al. Enhancing Nrf2 pathway by disruption of Keap1 in myeloid leukocytes protects against sepsis. Am J Respir Crit Care Med. 2011;184(8):928-938. doi:10.1164/rccm.201102-0271OC
- Chaudhri G, Clark IA, Hunt NH, Cowden WB, Ceredig R. Effect of antioxidants on primary alloantigen-induced T cell activation and proliferation. J Immunol. 1986;137(8):2646-2652.
- Laniewski NG, Grayson JM. Antioxidant treatment reduces expansion and contraction of antigen-specific CD8+ T cells during primary but not secondary viral infection. J Virol. 2004;78(20):11246-11257. doi:10.1128/JVI.78.20.11246-11257.2004
- Schieber M, Chandel NS. ROS function in redox signaling and oxidative stress. Curr Biol. 2014;24(10):R453-462. doi:10.1016/j.cub.2014.03.034
- Harman D. Aging: a theory based on free radical and radiation chemistry. J Gerontol. 1956;11(3):298-300. doi:10.1093/geronj/11.3.298
- Van Raamsdonk JM, Hekimi S. Reactive Oxygen Species and Aging in Caenorhabditis elegans: Causal or Casual Relationship? Antioxid Redox Signal. 2010;13(12):1911-1953. doi:10.1089/ars.2010.3215
- Ristow M, Schmeisser S. Extending life span by increasing oxidative stress. Free Radic Biol Med. 2011;51(2):327-336. doi:10.1016/j.freeradbiomed.2011.05.010
- Pérez VI, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009;8(1):73-75. doi:10.1111/j.1474-9726.2008.00449.x
- Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Oxidative DNA damage: mechanisms, mutation, and disease. FASEB J. 2003;17(10):1195-1214. doi:10.1096/fj.02-0752rev
- Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 2007;87(1):315-424. doi:10.1152/physrev.00029.2006
- Halliwell B. Biochemistry of oxidative stress. Biochem Soc Trans. 2007;35(Pt 5):1147-1150. doi:10.1042/BST0351147
- Vlassara H, Palace MR. Diabetes and advanced glycation endproducts. Journal of Internal Medicine. 2002;251(2):87-101. doi:10.1046/j.1365-2796.2002.00932.x
- Huebschmann AG, Regensteiner JG, Vlassara H, Reusch JEB. Diabetes and advanced glycoxidation end products. Diabetes Care. 2006;29(6):1420-1432. doi:10.2337/dc05-2096
- Haddad JJ. Oxygen sensing and oxidant/redox-related pathways. Biochem Biophys Res Commun. 2004;316(4):969-977. doi:10.1016/j.bbrc.2004.02.162
- Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidative stress and cell signalling. Curr Med Chem. 2004;11(9):1163-1182. doi:10.2174/0929867043365323
- Finkel T. Signal transduction by reactive oxygen species. J Cell Biol. 2011;194(1):7-15. doi:10.1083/jcb.201102095
- Lushchak VI. Free radicals, reactive oxygen species, oxidative stress and its classification. Chem Biol Interact. 2014;224:164-175. doi:10.1016/j.cbi.2014.10.016
- Narendhirakannan RT, Hannah MAC. Oxidative Stress and Skin Cancer: An Overview. Indian J Clin Biochem. 2013;28(2):110-115. doi:10.1007/s12291-012-0278-8
- Iwanaga M, Mori K, Iida T, et al. Nuclear factor kappa B dependent induction of gamma glutamylcysteine synthetase by ionizing radiation in T98G human glioblastoma cells. Free Radic Biol Med. 1998;24(7-8):1256-1268. doi:10.1016/s0891-5849(97)00443-7
- Stohs SJ, Bagchi D. Oxidative mechanisms in the toxicity of metal ions. Free Radic Biol Med. 1995;18(2):321-336. doi:10.1016/0891-5849(94)00159-h
- Albano E. Alcohol, oxidative stress and free radical damage. Proc Nutr Soc. 2006;65(3):278-290. doi:10.1079/pns2006496
- Mansouri A, Demeilliers C, Amsellem S, Pessayre D, Fromenty B. Acute ethanol administration oxidatively damages and depletes mitochondrial dna in mouse liver, brain, heart, and skeletal muscles: protective effects of antioxidants. J Pharmacol Exp Ther. 2001;298(2):737-743.
- Piano MR. Alcohol’s Effects on the Cardiovascular System. Alcohol Res. 2017;38(2):219-241.
- Deavall DG, Martin EA, Horner JM, Roberts R. Drug-Induced Oxidative Stress and Toxicity. J Toxicol. 2012;2012. doi:10.1155/2012/645460
- Sawyer DB, Peng X, Chen B, Pentassuglia L, Lim CC. Mechanisms of Anthracycline Cardiac Injury: Can we identify strategies for cardio-protection? Prog Cardiovasc Dis. 2010;53(2):105-113. doi:10.1016/j.pcad.2010.06.007
- Kline ER, Bassit L, Hernandez-Santiago BI, et al. Long-Term Exposure to AZT, but not d4T, Increases Endothelial Cell Oxidative Stress and Mitochondrial Dysfunction. Cardiovasc Toxicol. 2009;9(1):1-12. doi:10.1007/s12012-008-9029-8
- Hickey EJ, Raje RR, Reid VE, Gross SM, Ray SD. Diclofenac induced in vivo nephrotoxicity may involve oxidative stress-mediated massive genomic DNA fragmentation and apoptotic cell death. Free Radic Biol Med. 2001;31(2):139-152. doi:10.1016/s0891-5849(01)00560-3
- Chirino YI, Pedraza-Chaverri J. Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity. Exp Toxicol Pathol. 2009;61(3):223-242. doi:10.1016/j.etp.2008.09.003
- Stirnimann G, Kessebohm K, Lauterburg B. Liver injury caused by drugs: an update. Swiss Med Wkly. 2010;140:w13080. doi:10.4414/smw.2010.13080
- Wang X, Wu Q, Liu A, et al. Paracetamol: overdose-induced oxidative stress toxicity, metabolism, and protective effects of various compounds in vivo and in vitro. Drug Metab Rev. 2017;49(4):395-437. doi:10.1080/03602532.2017.1354014
- Onoue S, Kawamura K, Igarashi N, et al. Reactive oxygen species assay-based risk assessment of drug-induced phototoxicity: classification criteria and application to drug candidates. J Pharm Biomed Anal. 2008;47(4-5):967-972. doi:10.1016/j.jpba.2008.03.026
- Abdollahi M, Ranjbar A, Shadnia S, Nikfar S, Rezaie A. Pesticides and oxidative stress: a review. Med Sci Monit. 2004;10(6):RA141-147.
- Ranjbar A, Pasalar P, Sedighi A, Abdollahi M. Induction of oxidative stress in paraquat formulating workers. Toxicol Lett. 2002;131(3):191-194. doi:10.1016/s0378-4274(02)00033-4
- Yumino K, Kawakami I, Tamura M, Hayashi T, Nakamura M. Paraquat- and diquat-induced oxygen radical generation and lipid peroxidation in rat brain microsomes. J Biochem. 2002;131(4):565-570. doi:10.1093/oxfordjournals.jbchem.a003135
- Kim H-S, Manevich Y, Feinstein SI, Pak JH, Ho YS, Fisher AB. Induction of 1-cys peroxiredoxin expression by oxidative stress in lung epithelial cells. Am J Physiol Lung Cell Mol Physiol. 2003;285(2):L363-369. doi:10.1152/ajplung.00078.2003
- Pérez FJ, Maureira V. Inactivation in vivo of basic peroxidase and increased content of H2O2 in grapevine leaves post treatment with DTT and paraquat. J Plant Physiol. 2003;160(6):645-650. doi:10.1078/0176-1617-00826
- Milczarek R, Sokołowska E, Rybakowska I, Kaletha K, Klimek J. Paraquat inhibits progesterone synthesis in human placental mitochondria. Placenta. 2016;43:41-46. doi:10.1016/j.placenta.2016.04.019
- Gupta A, Nigam D, Gupta A, Shukla GS, Agarwal AK. Effect of pyrethroid-based liquid mosquito repellent inhalation on the blood-brain barrier function and oxidative damage in selected organs of developing rats. J Appl Toxicol. 1999;19(1):67-72. doi:10.1002/(sici)1099-1263(199901/02)19:1<67::aid-jat540>3.0.co;2-#
- Kale M, Rathore N, John S, Bhatnagar D. Lipid peroxidative damage on pyrethroid exposure and alterations in antioxidant status in rat erythrocytes: a possible involvement of reactive oxygen species. Toxicol Lett. 1999;105(3):197-205. doi:10.1016/s0378-4274(98)00399-3
- Giray B, Gürbay A, Hincal F. Cypermethrin-induced oxidative stress in rat brain and liver is prevented by vitamin E or allopurinol. Toxicol Lett. 2001;118(3):139-146. doi:10.1016/s0378-4274(00)00277-0
- Gabbianelli R, Falcioni G, Nasuti C, Cantalamessa F. Cypermethrin-induced plasma membrane perturbation on erythrocytes from rats: reduction of fluidity in the hydrophobic core and in glutathione peroxidase activity. Toxicology. 2002;175(1-3):91-101. doi:10.1016/s0300-483x(02)00058-6
- Banerjee BD, Seth V, Bhattacharya A, Pasha ST, Chakraborty AK. Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers. Toxicol Lett. 1999;107(1-3):33-47. doi:10.1016/s0378-4274(99)00029-6
- Ranjbar A, Pasalar P, Abdollahi M. Induction of oxidative stress and acetylcholinesterase inhibition in organophosphorous pesticide manufacturing workers. Hum Exp Toxicol. 2002;21(4):179-182. doi:10.1191/0960327102ht238oa
- Dantoine T, Debord J, Merle L, Charmes J-P. [From organophosphate compound toxicity to atherosclerosis: role of paraoxonase 1]. Rev Med Interne. 2003;24(7):436-442. doi:10.1016/s0248-8663(03)00058-4
- Pearson JN, Patel M. The role of oxidative stress in organophosphate and nerve agent toxicity. Ann N Y Acad Sci. 2016;1378(1):17-24. doi:10.1111/nyas.13115
- Gultekin F, Ozturk M, Akdogan M. The effect of organophosphate insecticide chlorpyrifos-ethyl on lipid peroxidation and antioxidant enzymes (in vitro). Arch Toxicol. 2000;74(9):533-538. doi:10.1007/s002040000167
- Gupta RC, Milatovic D, Dettbarn WD. Depletion of energy metabolites following acetylcholinesterase inhibitor-induced status epilepticus: protection by antioxidants. Neurotoxicology. 2001;22(2):271-282. doi:10.1016/s0161-813x(01)00013-4
- Kisby GE, Muniz JF, Scherer J, et al. Oxidative Stress and DNA Damage in Agricultural Workers. Journal of Agromedicine. 2009;14(2):206-214. doi:10.1080/10599240902824042
- Alavanja MCR, Ross MK, Bonner MR. Increased cancer burden among pesticide applicators and others due to pesticide exposure. CA Cancer J Clin. 2013;63(2):120-142. doi:10.3322/caac.21170
- Alavanja MCR, Ross MK, Bonner MR. Reply to Increased cancer burden among pesticide applicators and others due to pesticide exposure. CA Cancer J Clin. 2013;63(5):366-367. doi:10.3322/caac.21193
- Mostafalou S, Abdollahi M. Pesticides: an update of human exposure and toxicity. Arch Toxicol. 2017;91(2):549-599. doi:10.1007/s00204-016-1849-x
- Gunier RB, Kang A, Hammond SK, et al. A task-based assessment of parental occupational exposure to pesticides and childhood acute lymphoblastic leukemia. Environ Res. 2017;156:57-62. doi:10.1016/j.envres.2017.03.001
- Hennig B, Hammock BD, Slim R, Toborek M, Saraswathi V, Robertson LW. PCB-induced oxidative stress in endothelial cells: modulation by nutrients. Int J Hyg Environ Health. 2002;205(1-2):95-102. doi:10.1078/1438-4639-00134
- Zhu Y, Kalen AL, Li L, et al. Polychlorinated biphenyl (PCB) – Induced oxidative stress and cytotoxicity can be mitigated by antioxydants following exposure. Free Radic Biol Med. 2009;47(12):1762-1771. doi:10.1016/j.freeradbiomed.2009.09.024
- Bavithra S, Selvakumar K, Pratheepa Kumari R, Krishnamoorthy G, Venkataraman P, Arunakaran J. Polychlorinated biphenyl (PCBs)-induced oxidative stress plays a critical role on cerebellar dopaminergic receptor expression: ameliorative role of quercetin. Neurotox Res. 2012;21(2):149-159. doi:10.1007/s12640-011-9253-z
- Stohs SJ. Oxidative stress induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Free Radical Biology and Medicine. 1990;9(1):79-90. doi:10.1016/0891-5849(90)90052-K
- Yoshida R, Ogawa Y. Oxidative stress induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin: an application of oxidative stress markers to cancer risk assessment of dioxins. Ind Health. 2000;38(1):5-14. doi:10.2486/indhealth.38.5
- Reichard JF, Dalton TP, Shertzer HG, Puga A. Induction of Oxidative Stress Responses by Dioxin and other Ligands of the Aryl Hydrocarbon Receptor. Dose Response. 2006;3(3):306-331. doi:10.2203/dose-response.003.03.003
- Rochester JR. Bisphenol A and human health: a review of the literature. Reprod Toxicol. 2013;42:132-155. doi:10.1016/j.reprotox.2013.08.008
- Babu S, Uppu S, Claville MO, Uppu RM. Prooxidant actions of bisphenol A (BPA) phenoxyl radicals: implications to BPA-related oxidative stress and toxicity. Toxicol Mech Methods. 2013;23(4):273-280. doi:10.3109/15376516.2012.753969
- Seachrist DD, Bonk KW, Ho S-M, Prins GS, Soto AM, Keri RA. A review of the carcinogenic potential of bisphenol A. Reprod Toxicol. 2016;59:167-182. doi:10.1016/j.reprotox.2015.09.006
- Gassman NR. Induction of oxidative stress by bisphenol A and its pleiotropic effects. Environ Mol Mutagen. 2017;58(2):60-71. doi:10.1002/em.22072
- Maćczak A, Cyrkler M, Bukowska B, Michałowicz J. Bisphenol A, bisphenol S, bisphenol F and bisphenol AF induce different oxidative stress and damage in human red blood cells (in vitro study). Toxicol In Vitro. 2017;41:143-149. doi:10.1016/j.tiv.2017.02.018
- Zhang Z, Lin L, Gai Y, Hong Y, Li L, Weng L. Subchronic bisphenol S exposure affects liver function in mice involving oxidative damage. Regulatory Toxicology and Pharmacology. 2018;92:138-144. doi:10.1016/j.yrtph.2017.11.018
- Meng Z, Tian S, Yan J, et al. Effects of perinatal exposure to BPA, BPF and BPAF on liver function in male mouse offspring involving in oxidative damage and metabolic disorder. Environ Pollut. 2019;247:935-943. doi:10.1016/j.envpol.2019.01.116
- Iyyaswamy A, Rathinasamy S. Effect of chronic exposure to aspartame on oxidative stress in the brain of albino rats. J Biosci. 2012;37(4):679-688. doi:10.1007/s12038-012-9236-0
- Choudhary AK, Lee YY. Neurophysiological symptoms and aspartame: What is the connection? Nutr Neurosci. 2018;21(5):306-316. doi:10.1080/1028415X.2017.1288340
- Eriksson Wiklund A-K, Adolfsson-Erici M, Liewenborg B, Gorokhova E. Sucralose Induces Biochemical Responses in Daphnia magna. PLoS One. 2014;9(4). doi:10.1371/journal.pone.0092771
- Heredia-García G, Gómez-Oliván LM, Orozco-Hernández JM, et al. Alterations to DNA, apoptosis and oxidative damage induced by sucralose in blood cells of Cyprinus carpio. Sci Total Environ. 2019;692:411-421. doi:10.1016/j.scitotenv.2019.07.165
- Tatsuishi T, Oyama Y, Iwase K, et al. Polysorbate 80 increases the susceptibility to oxidative stress in rat thymocytes. Toxicology. 2005;207(1):7-14. doi:10.1016/j.tox.2004.07.020
- Yuan Z-Y, Hu Y-L, Gao J-Q. Brain Localization and Neurotoxicity Evaluation of Polysorbate 80-Modified Chitosan Nanoparticles in Rats. PLoS ONE. 2015;10(8):e0134722. doi:10.1371/journal.pone.0134722
- Manke A, Wang L, Rojanasakul Y. Mechanisms of Nanoparticle-Induced Oxidative Stress and Toxicity. Biomed Res Int. 2013;2013. doi:10.1155/2013/942916
- Zuberek M, Grzelak A. Nanoparticles-Caused Oxidative Imbalance. Adv Exp Med Biol. 2018;1048:85-98. doi:10.1007/978-3-319-72041-8_6
- Bhattacharya K, Davoren M, Boertz J, Schins RP, Hoffmann E, Dopp E. Titanium dioxide nanoparticles induce oxidative stress and DNA-adduct formation but not DNA-breakage in human lung cells. Part Fibre Toxicol. 2009;6:17. doi:10.1186/1743-8977-6-17
- Shukla RK, Kumar A, Pandey AK, Singh SS, Dhawan A. Titanium dioxide nanoparticles induce oxidative stress-mediated apoptosis in human keratinocyte cells. J Biomed Nanotechnol. 2011;7(1):100-101. doi:10.1166/jbn.2011.1221
- Pérez-Arizti JA, Ventura-Gallegos JL, Galván Juárez RE, Ramos-Godinez MDP, Colín-Val Z, López-Marure R. Titanium dioxide nanoparticles promote oxidative stress, autophagy and reduce NLRP3 in primary rat astrocytes. Chem Biol Interact. 2020;317:108966. doi:10.1016/j.cbi.2020.108966
- Ferraro SA, Domingo MG, Etcheverrito A, Olmedo DG, Tasat DR. Neurotoxicity mediated by oxidative stress caused by titanium dioxide nanoparticles in human neuroblastoma (SH-SY5Y) cells. J Trace Elem Med Biol. 2020;57:126413. doi:10.1016/j.jtemb.2019.126413
- Singh R, Kiloung J, Singh S, Sharma D. Effect of paradoxical sleep deprivation on oxidative stress parameters in brain regions of adult and old rats. Biogerontology. 2008;9(3):153-162. doi:10.1007/s10522-008-9124-z
- Reimund E. The free radical flux theory of sleep. Med Hypotheses. 1994;43(4):231-233. doi:10.1016/0306-9877(94)90071-x
- D’Almeida V, Hipólide DC, Azzalis LA, Lobo LL, Junqueira VB, Tufik S. Absence of oxidative stress following paradoxical sleep deprivation in rats. Neurosci Lett. 1997;235(1-2):25-28. doi:10.1016/s0304-3940(97)00706-4
- D’Almeida V, Lobo LL, Hipólide DC, de Oliveira AC, Nobrega JN, Tufik S. Sleep deprivation induces brain region-specific decreases in glutathione levels. Neuroreport. 1998;9(12):2853-2856. doi:10.1097/00001756-199808240-00031
- Ramanathan L, Gulyani S, Nienhuis R, Siegel JM. Sleep deprivation decreases superoxide dismutase activity in rat hippocampus and brainstem. Neuroreport. 2002;13(11):1387-1390. doi:10.1097/00001756-200208070-00007
- Gopalakrishnan A, Ji LL, Cirelli C. Sleep deprivation and cellular responses to oxidative stress. Sleep. 2004;27(1):27-35. doi:10.1093/sleep/27.1.27
- Ramanathan L, Hu S, Frautschy SA, Siegel JM. Short-term total sleep deprivation in the rat increases antioxidant responses in multiple brain regions without impairing spontaneous alternation behavior. Behav Brain Res. 2010;207(2):305-309. doi:10.1016/j.bbr.2009.10.014
- Donlea JM, Thimgan MS, Suzuki Y, Gottschalk L, Shaw PJ. Inducing sleep by remote control facilitates memory consolidation in Drosophila. Science. 2011;332(6037):1571-1576. doi:10.1126/science.1202249
- Hill VM, O’Connor RM, Sissoko GB, et al. A bidirectional relationship between sleep and oxidative stress in Drosophila. PLoS Biol. 2018;16(7). doi:10.1371/journal.pbio.2005206
- Ikeda M, Ikeda-Sagara M, Okada T, et al. Brain oxidation is an initial process in sleep induction. Neuroscience. 2005;130(4):1029-1040. doi:10.1016/j.neuroscience.2004.09.057
- Mittler R, Vanderauwera S, Suzuki N, et al. ROS signaling: the new wave? Trends Plant Sci. 2011;16(6):300-309. doi:10.1016/j.tplants.2011.03.007
- Magistretti PJ, Allaman I. A cellular perspective on brain energy metabolism and functional imaging. Neuron. 2015;86(4):883-901. doi:10.1016/j.neuron.2015.03.035
- Cobley JN, Fiorello ML, Bailey DM. 13 reasons why the brain is susceptible to oxidative stress. Redox Biol. 2018;15:490-503. doi:10.1016/j.redox.2018.01.008
- Dickinson BC, Peltier J, Stone D, Schaffer DV, Chang CJ. Nox2 redox signaling maintains essential cell populations in the brain. Nat Chem Biol. 2011;7(2):106-112. doi:10.1038/nchembio.497
- Meda F, Gauron C, Rampon C, Teillon J, Volovitch M, Vriz S. Nerves Control Redox Levels in Mature Tissues Through Schwann Cells and Hedgehog Signaling. Antioxid Redox Signal. 2016;24(6):299-311. doi:10.1089/ars.2015.6380
- Youdim MBH, Edmondson D, Tipton KF. The therapeutic potential of monoamine oxidase inhibitors. Nat Rev Neurosci. 2006;7(4):295-309. doi:10.1038/nrn1883
- Booth DM, Enyedi B, Geiszt M, Várnai P, Hajnóczky G. Redox Nanodomains Are Induced by and Control Calcium Signaling at the ER-Mitochondrial Interface. Mol Cell. 2016;63(2):240-248. doi:10.1016/j.molcel.2016.05.040
- LeBel CP, Bondy SC. Oxygen radicals: common mediators of neurotoxicity. Neurotoxicol Teratol. 1991;13(3):341-346. doi:10.1016/0892-0362(91)90081-7
- Machado-Vieira R, Andreazza AC, Viale CI, et al. Oxidative stress parameters in unmedicated and treated bipolar subjects during initial manic episode: a possible role for lithium antioxidant effects. Neurosci Lett. 2007;421(1):33-36. doi:10.1016/j.neulet.2007.05.016
- Maes M, Fišar Z, Medina M, Scapagnini G, Nowak G, Berk M. New drug targets in depression: inflammatory, cell-mediated immune, oxidative and nitrosative stress, mitochondrial, antioxidant, and neuroprogressive pathways. And new drug candidates–Nrf2 activators and GSK-3 inhibitors. Inflammopharmacology. 2012;20(3):127-150. doi:10.1007/s10787-011-0111-7
- Behr GA, Moreira JCF, Frey BN. Preclinical and clinical evidence of antioxidant effects of antidepressant agents: implications for the pathophysiology of major depressive disorder. Oxid Med Cell Longev. 2012;2012:609421. doi:10.1155/2012/609421
- Lee S-Y, Lee S-J, Han C, Patkar AA, Masand PS, Pae C-U. Oxidative/nitrosative stress and antidepressants: targets for novel antidepressants. Prog Neuropsychopharmacol Biol Psychiatry. 2013;46:224-235. doi:10.1016/j.pnpbp.2012.09.008
- Bouvier E, Brouillard F, Molet J, et al. Nrf2-dependent persistent oxidative stress results in stress-induced vulnerability to depression. Mol Psychiatry. 2017;22(12):1701-1713. doi:10.1038/mp.2016.144
- Terblanche SE. The effects of exhaustive exercise on the activity levels of catalase in various tissues of male and female rats. Cell Biol Int. 2000;23(11):749-753. doi:10.1006/cbir.1999.0442
- Radak Z, Zhao Z, Koltai E, Ohno H, Atalay M. Oxygen consumption and usage during physical exercise: the balance between oxidative stress and ROS-dependent adaptive signaling. Antioxid Redox Signal. 2013;18(10):1208-1246. doi:10.1089/ars.2011.4498
- Gliemann L, Nyberg M, Hellsten Y. Nitric oxide and reactive oxygen species in limb vascular function: what is the effect of physical activity? Free Radic Res. 2014;48(1):71-83. doi:10.3109/10715762.2013.835045
- Powers SK, Jackson MJ. Exercise-induced oxidative stress: cellular mechanisms and impact on muscle force production. Physiol Rev. 2008;88(4):1243-1276. doi:10.1152/physrev.00031.2007
- Bramble DM, Lieberman DE. Endurance running and the evolution of Homo. Nature. 2004;432(7015):345-352. doi:10.1038/nature03052
- Maslin MA, Shultz S, Trauth MH. A synthesis of the theories and concepts of early human evolution. Philos Trans R Soc Lond B Biol Sci. 2015;370(1663). doi:10.1098/rstb.2014.0064
- Vining AQ, Nunn CL. Evolutionary change in physiological phenotypes along the human lineage. Evol Med Public Health. 2016;2016(1):312-324. doi:10.1093/emph/eow026
- Sabharwal SS, Schumacker PT. Mitochondrial ROS in cancer: initiators, amplifiers or an Achilles’ heel? Nat Rev Cancer. 2014;14(11):709-721. doi:10.1038/nrc3803
- Panieri E, Santoro MM. ROS homeostasis and metabolism: a dangerous liason in cancer cells. Cell Death Dis. 2016;7(6):e2253. doi:10.1038/cddis.2016.105
- Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure. Am J Physiol Heart Circ Physiol. 2011;301(6):H2181-2190. doi:10.1152/ajpheart.00554.2011
- Kattoor AJ, Pothineni NVK, Palagiri D, Mehta JL. Oxidative Stress in Atherosclerosis. Curr Atheroscler Rep. 2017;19(11):42. doi:10.1007/s11883-017-0678-6
- Loperena R, Harrison DG. Oxidative Stress and Hypertensive Diseases. Med Clin North Am. 2017;101(1):169-193. doi:10.1016/j.mcna.2016.08.004
- Bihan H. Stress oxydatif, insulino-sécrétion et insulino-résistance. /data/revues/00034266/00630001/61/. Published online February 16, 2008. Accessed May 31, 2020. https://www.em-consulte.com/en/article/75453
- Tiwari BK, Pandey KB, Abidi AB, Rizvi SI. Markers of Oxidative Stress during Diabetes Mellitus. J Biomark. 2013;2013. doi:10.1155/2013/378790
- Asmat U, Abad K, Ismail K. Diabetes mellitus and oxidative stress—A concise review. Saudi Pharm J. 2016;24(5):547-553. doi:10.1016/j.jsps.2015.03.013
- Butterfield DA. Amyloid beta-peptide (1-42)-induced oxidative stress and neurotoxicity: implications for neurodegeneration in Alzheimer’s disease brain. A review. Free Radic Res. 2002;36(12):1307-1313.
- Kim GH, Kim JE, Rhie SJ, Yoon S. The Role of Oxidative Stress in Neurodegenerative Diseases. Exp Neurobiol. 2015;24(4):325-340. doi:10.5607/en.2015.24.4.325
- Mateen S, Moin S, Khan AQ, Zafar A, Fatima N. Increased Reactive Oxygen Species Formation and Oxidative Stress in Rheumatoid Arthritis. PLoS ONE. 2016;11(4):e0152925. doi:10.1371/journal.pone.0152925
- Phull A-R, Nasir B, Haq IU, Kim SJ. Oxidative stress, consequences and ROS mediated cellular signaling in rheumatoid arthritis. Chem Biol Interact. 2018;281:121-136. doi:10.1016/j.cbi.2017.12.024
- da Fonseca LJS, Nunes-Souza V, Goulart MOF, Rabelo LA. Oxidative Stress in Rheumatoid Arthritis: What the Future Might Hold regarding Novel Biomarkers and Add-On Therapies. Oxid Med Cell Longev. 2019;2019:7536805. doi:10.1155/2019/7536805
- Bashir S, Harris G, Denman MA, Blake DR, Winyard PG. Oxidative DNA damage and cellular sensitivity to oxidative stress in human autoimmune diseases. Ann Rheum Dis. 1993;52(9):659-666.
- Ramani S, Pathak A, Dalal V, Paul A, Biswas S. Oxidative Stress in Autoimmune Diseases: An under dealt malice. Curr Protein Pept Sci. Published online February 13, 2020. doi:10.2174/1389203721666200214111816
- Jarrett SG, Boulton ME. Consequences of oxidative stress in age-related macular degeneration. Mol Aspects Med. 2012;33(4):399-417. doi:10.1016/j.mam.2012.03.009
- Mao H, Seo SJ, Biswal MR, et al. Mitochondrial oxidative stress in the retinal pigment epithelium leads to localized retinal degeneration. Invest Ophthalmol Vis Sci. 2014;55(7):4613-4627. doi:10.1167/iovs.14-14633
- Vinson JA. Oxidative stress in cataracts. Pathophysiology. 2006;13(3):151-162. doi:10.1016/j.pathophys.2006.05.006
- Beebe DC, Holekamp NM, Shui Y-B. Oxidative damage and the prevention of age-related cataracts. Ophthalmic Res. 2010;44(3):155-165. doi:10.1159/000316481
- Henrotin Y, Kurz B, Aigner T. Oxygen and reactive oxygen species in cartilage degradation: friends or foes? Osteoarthr Cartil. 2005;13(8):643-654. doi:10.1016/j.joca.2005.04.002
- Altindag O, Erel O, Aksoy N, Selek S, Celik H, Karaoglanoglu M. Increased oxidative stress and its relation with collagen metabolism in knee osteoarthritis. Rheumatol Int. 2007;27(4):339-344. doi:10.1007/s00296-006-0247-8
- Paździor M, Kiełczykowska M, Kurzepa J, Luchowska-Kocot D, Kocot J, Musik I. The Oxidative Stress in Knee Osteoarthritis Patients. An Attempt of Evaluation of Possible Compensatory Effects Occurring in the Disease Development. Medicina (Kaunas). 2019;55(5). doi:10.3390/medicina55050150
- Manolagas SC. From estrogen-centric to aging and oxidative stress: a revised perspective of the pathogenesis of osteoporosis. Endocr Rev. 2010;31(3):266-300. doi:10.1210/er.2009-0024
- Wilson C. Bone: Oxidative stress and osteoporosis. Nat Rev Endocrinol. 2014;10(1):3. doi:10.1038/nrendo.2013.225
- Kammeyer A, Luiten RM. Oxidation events and skin aging. Ageing Res Rev. 2015;21:16-29. doi:10.1016/j.arr.2015.01.001
- Rinnerthaler M, Bischof J, Streubel MK, Trost A, Richter K. Oxidative Stress in Aging Human Skin. Biomolecules. 2015;5(2):545-589. doi:10.3390/biom5020545
- Kunsch C, Medford RM. Oxidative stress as a regulator of gene expression in the vasculature. Circ Res. 1999;85(8):753-766. doi:10.1161/01.res.85.8.753
- Cominacini L, Pasini AF, Garbin U, et al. Oxidized low density lipoprotein (ox-LDL) binding to ox-LDL receptor-1 in endothelial cells induces the activation of NF-kappaB through an increased production of intracellular reactive oxygen species. J Biol Chem. 2000;275(17):12633-12638. doi:10.1074/jbc.275.17.12633
- Tavakoli S, Asmis R. Reactive Oxygen Species and Thiol Redox Signaling in the Macrophage Biology of Atherosclerosis. Antioxid Redox Signal. 2012;17(12):1785-1795. doi:10.1089/ars.2012.4638
- Peluso I, Morabito G, Urban L, Ioannone F, Serafini M. Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst. Endocr Metab Immune Disord Drug Targets. 2012;12(4):351-360. doi:10.2174/187153012803832602
- Gao S, Zhao D, Wang M, et al. Association Between Circulating Oxidized LDL and Atherosclerotic Cardiovascular Disease: A Meta-analysis of Observational Studies. Can J Cardiol. 2017;33(12):1624-1632. doi:10.1016/j.cjca.2017.07.015
- Nègre-Salvayre A, Augé N, Camaré C, Bacchetti T, Ferretti G, Salvayre R. Dual signaling evoked by oxidized LDLs in vascular cells. Free Radic Biol Med. 2017;106:118-133. doi:10.1016/j.freeradbiomed.2017.02.006
- Kattoor AJ, Kanuri SH, Mehta JL. Role of Ox-LDL and LOX-1 in Atherogenesis. Curr Med Chem. 2019;26(9):1693-1700. doi:10.2174/0929867325666180508100950
- Kattoor AJ, Goel A, Mehta JL. LOX-1: Regulation, Signaling and Its Role in Atherosclerosis. Antioxidants (Basel). 2019;8(7). doi:10.3390/antiox8070218
- Balzan S, Lubrano V. LOX-1 receptor: A potential link in atherosclerosis and cancer. Life Sci. 2018;198:79-86. doi:10.1016/j.lfs.2018.02.024
- Cominacini L, Garbin U, Pasini AF, et al. Antioxidants inhibit the expression of intercellular cell adhesion molecule-1 and vascular cell adhesion molecule-1 induced by oxidized LDL on human umbilical vein endothelial cells. Free Radic Biol Med. 1997;22(1-2):117-127. doi:10.1016/s0891-5849(96)00271-7
- Hansson GK, Holm J, Jonasson L. Detection of activated T lymphocytes in the human atherosclerotic plaque. Am J Pathol. 1989;135(1):169-175.
- Abedin M, Tintut Y, Demer LL. Vascular calcification: mechanisms and clinical ramifications. Arterioscler Thromb Vasc Biol. 2004;24(7):1161-1170. doi:10.1161/01.ATV.0000133194.94939.42
- Shanahan CM, Crouthamel MH, Kapustin A, Giachelli CM. Arterial Calcification in Chronic Kidney Disease: Key Roles for Calcium and Phosphate. Circ Res. 2011;109(6):697-711. doi:10.1161/CIRCRESAHA.110.234914
- Maiolino G, Rossitto G, Caielli P, Bisogni V, Rossi GP, Calò LA. The role of oxidized low-density lipoproteins in atherosclerosis: the myths and the facts. Mediators Inflamm. 2013;2013:714653. doi:10.1155/2013/714653
- Di Pietro N, Formoso G, Pandolfi A. Physiology and pathophysiology of oxLDL uptake by vascular wall cells in atherosclerosis. Vascul Pharmacol. 2016;84:1-7. doi:10.1016/j.vph.2016.05.013
- Park K-H, Park WJ. Endothelial Dysfunction: Clinical Implications in Cardiovascular Disease and Therapeutic Approaches. J Korean Med Sci. 2015;30(9):1213-1225. doi:10.3346/jkms.2015.30.9.1213
- Ames BN, Cathcart R, Schwiers E, Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA. 1981;78(11):6858-6862. doi:10.1073/pnas.78.11.6858
- Lubrano V, Balzan S. Enzymatic antioxidant system in vascular inflammation and coronary artery disease. World J Exp Med. 2015;5(4):218-224. doi:10.5493/wjem.v5.i4.218