L'hypersensibilité aux caséines de lait de vache
Abordons la seconde problématique liée à la consommation de produits laitiers, à savoir la question de l’intolérance potentielle à certaines protéines laitières, qualifiée plus justement d’hypersensibilité aux caséines de lait de vache.
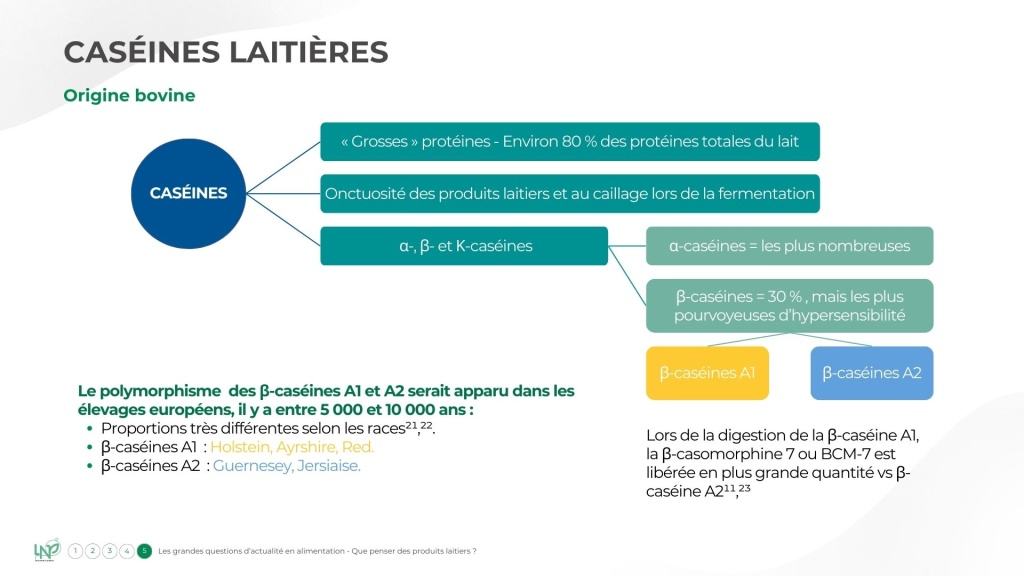
Les caséines A1 et A2
Attardons-nous quelques instants sur la composition protéique du lait de vache. Les caséines sont les protéines les plus abondantes, représentant environ 80 % des protéines totales. Viennent ensuite les protéines de lactosérum (la fameuse whey), puis l’albumine et les immunoglobulines. Les caséines sont des « grosses » protéines, contribuant notamment à l’onctuosité des produits laitiers et au caillage lors de la fermentation. Le lactosérum correspond quant à lui au petit lait s’écoulant d’une faisselle par exemple.
Il existe plusieurs types de caséines : les α, β et K-caséines. Les α-caséines sont les plus nombreuses, mais celles qui sont les plus sujettes à la question de leur tolérance sont les β-caséines. Elles représentent environ 30 % des protéines laitières et existent sous deux variantes génétiques, les β-caséines A1 et A2.
Ce polymorphisme génétique serait apparu au sein des élevages il y a entre 5 000 et 10 000 ans en Europe, ce qui expliquerait que ces protéines soient plus abondantes dans les laits de vache issus de ce continent, dans des proportions variables selon les races¹⁻².

📣 Caséines A1 et A2 : une différence selon les races laitières
Les caséines A1 sont abondantes dans le lait des races Ayrshire et Holstein (fortement exploitées dans les élevages laitiers intensifs), alors que celui des Guernesey et Jersiaise contient davantage de β-caséines A2.
Le peptide BCM-7
La digestion de la β-caséine A1 libère un peptide particulier en plus grande quantité que la β-caséine A2, la β-casomorphine 7 ou BCM-7³⁻⁴. Ce peptide est présent dans le lait maternel, mais selon une structure biochimique légèrement différente, lui conférant donc des effets eux aussi différents⁵⁻⁶.
Le BCM-7 exerce des fonctions précises. Il est particulièrement abondant au cours des deux premiers mois de lactation chez la femme afin de favoriser les fonctions digestives, la production de mucus et l’induction du sommeil chez le nouveau-né⁷. Ce peptide fait partie des peptides dits opioïdes. Des récepteurs opiacés sont en effet largement exprimés le long du tractus digestif et leur activation facilite la mobilité intestinale, la production de mucus et d’hormones⁸⁻⁹. En se fixant aux récepteurs des cellules épithéliales et des neurones intestinaux, le BCM-7 contribue ainsi à ralentir ces fonctions (comme peut d’ailleurs le faire la codéine, un dérivé opiacé utilisé pour réduire les douleurs)¹⁰⁻¹³.
📣 BCM-7 et production de mucus : protection ou déséquilibre ?
In vitro, le peptide BCM-7 augmente fortement la production de mucine (+ 169 % avec un pic 8 h après l’exposition)¹⁴⁻¹⁸. Cet effet peut apparaître favorable dans la mesure où le mucus permet de protéger la muqueuse intestinale. Néanmoins, une production excessive interfère avec l’équilibre du microbiote, donc potentiellement avec celui du système immunitaire local. Les quelques études menées chez l’homme ne mettent toutefois pas en évidence d’augmentation de production de mucus à la suite de la consommation de produits laitiers, ni d’altération de la récupération en cas de rhume ou d’asthme¹⁹⁻²¹.
Au-delà de ces effets et bien que les mécanismes ne soient pas encore bien compris, les peptides opioïdes sont suspectés d’agir comme des modulateurs de la réponse immunitaire intestinale. Le BCM-7 est présent dans le lait bovin dans des quantités suffisamment importantes pour agir à dose pharmacologique lorsqu’un individu boit un litre entier de lait, et ce d’autant plus qu’il est retrouvé intact dans les urines et le plasma des nourrissons²²⁻²⁵.
L'enzyme DPP-IV
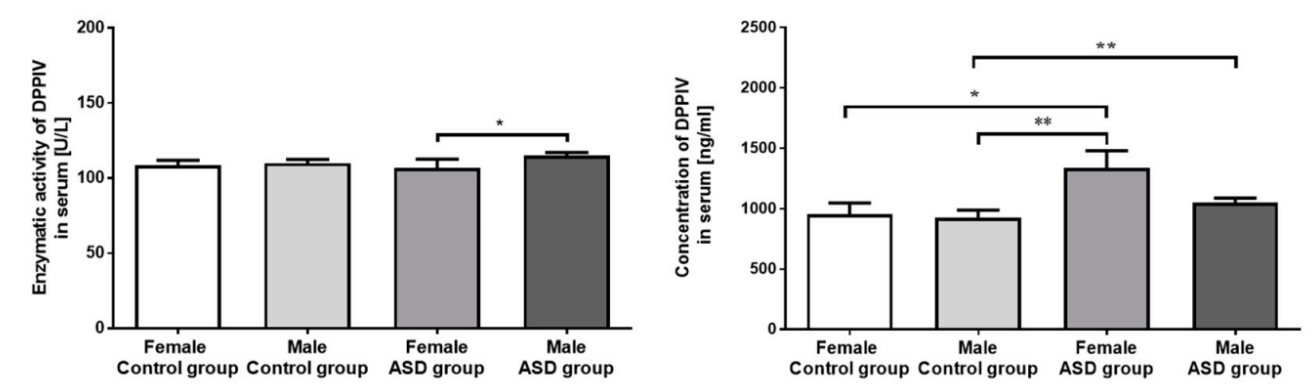
Chez la souris, la β-caséine A1 (pour rappel, la fraction de caséine à l’origine de la production de BCM-7) augmente le taux d’une enzyme, la DPP-IV. Selon les résultats d’une première étude du Dr Uhl Had menée chez la souris, la consommation d’un lait constitué de β-caséines A1 est à l’origine d’une stimulation d’une réponse immunitaire de type Th2 plus importante qu’un second lait contenant, lui, des β-caséines A2²⁶. Il s’ensuit une potentielle cascade pro-inflammatoire. La même équipe a obtenu des résultats similaires lorsqu’elle a analysé les effets spécifiques de BCM-7²⁷.
Peu d’études sont disponibles chez l’homme. Un premier protocole a toutefois comparé les effets des β-caséines A1 et A2 auprès de 21 enfants constipés²⁸. Lorsque ces derniers ont arrêté de boire du lait, 81 % ont vu leur transit se réguler. S’ils buvaient du lait à base de β-caséines A2, le pourcentage était de 79 %, mais diminuait à 57 % en cas de consommation de lait riche en β-caséines A1. Compte tenu du faible échantillon, cette étude est considérée comme peu significative. Une autre étude comprenait quant à elle 36 participants ayant bu 750 ml par jour de lait à base de β-caséines soit A1, soit A2, pendant 2 semaines²⁹. Ceux ayant consommé le lait A1 ont vu leur transit se ralentir, leurs douleurs intestinales et les marqueurs inflammatoires associés augmenter, à la différence du groupe ayant bu le lait A2.
Jarmolowska et al. 2019
Des effets à explorer
L’EFSA a été consulté en 2009 pour statuer sur les effets potentiels du BCM-7³⁰. L’organisme européen a confirmé les effets de ce dernier sur le tractus digestif. Concernant les autres conséquences potentielles, elle ne s’est pas positionnée faute de données suffisantes et arguant le principe que le BCM-7 n’est pas retrouvé au niveau plasmatique.
Les études réalisées chez l’homme publiées depuis et citées précédemment ont permis de préciser les choses, à savoir qu’il existe bien de potentiels effets du peptide BCM-7, d’ordre inflammatoire, immunitaire, voire épigénétique³¹⁻³⁴. Dans la mesure où les études menées chez l’homme sont limitées et réalisées auprès de populations hétérogènes, d’autres données demeurent encore nécessaires. L’incidence du lactose sur les symptômes signalés ne peut de plus pas être exclue. Une étude récente précise néanmoins, qu’après standardisation d’un protocole éliminant l’effet possible du lactose, les laits riches en β-caséine A2 diminuent bien les troubles du transit et les nausées comparativement aux laits riches en β-caséine A1³⁵. Les effets des caséines sur le microbiote intestinal sont bien sûr aussi à considérer dans le cadre du contrôle de l’inflammation intestinale³⁶⁻³⁷.
Serait-ce une question d'inflammation systémique débutant dans l'intestin ?
ll est fréquemment évoqué l’implication potentielle des caséines laitières (et du gluten) dans la survenue de troubles tels que les troubles du spectre autistique ou les TDA/H, voire la schizophrénie³⁸⁻⁴². Pour plusieurs auteurs, le point de départ se situerait comme souvent dans l’intestin.
Il est en effet fréquemment constaté une augmentation de la prévalence des troubles digestifs, en particulier du transit, chez les enfants souffrant de troubles du spectre autistique⁴³⁻⁴⁷. Ces troubles sont par ailleurs souvent associés à une perturbation de la réponse immunitaire, orientée vers la production de cytokines pro-inflammatoires (IL-12, TNF-alpha)⁴⁸⁻⁵⁰. Il existe probablement un lien entre ce que l’on nomme les peptides opioïdes, en particulier issus des β-caséines A1 de lait de vache, l’activité de l’enzyme DPP-IV et certains troubles d’ordre immunitaire (Voir mon article sur les péptides opioïdes). Des essais cliniques de qualité permettraient de préciser ou de réfuter cette hypothèse, notamment au regard des critiques dont elle fait l’objet dans le milieu scientifique.
À mon sens, la problématique de fond ne concerne toutefois pas tant les caséines laitières que la dysrégulation de la réponse immunitaire en réponse à l’environnement actuel, générant une inflammation de bas grade systémique. L’existence de cette dernière a été confirmée en cas de troubles du spectre autistique par le Pr Alessio Fasano et plusieurs autres experts du sujet⁵¹⁻⁵³ . L’anxiété et la dépression pourraient être, elles aussi, concernées⁵⁴.
Ainsi, davantage que de faire la chasse à la sorcière nutritionnelle, il m’apparaît plus important de replacer la question de la tolérance aux peptides alimentaires dans une réflexion bien plus systémique, au sein de laquelle l’axe intestin-cerveau est particulièrement impliqué, y compris en cas de maladies neurodégénératives⁵⁵⁻⁵⁷.
📣 DPP-IV, mitochondries et neuro-inflammation : un lien à explorer
Certains traitements médicamenteux inhibiteurs de l’activité de la DPP-IV (utilisé dans le traitement du diabète de type 2) sont capables de moduler les fonctions mitochondriales⁵⁸⁻⁶¹. Ils contribuent de plus à réduire le développement des maladies neurodégénératives en cas de diabète, renforçant l’existence d’un lien étroit entre le métabolisme de l’insuline, la neuro-inflammation et les mitochondries⁶²⁻⁶³. Il existe très peu de données relatives aux effets spécifiques des peptides opioïdes sur le fonctionnement des mitochondries. Au regard de ces éléments, la question mériterait pourtant d’être explorée.
Bibliographie
- Kamiński S, Cieślińska A, Kostyra E. Polymorphism of bovine beta-casein and its potential effect on human health. J Appl Genet. 2007;48(3):189-198. doi:10.1007/BF03195213
- Pal S, Woodford K, Kukuljan S, Ho S. Milk Intolerance, Beta-Casein and Lactose. Nutrients. 2015;7(9):7285-7297. doi:10.3390/nu7095339
- Cieślińska A, Kostyra E, Kostyra H, Oleński K, Fiedorowicz E, Kamiński S. Milk from cows of different β-casein genotypes as a source of β-casomorphin-7. Int J Food Sci Nutr. 2012;63(4):426-430. doi:10.3109/09637486.2011.634785
- Boutrou R, Gaudichon C, Dupont D, et al. Sequential release of milk protein-derived bioactive peptides in the jejunum in healthy humans. Am J Clin Nutr. 2013;97(6):1314-1323. doi:10.3945/ajcn.112.055202
- Brantl V. Novel opioid peptides derived from human beta-casein: human beta-casomorphins. Eur J Pharmacol. 1984;106(1):213-214. doi:10.1016/0014-2999(84)90702-7
- Wada Y, Lönnerdal B. Bioactive peptides released from in vitro digestion of human milk with or without pasteurization. Pediatr Res. 2015;77(4):546-553. doi:10.1038/pr.2015.10
- Jarmołowska B, Sidor K, Iwan M, et al. Changes of beta-casomorphin content in human milk during lactation. Peptides. 2007;28(10):1982-1986. doi:10.1016/j.peptides.2007.08.002
- Saito T, Nakamura T, Kitazawa H, Kawai Y, Itoh T. Isolation and structural analysis of antihypertensive peptides that exist naturally in Gouda cheese. J Dairy Sci. 2000;83(7):1434-1440. doi:10.3168/jds.S0022-0302(00)75013-2
- Zoghbi S, Trompette A, Claustre J, et al. beta-Casomorphin-7 regulates the secretion and expression of gastrointestinal mucins through a mu-opioid pathway. Am J Physiol Gastrointest Liver Physiol. 2006;290(6):G1105-1113. doi:10.1152/ajpgi.00455.2005
- Mihatsch WA, Franz AR, Kuhnt B, Högel J, Pohland F. Hydrolysis of casein accelerates gastrointestinal transit via reduction of opioid receptor agonists released from casein in rats. Biol Neonate. 2005;87(3):160-163. doi:10.1159/000082367
- Greenwood-Van Meerveld B, Gardner CJ, Little PJ, Hicks GA, Dehaven-Hudkins DL. Preclinical studies of opioids and opioid antagonists on gastrointestinal function. Neurogastroenterol Motil. 2004;16 Suppl 2:46-53. doi:10.1111/j.1743-3150.2004.00555.x
- Barnett MPG, McNabb WC, Roy NC, Woodford KB, Clarke AJ. Dietary A1 β-casein affects gastrointestinal transit time, dipeptidyl peptidase-4 activity, and inflammatory status relative to A2 β-casein in Wistar rats. Int J Food Sci Nutr. 2014;65(6):720-727. doi:10.3109/09637486.2014.898260
- Defilippi C, Gomez E, Charlin V, Silva C. Inhibition of small intestinal motility by casein: a role of beta casomorphins? Nutrition. 1995;11(6):751-754.
- Mihatsch WA, Franz AR, Kuhnt B, Högel J, Pohland F. Hydrolysis of casein accelerates gastrointestinal transit via reduction of opioid receptor agonists released from casein in rats. Biol Neonate. 2005;87(3):160-163. doi:10.1159/00008236
- Greenwood-Van Meerveld B, Gardner CJ, Little PJ, Hicks GA, Dehaven-Hudkins DL. Preclinical studies of opioids and opioid antagonists on gastrointestinal function. Neurogastroenterol Motil. 2004;16 Suppl 2:46-53. doi:10.1111/j.1743-3150.2004.00555.x
- Barnett MPG, McNabb WC, Roy NC, Woodford KB, Clarke AJ. Dietary A1 β-casein affects gastrointestinal transit time, dipeptidyl peptidase-4 activity, and inflammatory status relative to A2 β-casein in Wistar rats. Int J Food Sci Nutr. 2014;65(6):720-727. doi:10.3109/09637486.2014.898260
- Defilippi C, Gomez E, Charlin V, Silva C. Inhibition of small intestinal motility by casein: a role of beta casomorphins? Nutrition. 1995;11(6):751-754.
- Claustre J, Toumi F, Trompette A, et al. Effects of peptides derived from dietary proteins on mucus secretion in rat jejunum. Am J Physiol Gastrointest Liver Physiol. 2002;283(3):G521-528. doi:10.1152/ajpgi.00535.2001
- Pinnock CB, Graham NM, Mylvaganam A, Douglas RM. Relationship between milk intake and mucus production in adult volunteers challenged with rhinovirus-2. Am Rev Respir Dis. 1990;141(2):352-356. doi:10.1164/ajrccm/141.2.352
- Wüthrich B, Schmid A, Walther B, Sieber R. Milk consumption does not lead to mucus production or occurrence of asthma. J Am Coll Nutr. 2005;24(6 Suppl):547S-555S. doi:10.1080/07315724.2005.10719503
- Bartley J, McGlashan SR. Does milk increase mucus production? Med Hypotheses. 2010;74(4):732-734. doi:10.1016/j.mehy.2009.10.044
- Kost NV, Sokolov OY, Kurasova OB, et al. Beta-casomorphins-7 in infants on different types of feeding and different levels of psychomotor development. Peptides. 2009;30(10):1854-1860. doi:10.1016/j.peptides.2009.06.025
- Sokolov O, Kost N, Andreeva O, et al. Autistic children display elevated urine levels of bovine casomorphin-7 immunoreactivity. Peptides. 2014;56:68-71. doi:10.1016/j.peptides.2014.03.007
- Brooke-Taylor S, Dwyer K, Woodford K, Kost N. Systematic Review of the Gastrointestinal Effects of A1 Compared with A2 β-Casein. Adv Nutr. 2017;8(5):739-748. doi:10.3945/an.116.013953
- Truswell AS. The A2 milk case: a critical review. Eur J Clin Nutr. 2005;59(5):623-631. doi:10.1038/sj.ejcn.1602104
- Ul Haq MR, Kapila R, Sharma R, Saliganti V, Kapila S. Comparative evaluation of cow β-casein variants (A1/A2) consumption on Th2-mediated inflammatory response in mouse gut. Eur J Nutr. 2014;53(4):1039-1049. doi:10.1007/s00394-013-0606-7
- Ul Haq DM, Kapila R, Saliganti V. Consumption of β-casomorphins-7/5 induce inflammatory immune response in mice gut through Th2 pathway. Journal of Functional Foods. 2014;8:150-160. doi:10.1016/j.jff.2014.03.018
- Crowley ET, Williams LT, Roberts TK, Dunstan RH, Jones PD. Does milk cause constipation? A crossover dietary trial. Nutrients. 2013;5(1):253-266. doi:10.3390/nu5010253
- Ho S, Woodford K, Kukuljan S, Pal S. Comparative effects of A1 versus A2 beta-casein on gastrointestinal measures: a blinded randomised cross-over pilot study. Eur J Clin Nutr. 2014;68(9):994-1000. doi:10.1038/ejcn.2014.127
- Trivedi MS, Shah JS, Al-Mughairy S, et al. Food-derived opioid peptides inhibit cysteine uptake with redox and epigenetic consequences. J Nutr Biochem. 2014;25(10):1011-1018. doi:10.1016/j.jnutbio.2014.05.004
- Trivedi M, Zhang Y, Lopez-Toledano M, Clarke A, Deth R. Differential neurogenic effects of casein-derived opioid peptides on neuronal stem cells: implications for redox-based epigenetic changes. J Nutr Biochem. 2016;37:39-46. doi:10.1016/j.jnutbio.2015.10.012
- Jianqin S, Leiming X, Lu X, Yelland GW, Ni J, Clarke AJ. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows’ milk. Nutr J. 2016;15(1):35. doi:10.1186/s12937-016-0147-2
- He M, Sun J, Jiang ZQ, Yang YX. Effects of cow’s milk beta-casein variants on symptoms of milk intolerance in Chinese adults: a multicentre, randomised controlled study. Nutr J. 2017;16(1):72. doi:10.1186/s12937-017-0275-0
- Milan AM, Shrestha A, Karlström HJ, et al. Comparison of the impact of bovine milk β-casein variants on digestive comfort in females self-reporting dairy intolerance: a randomized controlled trial. Am J Clin Nutr. 2020;111(1):149-160. doi:10.1093/ajcn/nqz279
- Zhu Y, Lin X, Zhao F, et al. Meat, dairy and plant proteins alter bacterial composition of rat gut bacteria. Sci Rep. 2015;5:15220. doi:10.1038/srep15220
- Llewellyn SR, Britton GJ, Contijoch EJ, et al. Interactions between diet and the intestinal microbiota alter intestinal permeability and colitis severity in mice. Gastroenterology. 2018;154(4):1037-1046.e2. doi:10.1053/j.gastro.2017.11.030
- Masarwi M, Solnik H, Phillip M, et al. Food restriction followed by refeeding with a casein- or whey-based diet differentially affects the gut microbiota of pre-pubertal male rats. J Nutr Biochem. 2018;154(4):1037-1046.e2. doi:10.1016/j.jnutbio.2017.08.014
- Sun Z, Cade JR. A Peptide Found in Schizophrenia and Autism Causes Behavioral Changes in Rats. Autism. 1999;3(1):85-95. doi:10.1177/1362361399003001007
- Whiteley P, Haracopos D, Knivsberg AM, et al. The ScanBrit randomised, controlled, single-blind study of a gluten- and casein-free dietary intervention for children with autism spectrum disorders. Nutr Neurosci. 2010;13(2):87-100. doi:10.1179/147683010X12611460763922
- Erić-Nikolić A, Matić IZ, Dord̄ević M, et al. Serum DPPIV activity and CD26 expression on lymphocytes in patients with benign or malignant breast tumors. Immunobiology. 2011;216(8):942-946. doi:10.1016/j.imbio.2011.01.005
- Marí-Bauset S, Zazpe I, Mari-Sanchis A, Llopis-González A, Morales-Suárez-Varela M. Evidence of the gluten-free and casein-free diet in autism spectrum disorders: a systematic review. J Child Neurol. 2014;29(12):1718-1727. doi:10.1177/0883073814531330
- Hartman RE, Patel D. Dietary Approaches to the Management of Autism Spectrum Disorders. Adv Neurobiol. 2020;24:547-571. doi:10.1007/978-3-030-30402-7_19
- Valicenti-McDermott M, McVicar K, Rapin I, Wershil BK, Cohen H, Shinnar S. Frequency of gastrointestinal symptoms in children with autistic spectrum disorders and association with family history of autoimmune disease. J Dev Behav Pediatr. 2006;27(2 Suppl):S128-136. doi:10.1097/00004703-200604002-00011
- Ibrahim SH, Voigt RG, Katusic SK, Weaver AL, Barbaresi WJ. Incidence of gastrointestinal symptoms in children with autism: a population-based study. Pediatrics. 2009;124(2):680-686. doi:10.1542/peds.2008-2933
- Chaidez V, Hansen RL, Hertz-Picciotto I. Gastrointestinal problems in children with autism, developmental delays or typical development. J Autism Dev Disord. 2014;44(5):1117-1127. doi:10.1007/s10803-013-1973-x
- Kushak RI, Buie TM, Murray KF, et al. Evaluation of Intestinal Function in Children With Autism and Gastrointestinal Symptoms. J Pediatr Gastroenterol Nutr. 2016;62(5):687-691. doi:10.1097/MPG.0000000000001174
- Lefter R, Ciobica A, Timofte D, Stanciu C, Trifan A. A Descriptive Review on the Prevalence of Gastrointestinal Disturbances and Their Multiple Associations in Autism Spectrum Disorder. Medicina (Kaunas). 2019;56(1). doi:10.3390/medicina56010011
- Coury DL, Ashwood P, Fasano A, et al. Gastrointestinal conditions in children with autism spectrum disorder: developing a research agenda. Pediatrics. 2012;130 Suppl 2:S160-168. doi:10.1542/peds.2012-0900N
- Jyonouchi H, Geng L, Davidow AL. Cytokine profiles by peripheral blood monocytes are associated with changes in behavioral symptoms following immune insults in a subset of ASD subjects: an inflammatory subtype? J Neuroinflammation. 2014;11:187. doi:10.1186/s12974-014-0187-2
- Samsam M, Ahangari R, Naser SA. Pathophysiology of autism spectrum disorders: revisiting gastrointestinal involvement and immune imbalance. World J Gastroenterol. 2014;20(29):9942-9951. doi:10.3748/wjg.v20.i29.9942
- Masarwi M, Solnik HI, Phillip M, et al. Food restriction followed by refeeding with a casein- or whey-based diet differentially affects the gut microbiota of pre-pubertal male rats. J Nutr Biochem. 2018;51:27-39. doi:10.1016/j.jnutbio.2017.08.014
- MacFabe D. Autism: Metabolism, Mitochondria, and the Microbiome. Glob Adv Health Med. 2013;2(6):52-66. doi:10.7453/gahmj.2013.089
- Doenyas C. Novel Personalized Dietary Treatment for Autism Based on the Gut-Immune-Endocrine-Brain Axis. Front Endocrinol (Lausanne). 2019;10. doi:10.3389/fendo.2019.00508
- Stevens BR, Goel R, Seungbum K, et al. Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression. Gut. 2018;67(8):1555-1557. doi:10.1136/gutjnl-2017-314759
- Hsiao EY, McBride SW, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell. 2013;155(7):1451-1463. doi:10.1016/j.cell.2013.11.024
- Rodrigo L, Hernández-Lahoz C, Lauret E, et al. Gluten ataxia is better classified as non-celiac gluten sensitivity than as celiac disease: a comparative clinical study. Immunol Res. 2016;64(2):558-564. doi:10.1007/s12026-015-8750-1
- Hadjivassiliou M, Rao DG, Grünewald RA, et al. Neurological Dysfunction in Coeliac Disease and Non-Coeliac Gluten Sensitivity. Am J Gastroenterol. 2016;111(4):561-567. doi:10.1038/ajg.2015.434
- Zhao K, Luo G, Giannelli S, Szeto HH. Mitochondria-targeted peptide prevents mitochondrial depolarization and apoptosis induced by tert-butyl hydroperoxide in neuronal cell lines. Biochem Pharmacol. 2005;70(12):1796-1806. doi:10.1016/j.bcp.2005.08.022
- Pintana H, Apaijai N, Chattipakorn N, Chattipakorn SC. DPP-4 inhibitors improve cognition and brain mitochondrial function of insulin-resistant rats. J Endocrinol. 2013;218(1):1-11. doi:10.1530/JOE-12-0521
- Liu L, Liu J, Tian XY, et al. Uncoupling protein-2 mediates DPP-4 inhibitor-induced restoration of endothelial function in hypertension through reducing oxidative stress. Antioxid Redox Signal. 2014;21(11):1571-1581. doi:10.1089/ars.2013.5519
- Aroor AR, Habibi J, Ford DA, et al. Dipeptidyl peptidase-4 inhibition ameliorates Western diet-induced hepatic steatosis and insulin resistance through hepatic lipid remodeling and modulation of hepatic mitochondrial function. Diabetes. 2015;64(6):1988-2001. doi:10.2337/db14-0804
- Sa-Nguanmoo P, Tanajak P, Kerdphoo S, et al. SGLT2-inhibitor and DPP-4 inhibitor improve brain function via attenuating mitochondrial dysfunction, insulin resistance, inflammation, and apoptosis in HFD-induced obese rats. Toxicol Appl Pharmacol. 2017;333:43-50. doi:10.1016/j.taap.2017.08.005
- Cheng H, Gang X, Liu Y, Wang G, Zhao X, Wang G. Mitochondrial dysfunction plays a key role in the development of neurodegenerative diseases in diabetes. Am J Physiol Endocrinol Metab. 2020;318(5):E750-E764. doi:10.1152/ajpendo.00179.2019


Partagez cet article !